-
Diese
Anmeldung ist eine Continuation-in-part der gleichzeitig anhängigen U.S.-Anmeldung
Seriennr. 08/707,776, eingereicht am 4. September 1996.
-
Technisches Gebiet
-
Diese
Erfindung betrifft neue halbsynthetische Makrolide mit antibakterieller
Aktivität,
pharmazeutische Zusammensetzungen, die diese Verbindungen umfassen,
und ein medizinisches Behandlungsverfahren. Genauer betrifft diese
Erfindung 6-O-substituierte Erythromycin-Ketolidderivate, Zusammensetzungen,
die diese Verbindungen enthalten, und ein Verfahren zur Behandlung
bakterieller Infektionen.
-
Hintergrund der Erfindung
-
Erythromycine
A bis D, dargestellt durch Formel (I),
sind gut
bekannte und wirksame antibakterielle Wirkstoffe, die zur Behandlung
und Vorbeugung bakterieller Infektionen weit verbreitet verwendet
werden. Wie bei anderen antibakteriellen Wirkstoffen sind jedoch
Bakterienstämme
mit Resistenz oder nicht ausreichender Empfindlichkeit gegenüber Erythromycin identifiziert
worden. Auch hat Erythromycin A nur schwache Wirkung auf gramnegative
Bakterien. Daher besteht eine kontinuierliche Notwendigkeit, neue
Erythromycin-Derivat-Verbindungen
zu identifizieren, die verbesserte antibakterielle Wirkung haben,
die über
weniger Potential zur Entwicklung von Resistenz verfügen, die
die gewünschte gramnegative
Aktivität
besitzen oder die unerwartete Selektivität gegenüber Ziel-Mikroorganismen aufweisen. Folglich
haben zahlreiche Forscher chemische Derivate von Erythromycin in
einem Versuch hergestellt, Analoge mit modifizierten oder verbesserten
Profilen antibiotischer Wirkung zu gewinnen.
-
Das
United States-Patent 5,444,051 offenbart 6-O-substituierte-3-Oxoerythromycin
A-Derivate, in denen die Substituenten gewählt sind aus Alkyl, -CONH2, -CONHC(O)Alkyl und -CONHSO2Alkyl.
Die PCT-Anmeldung WO 97/10251, veröffentlicht am 20. März 1997,
offenbart 6-O-Methyl-3-descladinose-Erythromycinderivate.
-
Die
Europäische
Patentanmeldung 596802, veröffentlicht
am 11. Mai 1994, offenbart bicyclische 6-O-Methyl-3-oxoerythromycin
A-Derivate.
-
Die
PCT-Anmeldung WO 92/09614, veröffentlicht
am 11. Juni 1992, offenbart tricyclische 6-O-Methylerythromycin
A-Derivate. EP-A-0487411 betrifft Erythromycinderivate, deren Herstellung,
gewonnene Intermediate und deren Anwendung als Medikamente. Die
darin offenbarten Erythromycin-Analoge umfassen jedoch nicht die
C9N-C11N-Brücken-bildende
Gruppe.
-
WO-A-9717356
offenbart tricyclische Erythromycinverbindungen und pharmazeutisch
verträgliche Salze
und Ester davon; es gibt jedoch keine spezifische Offenbarung, worin
der Substituent R nicht OCH3 ist.
-
EP-A-0638585
betrifft Derivate von Erythromycin, insbesondere 5-O-Desosaminylerythronolid-Derivate,
pharmazeutisch verträgliche
Säureadditionssalze
davon und Intermediate für
die Herstellung davon. Diese Verbindungen umfassen nur ein 6-O-Me.
-
Zusammenfassung der Erfindung
-
Die
vorliegende Erfindung stellt eine neue Klasse von 6-O- substituierten Erythromycinderivaten
mit erhöhter
Säurebeständigkeit
im Vergleich zu Erythromycin A und 6-O-Methylerythromycin A und verstärkter Wirkung
auf gramnegative Bakterien und makrolidresistente grampositive Bakterien
bereit.
-
In
einer Ausführungsform
liefert die vorliegende Erfindung Verbindungen, die gewählt sind
aus der Gruppe bestehend aus
oder ein
pharmazeutisch verträgliches
Salz, Ester oder Prodrug davon,
worin
entweder
Y
und Z zusammengenommen eine Gruppe X definieren,
worin
X
gewählt
ist aus der Gruppe bestehend aus
(1)=O,
(2)=N-OH,
(3)=N-O-R
1, worin R
1 gewählt ist
aus der Gruppe bestehend aus
(a) unsubstituiertem C
1-C
12-Alkyl,
(b)
C
1-C
12-Alkyl, substituiert
mit Aryl,
(c) C
1-C
12-Alkyl,
substituiert mit substituiertem Aryl,
(d) C
1-C
12-Alkyl, substituiert mit Heteroaryl,
(e)
C
1-C
12-Alkyl, substituiert
mit substituiertem Heteroaryl,
(f) C
3-C
12-Cycloalkyl und
(g) -Si- (R
2) (R
3) (R
4), worin R
2, R
3 und R
4 jeweils unabhängig gewählt sind
aus C
1-C
12-Alkyl
und Aryl; und
(4)=N-O-C (R
5) (R
6)-O-R
1, worin R
1 wie zuvor definiert ist und R
5 und
R
6 jeweils unabhängig gewählt sind aus der Gruppe bestehend
aus
(a) Wasserstoff,
(b) unsubstituiertem C
1-C
12-Alkyl,
(c) C
1-C
12-Alkyl, substituiert mit Aryl,
(d)
C
1-C
12-Alkyl, substituiert
mit substituiertem Aryl,
(e) C
1-C
12-Alkyl, substituiert mit Heteroaryl und
(f)
C
1-C
12-Alkyl, substituiert
mit substituiertem Heteroaryl oder
R
5 und
R
6, zusammengenommen mit dem Atom, an welches
sie gebunden sind, einen C
3-C
12-Cycloalkylring bilden;
oder
eines von Y und Z Wasserstoff ist und das andere gewählt ist
aus einer Gruppe bestehend aus
(1) Wasserstoff,
(2) Hydroxy,
(3)
geschütztem
Hydroxy und
(4) NR
7R
8,
worin R
7 und R
8 unabhängig gewählt sind
aus Wasserstoff und C
1-C
6-Alkyl
oder R
7 und R
8 zusammengenommen
werden mit dem Stickstoffatom, an welches sie gebunden sind, um
einen 3- bis 7-gliedrigen Ring zu bilden, der, wenn der Ring ein
5- bis 7-gliedriger
Ring ist, wahlweise eine Heterofunktion enthalten kann, die gewählt ist
aus der Gruppe bestehend aus -O-, -NH-, -N(C
1-C
6-Alkyl-) -, -N(Aryl) -, -N(Aryl-C
1-C
6-alkyl-)-, -N(substituiertem-Aryl-C
1-C
6-alkyl-)-, -N(Heteroaryl)-,
-N(Heteroaryl-C
1-C
6-alkyl-)-,
-N(substituiertem-Heteroaryl-C
1-C
6-alkyl-)- und -S- oder -S(O)
n-,
worin n 1 oder 2 ist,
R
a Wasserstoff
oder Hydroxy ist;
R
b gewählt ist
aus der Gruppe bestehend aus Hydroxy -O-C(O)-NH
2 und
-O-C(O)-Imidazolyl;
R
c Wasserstoff
oder eine Hydroxyschutzgruppe ist;
L Methylen oder Carbonyl
ist, vorausgesetzt, dass, wenn L Methylen ist, T -O- ist,
T
gewählt
ist aus der Gruppe bestehend aus -O-, -NH- und -N(W-R
d)-,
worin
W abwesend ist oder gewählt ist aus der Gruppe bestehend
aus -O-, -NH-CO-, -N=CH- und -NHund
R
d gewählt ist
aus der Gruppe bestehend aus
(1) Wasserstoff,
(2) C
1-C
6-Alkyl, wahlweise
substituiert mit einem oder mehreren Substituenten, gewählt aus
der Gruppe bestehend aus
(a) Aryl,
(b) substituiertem
Aryl,
(c) Heteroaryl,
(d) substituiertem Heteroaryl,
(e)
Hydroxy,
(f) C
1-C
6-Alkoxy,
(g)
NR
7R
8, worin R
7 und R
8 wie zuvor
definiert sind, und
(h) -CH
2-M-R
9,
worin M gewählt ist aus der Gruppe bestehend
aus:
(i) -C(O)-NH-,
(ii) -NH-C(O)-,
(iii) -NH-,
(iv)
-N=,
(v) -N(CH
3)-,
(vi) -NH-C(O)-O-,
(vii)
-NH-C(O)-NH-,
(viii) -O-C(O)-NH-,
(ix) -O-C(O)-O-,
(x)
-O-,
(xi) -S(O)
n-, worin n 0, 1 oder
2 ist,
(xii) -C(O)-O-,
(xiii) -O-C(O)- und
(xiv)
-C(O)-, und
R
9 gewählt ist aus der Gruppe bestehend
aus:
(i) C
1-C
6-Alkyl,
wahlweise substituiert mit einem Substituenten gewählt aus
der Gruppe bestehend aus
(aa) Aryl,
(bb) substituiertem
Aryl,
(cc) Heteroaryl und
(dd) substituiertem Heteroaryl,
(ii)Aryl,
(iii)
substituiertem Aryl,
(iv) Heteroaryl,
(v) substituiertem
Heteroaryl und
(vi) Heterocycloalkyl,
(3) C
3-C
7-Cycloalkyl,
(4) Aryl,
(5) substituiertem
Aryl,
(6) Heteroaryl und
(7) substituiertem Heteroaryl;
R
ist gewählt
aus der Gruppe bestehend aus
(1) Methyl, substituiert mit einem
Anteil gewählt
aus der Gruppe bestehend aus
(a) CN,
(b) F,
(c) -CO
2R
10, worin R
10 C
1-C
3-Alkyl
oder Arylsubstituiertes C
1-C
3-Alkyl
oder Heteroarylsubstituiertes C
1-C
3-Alkyl ist,
(d) S(O)
nR
10, worin n 0, 1 oder 2 und R
10 wie
zuvor definiert ist,
(e) NHC(O)R
10,
worin R
10 wie zuvor definiert ist,
(f)
NHC(O) NR
11R
12,
worin R
11 und R
12 unabhängig gewählt sind
aus Wasserstoff, C
1-C
3-Alkyl,
C
1-C
3-Alkyl substituiert
mit Aryl, substituiertem Aryl, Heteroaryl, substituiertem Heteroaryl,
(g)
Aryl,
(h) substituiertem Aryl,
(i) Heteroaryl und
(j)
substituiertem Heteroaryl,
(2) C
2-C
10-Alkyl,
(3) C
2-C
10-Alkyl, substituiert mit einem oder mehreren
Substituenten, gewählt
aus der Gruppe bestehend aus
(a) Halogen,
(b) Hydroxy,
(c)
C
1-C
3-Alkoxy,
(d)
C
1-C
3-Alkoxy-C
1-C
3-alkoxy,
(e)
Oxo,
(f) -N
3,
(g) -CHO,
(h)
O-SO
2- (substituiertes C
1-C
6-Alkyl),
(i) -NR
13R
14, worin R
13 und
R
14 gewählt
sind aus der Gruppe bestehend aus
(i) Wasserstoff,
(ii)
C
1-C
12-Alkyl,
(iii)
substituiertem C
1-C
12-Alkyl,
(iv)
C
1-C
12-Alkenyl,
(v)
substituiertem C
1-C
12-Alkenyl,
(vi)
C
1-C
12-Alkinyl,
(vii)
substituiertem C
1-C
12-Alkinyl,
(viii)
Aryl,
(ix) C
3-C
8-Cycloalkyl,
(x)
substituiertem C
3-C
8-Cycloalkyl,
(xi)
substituiertem Aryl,
(xii) Heterocycloalkyl,
(xiii) substituiertem
Heterocycloalkyl,
(xiv) C
1-C
12-Alkyl, substituiert mit Aryl,
(xv)
C
1-C
12-Alkyl, substituiert
mit substituiertem Aryl,
(xvi) C
1-C
12-Alkyl, substituiert mit Heterocycloalkyl,
(xvii)
C
1-C
12-Alkyl, substituiert
mit substituiertem Heterocycloalkyl,
(xviii) C
1-C
12-Alkyl, substituiert mit C
3-C
8-Cycloalkyl,
(xix)
C
1-C
12-Alkyl, substituiert
mit substituiertem C
3-C
8-Cycloalkyl,
(xx)
Heteroaryl,
(xxi) substituiertem Heteroaryl,
(xxii) C
1-C
12-Alkyl, substituiert
mit Heteroaryl, und
(xxiii) C
1-C
12-Alkyl, substituiert mit substituiertem
Heteroaryl, oder
R
13 und R
19 zusammengenommen
werden mit dem Atom, an welches sie gebunden sind, um einen 3-10-gliedrigen Heterocycloalkylring
zu bilden, der mit einem oder mehreren Substituenten substituiert
sein kann, die unabhängig
gewählt
sind aus der Gruppe bestehend aus
(i) Halogen,
(ii) Hydroxy,
(iii)
C
1-C
3-Alkoxy,
(iv)
C
1-C
3-Alkoxy-C
1-C
3-alkoxy,
(v)
Oxo,
(vi) C
1-C
3-Alkyl,
(vii)
Halo-C
1-C
3-alkyl
und
(viii) C
1-C
3-Alkoxy-C
1-C
3-alkyl,
(j)
-CO
2R
10, worin R
10 wie zuvor definiert ist, (k) -C(O)NR
11R
12, worin R
11 und R
12 wie zuvor
definiert sind,
(l)=N-O-R
10, worin
R
10 wie zuvor definiert ist,
(m) -C≡N,
(n)
O-S(O)
nR
10, worin
n 0, 1 oder 2 ist und R
10 wie zuvor definiert
ist,
(o) Aryl,
(p) substituiertem Aryl,
(q) Heteroaryl,
(r)
substituiertem Heteroaryl,
(s) C
3-C
8-Cycloalkyl,
(t) substituiertem C
3-C
8-Cycloalkyl,
(u)
C
1-C
12-Alkyl, substituiert
mit Heteroaryl,
(v) Heterocycloalkyl,
(w) substituiertem
Heterocycloalkyl,
(x) NHC(O)R
10, worin
R
10 wie zuvor definiert ist,
(y) NHC(O)NR
11R
12, worin R
11 und R
12 wie zuvor
definiert sind,
(z) =N-NR
13R
14, worin R
13 und
R
14 wie zuvor definiert sind,
(aa)
=N-R
9, worin R
9 wie
zuvor definiert ist,
(bb) =N-NHC(O)R
10,
worin R
10 wie zuvor definiert ist, und
(cc)
=N-NHC(O)NR
11R
12,
worin R
11 und R
12 wie
zuvor definiert sind;
(4) C
3-Alkenyl,
substituiert mit einem Anteil gewählt aus der Gruppe bestehend
aus
(a) Halogen,
(b) -CHO,
(c) -CO
2R
10, worin R
10 wie
zuvor definiert ist,
(d) -C(O)-R
9,
worin R
9 wie zuvor definiert ist,
(e)
-C(O)NR
11R
12, worin
R
11 und R
12 wie
zuvor definiert sind,
(f) -C≡N,
(g) Aryl,
(h)
substituiertem Aryl,
(i) Heteroaryl,
(j) substituiertem
Heteroaryl,
(k) C
3-C
7-Cycloalkyl
und
(l) C
1-C
12-Alkyl,
substituiert mit Heteroaryl,
(5) C
4-C
10-Alkenyl;
(6) C
4-C
10-Alkenyl, substituiert mit einem oder mehreren
Substituenten gewählt
aus der Gruppe bestehend aus
(a) Halogen,
(b) C
1-C
3-Alkoxy,
(c)
Oxo,
(d) -CHO,
(e) -CO
2R
10, worin R
10 wie
zuvor definiert ist,
(f) -C(O)NR
11R
12, worin R
11 und
R
12 wie zuvor definiert sind,
(g) -NR
13R
14, worin R
13 und R
14 wie zuvor
definiert sind,
(h) =N-O-R
10, worin
R
10 wie zuvor definiert ist,
(i) -C≡N,
(j)
O-S(O)
nR
10, worin
n 0, 1 oder 2 und R
10 wie zuvor definiert
ist,
(k) Aryl,
(l) substituiertem Aryl,
(m) Heteroaryl,
(n)
substituiertem Heteroaryl,
(o) C
3-C
7-Cycloalkyl,
(p) C
1-C
12-Alkyl, substituiert mit Heteroaryl,
(q)
NHC(O)R
10, worin R
10 wie
zuvor definiert ist,
(r) NHC(O)NR
11R
12, worin R
11 und
R
12 wie zuvor definiert sind,
(s) =N-NR
13R
14, worin R
13 und R
14 wie zuvor
definiert sind,
(t) =N-R
9, worin R
9 wie zuvor definiert ist,
(u) =N-NHC(O)R
10, worin R
10 wie
zuvor definiert ist, und
(v) =N-NHC(O)NR
11R
12, worin R
11 und
R
12 wie zuvor definiert sind;
(7) C
3-C
10-Alkinyl und
(8)
C
3-C
10-Alkinyl,
substituiert mit einem oder mehreren Substituenten, gewählt aus
der Gruppe bestehend aus
(a) Trialkylsilyl,
(b) Aryl,
(c)
substituiertem Aryl,
(d) Heteroaryl und
(e) substituiertem
Heteroaryl; und
A, B, D und E, vorausgesetzt, dass mindestens
zwei von A, B, D und E Wasserstoff sind, sind unabhängig gewählt aus
der Gruppe bestehend aus:
(a) Wasserstoff;
(b) C
1-C
6-Alkyl, wahlweise
substituiert mit einem oder mehreren Substituenten, gewählt aus
der Gruppe bestehend aus:
(i) Aryl;
(ii) substituiertem
Aryl;
(iii) Heteroaryl;
(iv) substituiertem Heteroaryl;
(v)
Heterocycloalkyl;
(vi) Hydroxy;
(vii) C
1-C
6-Alkoxy;
(viii) Halogen, bestehend
aus Br, Cl, F oder I, und
(ix) NR
7R
8, worin R
7 und R
8 wie zuvor definiert sind,
(c) C
3-C
7-Cycloalkyl;
(d)
Aryl;
(e) substituiertem Aryl;
(f) Heteroaryl;
(g)
substituiertem Heteroaryl;
(h) Heterocycloalkyl und
(i)
einer Gruppe gewählt
aus der Option (b) oben,
weiter substituiert mit -M-R
9, worin M und R
9 wie
zuvor definiert sind, oder
ein beliebiges Paar von Substituenten,
bestehend aus AB, AD, AE, BD, BE oder DE, wird zusammengenommen
mit dem Atom oder den Atomen, an welche(s) sie gebunden sind, um
einen 3- bis 7-gliedrigen Ring zu bilden, der wahlweise eine Heterofunktion
enthält,
die gewählt
ist aus der Gruppe bestehend aus -O-, -NH-, -N(C
1-C
6-Alkyl-)-, -N(Aryl-C
1-C
6-alkyl-) -, -N(substituiertem-Aryl-C
1-C
6-alkyl-) -, -N(Heteroaryl-C
1-C
6-alkyl-)-, -N(substituiertem-Heteroaryl-C
1-C
6-alkyl-)-, -S-
oder -S(O)
n-, worin n 1 oder 2 ist, -C (O)
-NH-, -C(O) -NR
12-, worin R
12 wie
zuvor definiert ist, -NH-C(O) -, -NR12-C(O)-, worin R
12 wie
zuvor definiert ist, und -C(=NH)-NH-.
-
Die
vorliegende Erfindung stellt auch pharmazeutische Zusammensetzungen
bereit, die eine therapeutisch wirksame Menge einer Verbindung wie
oben definiert in Kombination mit einem pharmazeutisch verträglichen
Träger
umfassen.
-
Die
Erfindung betrifft weiterhin ein Verfahren zur Behandlung bakterieller
Infektionen in einem Wirtssäugetier,
das eine solche Behandlung benötigt,
welches die Verabreichung einer therapeutisch wirksamen Menge einer
Verbindung wie oben definiert an ein Säugetier, das eine solche Behandlung
benötigt,
umfasst.
-
In
einem weiteren Aspekt der vorliegenden Erfindung werden Verfahren
zur Herstellung 6-O-substituierter Makrolidderivate mit der Formel
(II), (III), (IV), (IV-A) und (V) oben bereitgestellt.
-
Ausführliche Beschreibung der Erfindung
-
In
einer Ausführungsform
der vorliegenden Erfindung sind Verbindungen mit der Formel II,
worin X, Y, R, Ra und Rc
wie zuvor beschrieben sind.
-
Eine
repräsentative
Verbindung mit der Formel II ist die Verbindung mit der Formel (II),
Ra ist OH, Rc ist
Benzoyl, R ist Allyl.
-
In
einer bevorzugten Ausführungsform
der Verbindungen der Formel II der Erfindung sind Verbindungen,
worin Ra Hydroxy und Rc Wasserstoff
ist.
-
In
einer stärker
bevorzugten Ausführungsform
der Verbindungen mit der Formel II der Erfindung sind Verbindungen
mit der Formel VIII,
worin X O oder NOH ist und
R wie zuvor definiert ist.
-
Verbindungen,
die repräsentativ
für diese
Ausführungsform
sind, schließen
folgende ein, sind aber nicht darauf beschränkt:
Verbindung mit der
Formel (VIII): X ist O, R ist Allyl;
Verbindung mit der Formel
(VIII): X ist NOH, R ist Allyl;
Verbindung mit der Formel (VIII):
X ist O, R ist Propyl;
Verbindung mit der Formel (VIII): X
ist O, R ist -CH2CHO;
Verbindung mit
der Formel (VIII): X ist O, R ist -CH2CH=NOH;
Verbindung
mit der Formel (VIII): X ist NOH, R ist -CH2CH=NOH;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CN;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH2NH2;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH2NHCH2-Phenyl;
Verbindung
mit der Formel (VIII) : X ist O, R ist -CH2CH2NHCH2CH2-Phenyl;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH2NHCH(CO2CH3)CH2-Phenyl;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH2NHCH2-(4-Pyridyl);
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH2NHCH2-(4-Chinolyl);
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH=CH-Phenyl;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH2CH2-Phenyl;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH=CH-(4-Methoxyphenyl);
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH=CH-(4-Chlorphenyl);
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH=CH-(3-Chinolyl);
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH2CH2OH;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2C(O)OH;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH2NHCH3;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH2NHCH2OH;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH2N(CH3)2;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH2(1-Morpholinyl);
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2C(O)NH2;
Verbindung mit der Formel (VIII):
X ist O, R ist -CH2NHC(O)NH2;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2NHC(O)CH3;
Verbindung mit der Formel (VIII):
X ist O, R ist -CH2F;
Verbindung mit
der Formel (VIII): X ist O, R ist -CH2CH2OCH3;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH3;
Verbindung mit der Formel (VIII):
X ist O, R ist -CH2CH=CH(CH3)2;
Verbindung mit der Formel (VIII):
X ist O, R ist -CH2CH2CH(CH3) CH3;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH2OCH2CH2OCH3;
Verbindung mit der Formel (VIII):
X ist O, R ist -CH2SCH3;
Verbindung
mit der Formel (VIII): X ist O, R ist -Cyclopropyl;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2OCH3;
Verbindung mit der Formel (VIII):
X ist O, R ist -CH2CH2F;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2-Cyclopropyl;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH2CHO;
Verbindung mit der Formel (VIII):
X ist O, R ist -C(O)CH2CH2CH3;
Verbindung mit der Formel (VIII):
X ist O, R ist -CH2-(4-Nitrophenyl);
Verbindung mit der
Formel (VIII): X ist O, R ist -CH2-(4-Chlorphenyl);
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2-(4-Methoxyphenyl);
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2-(4-Cyanophenyl);
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH=CHC(O)
OCH3;
Verbindung mit der Formel (VIII):
X ist O, R ist -CH2CH=CHC(O) OCH2CH3;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH=CHCH3;
Verbindung mit der Formel (VIII)
: X ist O, R ist -CH2CH=CHCH2CH3;
Verbindung mit der Formel (VIII):
X ist O, R ist -CH2CH=CHCH2CH2CH3;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH=CHSO2-Phenyl;
Verbindung
mit der Formel (VIII) : X ist O, R ist -CH2C≡C-Si(CH3)3;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2C=CCH2CH2CH2CH2CH2CH3;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2C≡CCH3;
Verbindung mit der Formel (VIII):
X ist O, R ist -CH2-(2- Pyridyl);
Verbindung mit der Formel
(VIII): X ist O, R ist -CH2-(3-Pyridyl);
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2-(4-Pyridyl);
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2-(4-Chinolyl);
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2NO2;
Verbindung mit der Formel (VIII):
X ist O, R ist -CH2C(O)OCH3;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2C(O)-Phenyl;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2C(O)CH2CH3;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2Cl;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2S(O)2-Phenyl;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH=CHBr;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH=CH-(4-Chinolyl);
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH2CH2-(4-Chinolyl);
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH=CH-CH-(5-Chinolyl);
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH2CH2-(5-Chinolyl);
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH=CH-(4-Benzoxazolyl);
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH=CH-(7-Benzimidazolyl);
Verbindung
mit der Formel (VIII): X ist O, R ist CH2-(3-Iodophenyl);
Verbindung
mit der Formel (VIII): X ist O, R ist CH2-(2-Naphthyl);
Verbindung
mit der Formel (VIII): X ist O, R ist CH2-CH=CH-(4-Fluorphenyl) und
Verbindung
mit der Formel (VIII): X ist O, R ist CH2-CH(OH)-CN.
-
Bevorzugte
Verbindungen mit der Formel VIII sind gewählt aus der Gruppe bestehend
aus:
Verbindung mit der Formel (VIII): X ist O, R ist Allyl;
Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH=CH-Phenyl
und
Verbindung mit der Formel (VIII): X ist O, R ist -CH2CH=CH-(3-Chinolyl).
-
In
einer Ausführungsform
der Erfindung ist ein Verfahren zur Herstellung von 6-O-substituierten
Makrolidverbindungen mit der Formel:
worin jeweils
Y, Z,
R
a, R
c und R wie
zuvor definiert sind,
wobei das Verfahren Folgendes umfasst:
(a)
Behandlung einer Verbindung, die folgende Formel hat:
worin R
p eine
Hydroxyschutzgruppe ist und V =N-O-R
1 oder
=N-O-C(R
5)(R
6)-O-R
1 ist, worin R
1,
R
9 und R
10 wie zuvor
definiert sind, mit einer Base in einem aprotischen Lösungsmittel,
gefolgt von Behandlung mit einem Alkylierungsmittel, um eine Verbindung
mit folgender Formel zu ergeben:
worin R
a und
R
p wie zuvor definiert sind, V =N-O-R
1 oder =N-O-C(R
5)(R
6)-O-R
1 ist, worin
R
1, R
5 und R
6 wie zuvor definiert sind und R die „Alkylgruppe" ist, die von dem
entsprechenden Alkylierungsmittel abgeleitet ist;
(b) Entschützen der
2'- und 4''-Hydroxylgruppen, um eine Verbindung
mit folgender Formel zu ergeben:
worin R
a wie
zuvor definiert ist und R die „Alkylgruppe" ist, die von dem
entsprechenden Alkylierungsmittel abgeleitet ist;
(c) Desoximierung
in Gegenwart einer Säure
in einem geeigneten Lösungsmittel,
um die gewünschte
Intermediatverbindung zu ergeben, die folgende Formel hat:
(d) Entfernen des Cladinoseanteils
durch Hydrolyse mit Säure
und Schützen
der 2'-Hydroxylgruppe
durch Behandlung mit einem Hydroxyschutz-Reagens, um eine 3-Hydroxy-Erythromycinverbindung
mit folgender Formel zu ergeben:
(e) Oxidieren der 3-Hydroxygruppe,
wahlweise Entschützen
der 2'-Hydroxylgruppe
und Isolieren der gewünschten
Verbindung.
-
In
einer bevorzugten Ausführungsform
des unmittelbar oben beschriebenen Verfahrens wird in Schritt (a)
die Base gewählt
aus der Gruppe bestehend aus Kaliumhydroxid, Cäsiumhydroxid, Tetraalkylammoniumhydroxid,
Natriumhydrid, Kaliumhydrid, Kaliumisopropoxid, Kalium-tert-butoxid
und Kaliumisobutoxid, das Alkylierungsmittel wird gewählt aus
der Gruppe bestehend aus Allylbromid, Propargylbromid, Benzylbromid, 2-Fluorethylbromid,
4-Nitrobenzylbromid, 4-Chlorbenzylbromid, 4-Methoxybenzylbromid, α-Brom-p-tolunitril, Cinnamylbromid,
Methyl-4-bromcrotonat, Crotylbromid, 1-Brom-2-penten, 3-Brom-1-propenylphenylsulfon, 3-Brom-1-trimethylsilyl-1-propin,
3-Brom-2-octin,
1-Brom-but-2-in, 2-Picolylchlorid, 3-Picolylchlorid, 4-Picolylchlorid, 4-Brommethylchinolin,
Bromacetonitril, Epichlorhydrin, Bromfluormethan, Bromnitromethan,
Methylbromacetat, Methoxymethylchlorid, Bromacetamid, 2-Bromacetophenon,
1-Brom-2-butanon, Bromchlormethan, Brommethylphenylsulfon, 1,3-Dibrom-1-propen,
Allyl-O-tosylat, 3-Phenylpropyl-O-trifluormethansulfonat und
n-Butyl-O-methansulfonat,
und die Reaktion wird durchgeführt
bei einer Temperatur von ungefähr
-15°C bis
ungefähr
50°C über einen
Zeitraum von 0,5 Stunden bis 10 Tage; in Schritt (b) wird das Entschützen mit Hilfe
von Essigsäure
in Wasser und Acetonitril durchgeführt; und in Schritt (c) ist
das Desoximierungsreagens eine anorganische Schwefeloxidverbindung,
gewählt
aus der Gruppe bestehend aus Natriumhydrogensulfit, Natriumpyrosulfat,
Natriumthiosulfat, Natriumsulfat, Natriumsulfit, Natriumhydrosulfit,
Natriummetabisulfit, Natriumdithionat, Kaliumthiosulfat und Kaliummetabisulfit,
oder ein anorganisches Nitritsalz in Gegenwart einer Säure, gewählt aus
der Gruppe bestehend aus Natriumnitrit und Kaliumnitrit, und das
Lösungsmittel
ist gewählt aus
der Gruppe bestehend aus Wasser, Methanol, Ethanol, Propanol, Isopropanol,
Trimethylsilanol, oder eine Mischung aus einem oder mehreren davon;
in Schritt (d) ist das Hydroxyschutzreagens gewählt aus der Gruppe bestehend
aus einem Trialkylsilylhalogenid, einem Acylanhydrid oder einem
Acylhalogenid; in Schritt (e) ist das Oxidationsmittel gewählt aus
N-Chlorsuccinimid-dimethylsulfid und Carbodiimiddimethylsulfoxid,
und das optionale Entschützen
wird durchgeführt
durch Rühren
in Methanol.
-
In
einer anderen Ausführungsform
der vorliegenden Erfindung sind Verbindungen mit der Formel III,
worin R, R
c,
L und T wie zuvor beschrieben sind.
-
Bevorzugte
Verbindungen mit der Formel III sind solche, die gewählt sind
aus der Gruppe bestehend aus:
Verbindung mit der Formel (III);
Rc ist Acetyl, L ist CO, T ist NH, R ist
-CH2CH=CH2;
Verbindung
mit der Formel (III): Rc ist Acetyl, L ist
CO, T ist NH, R ist -CH2CH=CH-(3-Chinolyl);
Verbindung
mit der Formel (III): Rc ist Benzoyl, L
ist CO, T ist NH, R ist -CH2CH=CH-(3-Chinolyl);
Verbindung
mit der Formel (III): Rc ist Propanoyl,
L ist CO, T ist NH, R ist -CH2CH=CH-(3-Chinolyl)
und
Verbindung mit der Formel (III): Rc ist
Ethylsuccinoyl, L ist CO, T ist NH, R ist -CH2CH=CH-(3-Chinolyl).
-
In
einer stärker
bevorzugten Ausführungsform
der Verbindungen mit der Formel III der Erfindung sind Verbindungen
mit der Formel IX,
worin L, T und R oben definiert
sind.
-
Verbindungen,
die für
diese Ausführungsform
repräsentativ
sind, schließen
Folgendes ein, sind aber nicht darauf beschränkt:
Verbindung mit der
Formel (IX): L ist CO, T ist O, R ist -CH2CH=CH2;
Verbindung mit der Formel (IX): L
ist CO, T ist O, R ist -CH2CH=CH-Phenyl;
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH2CH2-Phenyl;
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH=CH-(4-Chlorphenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH=CH-(3-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH2CH3;
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH2NH2;
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH=NOH;
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH2CH2OH;
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2F;
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH2-Phenyl;
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH2-(4-Pyridyl);
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH2-(4-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH(OH)CN;
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH(C(O)OCH3)CH2-Phenyl;
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CN;
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH=CH-(4-Methoxyphenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH=CH-(4-Fluorphenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH=CH-(8-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH2NHCH2-Phenyl;
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2-Phenyl;
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2-(4-Pyridyl);
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2-(4-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH=CH-(4-Pyridyl);
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH2CH2-(4-Pyridyl);
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH=CH-(4-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH2CH2-(4-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH=CH-(5-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH2CH2-(5-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH=CH-(4-Benzoxazolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH=CH-(4-Benzimidazolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH2;
Verbindung mit der Formel (IX): L
ist CO, T ist NH, R ist -CH2CH=CH-Phenyl;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(3-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH2CH3;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH2NH2;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=NOH;
Verbindung mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH2CH2OH;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2F;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH2-Phenyl;
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH2-(4-Pyridyl);
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH(OH)CN;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH2-(4-Chinolyl);
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH(C(O)OCH3)CH2-Phenyl;
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CN;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(4-Chlorphenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(4-Fluorphenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH2CH2-(4-Methoxyphenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(4-Methoxyphenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(3-Chlor-6-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH2NHCH2CH2-(2-Chlorphenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-Phenyl;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-(4-Pyridyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-(4-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(4-Pyridyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH2CH2-(4-Pyridyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(3-Fluor-6-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH2CH2-(4-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(3-Cyano-6-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH2CH2-(5-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(4-Benzoxazolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(4-Benzimidazolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(3-Methoxy-6-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-(2-Naphthyl);
Verbindung
mit der Formel (IX): L ist CO, T ist N(CH3),
R ist -CH2CH=CH2;
Verbindung
mit der Formel (IX): L ist CO, T ist N(CH3),
R ist -CH2CH=CH-(3-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist N(CH2CH2N(CH3)2),
R ist -CH2CH=CH2 ;
Verbindung mit der Formel (IX): L
ist CO, T ist N(CH2CH2N(CH3)2), R ist -CH2CH=CH-(3-Chinolyl);
Verbindung mit
der Formel (IX): L ist CO, T ist N(CH2CH=CH2), R ist -CH2CH=CH2;
Verbindung mit der Formel (IX): L
ist CO, T ist N(CH2CH=C-(3-Chinolyl)), R ist
-CH2CH=CH-(3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(3-Pyridyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(2-Naphthyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(4-Isochinolinyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(3,4-Methylendioxyphenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(8-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(5-Indolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-Chlor-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(3,4-Ethylendioxyphenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(3-Nitrophenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-Nitrochinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(5-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(2-Methyl-6-chinolyl);
Verbindung
mit der Formel (III): L ist CO, T ist NH, Rc ist
Acetyl; R ist -CH2CH=CH-(3-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(5-Isochinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(7-Nitro-6-chinoxalinyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-Amino-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(1,8-Naphthyridin-3-yl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-(Acetylamino)-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(3-Carbazolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(5-Benzimidazolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(-3-Hydroxy-2-(N-(2-methoxyphenyl)amido)-7-naphthyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-Chinoxalinyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-Hydroxy-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-Methoxy-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(5-Nitro-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(8-Nitro-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(2-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(4-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(4-Carboxyl-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-Fluor-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-Methoxycarbonyl-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-Aminocarbonyl-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-Cyano-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(3-Brom-6-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2C(O)H;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH2NHCH2Phenyl;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH2NHCH2CH2Phenyl;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH2NHCH2CH2CH2Phenyl;
Verbindung mit der Formel (IX):
L ist CO, T ist NH, R ist -CH2CH2NHCH2CH2CH2CH2Phenyl;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH2NHCH2CH2CH2-(3-Chinolyl);
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH2NHCH2(3-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH2NHCH2(6-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=NO
(Phenyl);
Verbindung mit der Formel (IX): L ist CO, T ist NH,
R ist -CH2CH=NOCH2(Phenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=NOCH2(4-NO2-Phenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=NOCH2(4-Chinolyl);
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH=NOCH2(2-Chinolyl); Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH=NOCH2(3-Chinolyl);
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH=NOCH2-(6-Chinolyl);
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH=NOCH2-(1-Naphthyl);
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH=NOCH2-(2-Naphthyl);
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH2NHOCH2-(Phenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH2NHOCH2-(4-NO2-Phenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2C(O)-Phenyl;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2C(O)-(4-F-Phenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=NNHC(O)
Phenyl;
Verbindung mit der Formel (IX): L ist CO, T ist NH,
R ist -CH2CH2CH2-(3-Chinolyl);
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2-(2-(3-Chinolyl)cyclopropyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-H;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-(3-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-(6-Nitro-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-Phenyl;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-Naphthyl;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-(2-Naphthyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-(6-Methoxy-2-naphthyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-(6-Chlor-2-naphthyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-(6-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-(2-Methyl-6-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-(5-(N-(2-Pyridyl)amino)carbonyl)furanyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C=C-(1-Phenylethenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-Br;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-(2,2-Dimethyl-1,3-dioxolan-4-yl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH(OH)-Phenyl;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH(OH)CH2OH;
Verbindung mit der Formel (IX):
L ist CO, T ist NHNH2, R ist -CH2CH=CH2;
Verbindung
mit der Formel (IX): L ist CO, T ist NHNH2,
R ist -CH2CH=CH-(3-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NHNH2,
R ist -CH2CH2CH2-(3-Chinolyl);
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-Naphthyl;
Verbindung mit der
Formel (IX): L ist CO, T ist NH2, R ist
-CH2CH=CH-(3-(2-Furanyl)-6-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-(8-Chlor-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-(4-Chlor-2-trifluormethyl-6-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-(9-Fluorenon-2-yl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-(6-Benzoyl-2-naphthyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-(7-Methoxy-2-naphthyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-(3-Phenyl-6-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-(3-(2-Pyridyl)-6-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-(3-(2-Thiophenyl)-6-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-(4-Methylnaphthyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-(6-β-D-Galactopyranosyl-2-naphthyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-(7-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-(4-Fluornaphthyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-(3-Biphenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-(5-Nitronaphthyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-(4-Pyrrolylphenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-(6-Methoxy-2-naphthyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-(3,5-Dichlorphenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2-(3-Iodphenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2-(3-(2-Furanyl)phenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-(6-Hydroxy-2-naphthyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-(6-(2-Bromethoxy)-2-naphthyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-(6-(2-Tetrazolyl)ethoxy-2-naphthyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-Naphthyl;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C=C-(2-Phenylethenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-CH=CH-(5-(3-Isoxazolyl)-2-thiophenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-CH=CH-(1,3-Dimethyl-2,4-dioxo-5-pyrimidinyl) und
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-CH=CH-(5-(2-Pyridyl)aminocarbonyl-2-furanyl).
-
Bevorzugte
Verbindungen mit der Formel IX sind diejenigen, die gewählt sind
aus der Gruppe bestehend aus:
Verbindung mit der Formel (IX):
L ist CO, T ist O, R ist -CH2CH=CH2;
Verbindung mit der Formel (IX): L
ist CO, T ist O, R ist -CH2CH=CH-Phenyl;
Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH=CH-(3-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH2;
Verbindung mit der Formel (IX): L
ist CO, T ist NH, R ist -CH2CH=CH-Phenyl;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(3-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist N(CH3),
R ist -CH2CH=CH2;
Verbindung
mit der Formel (IX): L ist CO, T ist N(CH3),
R ist -CH2CH=CH-(3-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist N(CH2CH2N(CH3)2),
R ist -CH2CH=CH2;
Verbindung
mit der Formel (IX): L ist CO, T ist N(CH2CH2N(CH3)2),
R ist -CH2CH=CH-(3-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(3-Pyridyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(2-Naphthyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(4-Isochinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(3,4-Methylendioxyphenyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(8-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-Nitrochinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(5-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-Amino-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(1,8-Naphthyridin-3-yl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-(Acetylamino)-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-Chinoxalinyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-Hydroxy-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-Methoxy-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(5-Nitro-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(8-Nitro-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(2-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(4-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(4-Carboxyl-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-Fluor-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-Methoxycarbonyl-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-Aminocarbonyl-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(6-Cyano-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(3-Brom-6-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH2CH2-(3-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-(2-(3-Chinolyl)cyclopropyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-H;
Verbindung mit der
Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-(3-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-(6-Nitro-3-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-Phenyl;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-Naphthyl;
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-(2-Naphthyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-(6-Methoxy-2-naphthyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-(6-Chlor-2-naphthyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-(6-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist N(NH2),
R ist -CH2CH=CH2;
Verbindung
mit der Formel (IX): L ist CO, T ist N(NH2),
R ist -CH2CH=CH-(3-Chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist N(NH2),
R ist -CH2CH2CH2-(3-Chinolyl);
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-Naphthyl;
Verbindung mit der
Formel (IX): L ist CO, T ist NH2, R ist
-CH2CH=CH-(3-(2-Pyridyl)-6-chinolyl);
Verbindung
mit der Formel (IX): L ist CO, T ist NH2,
R ist -CH2CH=CH-(7-Chinolyl) und
Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-CH=CH-(5-(3-Isoxazolyl)-2-thiophenyl).
-
In
einer anderen Ausführungsform
der Erfindung ist ein Verfahren zur Herstellung von 6-O-substituierten
Makrolidverbindungen mit der Formel:
worin R und R
p R
ist gewählt
aus der Gruppe bestehend aus
(1) Methyl, substituiert mit einem
Anteil gewählt
aus der Gruppe bestehend aus
(a) CN,
(b) F,
(c) -CO
2R
10, worin R
10 C
1-C
3-Alkyl
oder Aryl-substituiertes C
1-C
3-Alkyl
oder Heteroarylsubstituiertes C
1-C
3-Alkyl ist,
(d) S(O)
nR
10, worin n 0, 1 oder 2 ist und R
10 wie zuvor definiert ist,
(e) NHC(O)R
10, worin R
10 wie
zuvor definiert ist,
(f) NHC(O)NR
11R
12, worin R
11 und
R
12 unabhängig gewählt sind aus Wasserstoff, C
1-C
3-Alkyl, C
1-C
3-Alkyl, substituiert mit Aryl, substituiertem
Aryl, Heteroaryl, substituiertem Heteroaryl,
(g) Aryl,
(h)
substituiertem Aryl,
(i) Heteroaryl und
(j) substituiertem
Heteroaryl,
(2) C
2-C
10-Alkyl,
(3)
C
2-C
10-Alkyl, substituiert
mit einem oder mehreren Substituenten gewählt aus der Gruppe bestehend
aus
(a) Halogen,
(b) Hydroxy,
(c) C
1-C
3-Alkoxy,
(d) C
1-C
3-Alkoxy-C
1-C
3-alkoxy,
(e) Oxo,
(f) -N
3,
(g) -CHO,
(h) O-SO
2-(substituiertem
C
1-C
6-Alkyl),
(i)
-NR
13R
14, worin
R
13 und R
14 gewählt sind
aus der Gruppe bestehend aus
(i) Wasserstoff,
(ii) C
1-C
12-Alkyl,
(iii)
substituiertem C
1-C
12-Alkyl,
(iv)
C
1-C
12-Alkenyl,
(v)
substituiertem C
1-C
12-Alkenyl,
(vi)
C
1-C
12-Alkinyl,
(vii)
substituiertem C
1-C
12-Alkinyl,
(viii)
Aryl,
(ix) C
3-C
8-Cycloalkyl,
(x)
substituiertem C
3-C
8-Cycloalkyl,
(xi)
substituiertem Aryl,
(xii) Heterocycloalkyl,
(xiii) substituiertem
Heterocycloalkyl,
(xiv) C
1-C
12-Alkyl, substituiert mit Aryl,
(xv)
C
1-C
12-Alkyl, substituiert
mit substituiertem Aryl,
(xvi) C
1-C
12-Alkyl, substituiert mit Heterocycloalkyl,
(xvii)
C
1-C
12-Alkyl, substituiert
mit substituiertem Heterocycloalkyl,
(xviii) C
1-C
12-Alkyl, substituiert mit C
3-C
8-Cycloalkyl,
(xix) C
1-C
12-Alkyl, substituiert mit substituiertem
C
3-C
8-Cycloalkyl,
(xx)
Heteroaryl,
(xxi) substituiertem Heteroaryl,
(xxii) C
1-C
12-Alkyl, substituiert
mit Heteroaryl, und
(xxiii) C
1-C
12-Alkyl, substituiert mit substituiertem
Heteroaryl, oder
R
13 und R
14 zusammengenommen
mit dem Atom, an welches sie gebunden sind, einen 3-10-gliedrigen
Heterocycloalkylring bilden, der mit einem oder mehreren Substituenten
substituiert sein kann, die unabhängig gewählt sind aus der Gruppe bestehend
aus
(i) Halogen,
(ii) Hydroxy,
(iii) C
1-C
3-Alkoxy,
(iv) C
1-C
3-Alkoxy-C
1-C
3-alkoxy,
(v)
Oxo,
(vi) C
1-C
3-Alkyl,
(vii)
Halo-C
1-C
3-Alkyl
und
(viii) C
1-C
3-Alkoxy-C
1-C
3-alkyl,
(j) -CO
2R
10, worin R
10 wie
zuvor definiert ist,
(k) -C(O)NR
11R
12, worin R
11 und
R
12 wie zuvor definiert sind,
(l) =N-O-R
10, worin R
10 wie
zuvor definiert ist,
(m) -C≡N,
(n) O-S(O)
nR
10, worin n 0,
1 oder 2 ist und R
10 wie zuvor definiert
ist,
(o) Aryl,
(p) substituiertem Aryl,
(q) Heteroaryl,
(r)
substituiertem Heteroaryl,
(s) C
3-C
8-Cycloalkyl,
(t) substituiertem C
3-C
8-Cycloalkyl,
(u)
C
1-C
12-Alkyl, substituiert
mit Heteroaryl,
(v) Heterocycloalkyl,
(w) substituiertem
Heterocycloalkyl,
(x) NHC(O)R
10, worin
R
10 wie zuvor definiert ist,
(y) NHC(O)NR
11R
12, worin R
11 und R
12 wie zuvor
definiert sind,
(z) =N-NR
13R
14, worin R
13 und
R
14 wie zuvor definiert sind,
(aa)
=N-R
9, worin R
9 wie
zuvor definiert ist,
(bb) =N-NHC(O)R
10,
worin R
10 wie zuvor definiert ist, und
(cc)
=N-NHC(O)NR
11R
12,
worin R
11 und R
12 wie
zuvor definiert sind,
(4) C
3-Alkenyl,
substituiert mit einem Anteil gewählt aus der Gruppe bestehend
aus
(a) Halogen,
(b) -CHO,
(c) -CO
2R
10, worin R
10 wie
zuvor definiert ist,
(d) -C(O)-R
9,
worin R
9 wie zuvor definiert ist,
(e)
-C(O)NR
11R
12, worin
R
11 und R
12 wie
zuvor definiert sind,
(f) -C≡N,
(g) Aryl,
(h)
substituiertem Aryl,
(i) Heteroaryl,
(j) substituiertem
Heteroaryl,
(k) C
3-C
7-Cycloalkyl
und
(l) C
1-C
1 2-Alkyl, substituiert mit Heteroaryl,
(5)
C
4-C
10-Alkenyl,
(6)
C
4-C
10-Alkenyl,
substituiert mit einem oder mehreren Substituenten, gewählt aus
der Gruppe bestehend aus
(a) Halogen,
(b) C
1-C
3-Alkoxy,
(c) Oxo,
(d) -CHO,
(e)
-CO
2R
10, worin R
10 wie zuvor definiert ist,
(f) -C(O)NR
11R
12, worin R
11 und R
12 wie zuvor
definiert sind,
(g) -NR
13R
14,
worin R
13 und R
14 wie
zuvor definiert sind,
(h) =N-O-R
10,
worin R
10 wie zuvor definiert ist,
(i)
-C=N,
(j) O-S(O)
nR
10,
worin n 0, 1 oder 2 ist und R
10 wie zuvor
definiert ist,
(k) Aryl,
(l) substituiertem Aryl,
(m)
Heteroaryl,
(n) substituiertem Heteroaryl,
(o) C
3-C
7-Cycloalkyl,
(p)
C
1-C
12-Alkyl, substituiert
mit Heteroaryl,
(q) NHC(O)R
10, worin
R
10 wie zuvor definiert ist,
(r) NHC(O)NR
11R
12, worin R
11 und R
12 wie zuvor
definiert sind,
(s) =N-NR
13R
14, worin R
13 und
R
14 wie zuvor definiert sind,
(t) =N-R
9, worin R
9 wie zuvor
definiert ist,
(u) =N-NHC(O)R
10, worin
R
10 wie zuvor definiert ist, und
(v)
=N-NHC(O)NR
11R
12,
worin R
11 und R
12 wie
zuvor definiert sind;
(7) C
3-C
10-Alkinyl und
(8) C
3-C
10-Alkinyl, substituiert mit einem oder mehreren
Substituenten, gewählt
aus der Gruppe bestehend aus
(a) Trialkylsilyl,
(b) Aryl,
(c)
substituiertem Aryl,
(d) Heteroaryl und
(e) substituiertem
Heteroaryl;
R
e ist H oder W-R
d, worin W abwesend oder gewählt ist
aus der Gruppe bestehend aus -O-, -NH-CO-, -N=CH- und -NH- und R
d ist gewählt
aus der Gruppe bestehend aus
(1) Wasserstoff,
(2) C
1-C
6-Alkyl, wahlweise
substituiert mit einem oder mehreren Substituenten, gewählt aus
der Gruppe bestehend aus
(a) Aryl,
(b) substituiertem
Aryl,
(c) Heteroaryl,
(d) substituiertem Heteroaryl,
(e)
Hydroxy,
(f) C
1-C
6-Alkoxy,
(g)
NR
7R
8, worin R
7 und R
8 unabhängig gewählt sind
aus Wasserstoff und C
1-C
6-Alkyl
oder R
7 und R
8 mit
dem Stickstoffatom, an welches sie gebunden sind, genommen werden,
um einen 3- bis 7-gliedrigen
Ring zu bilden, der, wenn der Ring ein 5- bis 7-gliedriger Ring
ist, wahlweise eine Heterofunktion enthalten kann, die gewählt ist
aus der Gruppe bestehend aus -O-, -NH-, -N(C
1-C
6-Alkyl-)-,
-N(Aryl)-, -N(Aryl-C
1-C
6-alkyl-)-,
-N(substituiertem-Aryl-C
1-C
6-alkyl-)-,
-N(Heteroaryl)-, -N(Heteroaryl-C
1-C
6-alkyl-)-, -N(substituiertem-Heteroaryl-C
1-C
6-alkyl-)- und
-S- oder -S(O)
n-, worin n 1 oder 2 ist,
und
(h) -CH
2-M-R
9,
worin M gewählt
ist aus der Gruppe bestehend aus:
(i) -C(O)-NH-,
(ii)
-NH-C(O)-,
(iii) -NH-,
(iv) -N=,
(v) -N(CH
3)-,
(vi) -NH-C(O)-O-,
(vii) -NH-C(O)-NH-,
(viii)
-O-C(O)-NH-,
(ix) -O-C(O)-O-,
(x) -O-,
(xi) -S(O)
n-, worin n 0, 1 oder 2 ist,
(xii) -C(O)-O-,
(xiii)
-O-C(O)- und
(xiv) -C(O)-, und
R
9 gewählt ist
aus der Gruppe bestehend aus:
(i) C
1-C
6-Alkyl, wahlweise substituiert mit einem
Substituenten, gewählt
aus der Gruppe bestehend aus
(aa) Aryl,
(bb) substituiertem
Aryl,
(cc) Heteroaryl und
(dd) substituiertem Heteroaryl,
(ii)
Aryl,
(iii) substituiertem Aryl,
(iv) Heteroaryl,
(v)
substituiertem Heteroaryl und
(vi) Heterocycloalkyl,
(3)
C
3-C
7-Cycloalkyl,
(4)
Aryl,
(5) substituiertem Aryl,
(6) Heteroaryl und
(7)
substituiertem Heteroaryl,
wobei das Verfahren Folgendes umfasst:
(a)
Behandeln einer Verbindung mit der Formel
worin R wie zuvor definiert
ist, R
p eine Hydroxyschutzgruppe ist und
Z' 4''-Hydroxy-geschützte Cladinose ist, mit Natriumhexamethyldisilazid
und Carbonyldiimidazol, um eine Verbindung mit folgender Formel
zu ergeben:
(b) Behandeln der Verbindung
aus Schritt (a) mit einem Reagens, gewählt aus der Gruppe bestehend
aus Ammoniak, R
e-NH
2,
Hydrazin, substituiertem Hydrazin, Hydroxylamin und substituiertem
Hydroxylamin, um eine Verbindung mit folgender Formel zu ergeben:
worin R
e H
oder W-R
d ist, worin W abwesend oder gewählt ist
aus der Gruppe bestehend aus -O-, -NH-CO-, -N=CH- und -NH- und R
d wie zuvor definiert ist,
(c) wahlweise
Behandeln der Verbindung aus Schritt (b), worin R
e H
ist, mit einem Alkylierungsmittel, das die Formel R
d-Halogen hat, worin
R
d wie zuvor definiert ist, um eine Verbindung
mit der Formel zu ergeben, die in Schritt (b) dargestellt ist, worin
R
e W-R
d ist, W abwesend
ist und R
d wie zuvor definiert ist;
(d)
wahlweise Behandeln der Verbindung aus Schritt (b), worin R
e W-R
d ist und W
-NH- ist und R
d H ist, mit einem Alkylierungsmittel,
das gewählt
ist aus der Gruppe bestehend aus R
d-Halogen,
worin R
d wie zuvor definiert ist, um eine
Verbindung mit der Formel zu ergeben, die in Schritt (b) dargestellt
ist, worin R
e W-R
d ist,
W -NH- ist und R
d wie oben definiert ist;
(e)
wahlweise Behandeln der Verbindung aus Schritt (b), worin R
e W-R
d ist und W
-NH- ist und Rd H ist, mit einem Acylierungsmittel, das gewählt ist
aus der Gruppe bestehend aus R
d-C(CO)-Halogen
oder (R
d-C(CO)-O)
2,
um eine Verbindung zu ergeben, worin R
e W-R
d ist, W -NH-CO- ist und R
d wie
oben definiert ist;
(f) wahlweise Behandeln der Verbindung
aus Schritt (b), worin R
e W-R
d ist
und W -NH- ist und R
d H ist, mit einem Aldehyd,
das die Formel R
d-CHO hat, worin R
d wie oben definiert ist, um eine Verbindung
zu ergeben, worin R
e W-R
d ist,
W -N=CH- ist und R
d wie oben definiert ist;
(g)
Entfernen des Cladinoseanteils durch Hydrolyse mit Säure, um
eine Verbindung mit folgender Formel zu ergeben:
(h) Oxidieren der 3-Hydroxylgruppe
und
(i) wahlweise Entschützen
und Isolieren der gewünschten
Verbindung.
-
In
einer bevorzugten Ausführungsform
des unmittelbar oben erwähnten
Verfahrens ist R eine Allyl- oder Propargylgruppe, substituiert
mit einem Anteil gewählt
aus der Gruppe bestehend aus 1-Phenylethenyl, 2-Chlorphenyl, 2-Fluorenyl, 2-Methyl-6-chinolyl,
2-Naphthyl, 2-Phenylethenyl, 2-Chinolyl,
3-(2-Furanyl)-6-chinolyl, 3-(2-Pyridyl)-6-chinolyl, 3-Chinolyl. 3-(2-Thiophenyl)-6-chinolyl,
3-Biphenyl, 3-Brom-6-chinolyl,
3-Carbazolyl, 3-Chlor-6-chinolyl, 3-Cyano-6-chinolyl, 3-Fluor-6-chinolyl,
3-Hydroxy-2-(N-(2-methoxyphenyl)amido)-7-naphthyl, 3-Iodphenyl, 3-Methoxy-6-chinolyl,
3-Nitrophenyl, 3-Phenyl-6-chinolyl,
3-Chinolyl, 4-Benzoxazolyl, 4-Carboxyl-3-chinolyl, 4-Chlor-2-trifluormethyl-6-chinolyl,
4-Chlorphenyl, 4-Fluornaphthyl,
4-Fluorphenyl, 4-Isochinolinyl, 4-Methoxyphenyl, 4-Methylnaphthyl,
4-Pyridyl, 4-Pyrrolylphenyl, 4-Chinolyl, 5-(2- Pyridyl)aminocarbonyl-2-furanyl, 5-(3-Isoxazolyl)-2-thiophenyl,
5-Benzimidazolyl, 5-Indolyl, 5-Isochinolyl, 5-Nitro-3-chinolyl,
5-Nitronaphthyl, 5-(N-(2-Pyridyl)amino)carbonyl)furanyl, 5-Chinolyl, 6-(Acetylamino)-3-chinolyl,
6-(2-Tetrazolyl)ethoxy-2-naphthyl,
6-(2-Bromethoxy)-2-naphthyl, 6-Amino-3-chinolyl, 6-Aminocarbonyl-3-chinolyl, 6-β-D-Galactopyranosyl-2-naphthyl,
6-Benzoyl-2-naphthyl,
6-Cyano-3-chinolyl, 6-Fluor-3-chinolyl, 6-Hydroxy-2-naphthyl, 6-Hydroxy-3-chinolyl,
6-Methoxy-2-naphthyl, 6-Methoxy-3-chinolyl, 6-Methoxycarbonyl-3-chinolyl,
6-Nitrochinolyl,
6-Chinolyl, 6-Chinoxalinyl, 7-Methoxy-2-naphthyl, 7-Nitro-6-chinoxalinyl,
7-Chinolyl, 8-Chlor-3-chinolyl, 8-Nitro-3-chinolyl, 8-Chinolyl, 9-Oxofluoren-2-yl,
1,3-Dimethyl-2,4-dioxo-5-pyrimidinyl, 1,8-Naphthyridin-3-yl,
3,4-Methylendioxyphenyl,
3,5-Dichlorphenyl, Naphthyl und Phenyl, und in Schritt (b) ist das
Reagens gewählt
aus der Gruppe bestehend aus Ammoniak und Re-NH2; die fakultativen Schritte (c), (d) und
(e) werden ausgelassen; und in Schritt (g) wird das Oxidationsmittel
gewählt
aus N-Chlorsuccinimid-dimethylsulfid und Carbodiimid-dimethylsulfoxid;
und in Schritt (h) wird das wahlweise Entschützen durchgeführt durch
Rühren
in Methanol.
-
In
einer stärker
bevorzugten Ausführungsform
des unmittelbar oben beschriebenen Verfahrens ist R eine Allyl-
oder Propargylgruppe, substituiert mit einem Anteil gewählt aus
der Gruppe bestehend aus 2-Methyl-6-chinolyl, 2-Chinolyl, 3-(2-Furanyl)-6-chinolyl,
3-(2-Pyridyl)-6-chinolyl, 3-Chinolyl, 3-(2-Thiophenyl)-6-chinolyl, 3-Brom-6-chinolyl,
3-Chlor-6-chinolyl, 3-Cyano-6-chinolyl, 3-Fluor-6-chinolyl, 3-Methoxy-6-chinolyl, 3-Phenyl-6-chinolyl,
3-Chinolyl, 4-Carboxyl-3-chinolyl, 4-Chlor-2-trifluormethyl-6-chinolyl, 4-Isochinolinyl, 4-Chinolyl,
5-Isochinolyl, 5-Nitro-3-chinolyl,
5-Chinolyl, 6-(Acetylamino)-3-chinolyl,
6-Amino-3-chinolyl, 6-Aminocarbonyl-3-chinolyl, 6-Cyano-3-chinolyl,
6-Fluor-3-chinolyl, 6-Hydroxy-3-chinolyl, 6-Methoxy-3-chinolyl, 6-Methoxycarbonyl-3-chinolyl,
6-Nitrochinolyl,
6-Chinolyl, 7-Chinolyl, 8-Chlor-3-chinolyl, 8-Nitro-3-chinolyl und 8-Chinolyl.
-
In
einer anderen Ausführungsform
der Erfindung ist ein Verfahren zur Herstellung einer Verbindung
mit der Formel
worin R
e H
oder W-R
d ist, worin W abwesend oder gewählt ist
aus der Gruppe bestehend aus -O-, -NH-CO-, -N=CH- und -NH- und R
d wie zuvor definiert ist und R
10 H
oder C
1-C
3-Alkyl,
Arylsubstituiertes C
1-C
3-Alkyl
oder Heteroaryl-substituiertes C
1-C
3-Alkyl
ist,
wobei das Verfahren Folgendes umfasst:
(a) Behandeln
einer Verbindung mit der Formel
mit Ozon, um eine Verbindung
mit folgender Formel zu ergeben:
(b) Behandeln der Verbindung
von Schritt (a) mit einer Hydroxylaminverbindung, die die Formel
NH
2-O-R
10 hat, worin
R
10 wie zuvor definiert ist, und
(c)
wahlweise Entschützen
und Isolieren der gewünschten
Verbindung.
-
In
einer bevorzugten Ausführungsform
des unmittelbar oben erwähnten
Verfahrens ist Re H.
-
In
einer anderen Ausführungsform
der Erfindung ist ein Verfahren zur Herstellung einer Verbindung
mit der Formel
worin R
e H
oder W-R
d ist, worin W abwesend oder gewählt ist
aus der Gruppe bestehend aus -O-, -NH-CO-, -N=CH- und -NH- und R
d wie oben definiert ist,
wobei das
Verfahren Folgendes umfasst:
(a) reduktives Aminieren einer
Verbindung mit der Formel
mit einer Aminverbindung,
die die Formel NH
2-R
13 hat,
worin R
13 wie zuvor definiert ist; und
(b)
wahlweise Entschützen
und Isolieren der gewünschten
Verbindung.
-
In
einer anderen Ausführungsform
der vorliegenden Erfindung sind Verbindungen mit der Formel IV,
worin R, R
c,
A, B, D und E wie zuvor definiert sind.
-
In
einer stärker
bevorzugten Ausführungsform
der Verbindungen mit der Formel IV der Erfindung sind Verbindungen
mit der Formel VII,
worin A, B, D, E und R zuvor
definiert sind.
-
Verbindungen,
die repräsentativ
für die
Ausführungsform
der Formel VII sind, schließen
Folgendes ein, sind aber nicht darauf beschränkt:
Verbindung mit der
Formel (VII): A, B, D und E sind H, R ist Allyl;
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist -CH2CH2CH3;
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist -CH2CH2NH2;
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist -CH2CH=NOH;
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist -CH2CH2CH2OH;
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist -CH2F;
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist -CH2CN;
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist -CH2CH
(OH)CN;
Verbindung mit der Formel (VII): A, B, D und E sind
H, R ist -CH2-Phenyl;
Verbindung mit
der Formel (VII): A, B, D und E sind H, R ist -CH2-
(4-Pyridyl);
Verbindung mit der Formel (VII): A, B, D und E
sind H, R ist -CH2-(4-Chinolyl);
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist -CH2CH=CH-(4-Pyridyl);
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist -CH2CH=CH-
(4-Chlorphenyl);
Verbindung mit der Formel (VII): A, B, D und
E sind H, R ist -CH2CH=CH-(4-Fluorphenyl);
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist -CH2CH=CH-(4-Methoxyphenyl);
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist -CH2CH2CH2-Phenyl;
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist -CH2CH=CH-(4-Pyridyl);
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist -CH2CH2CH2-(4-Pyridyl);
Verbindung mit der Formel (VII): A, B, D und E sind H, R ist -CH2CH=CH-(4-Chinolyl);
Verbindung mit
der Formel (VII): A, B, D und E sind H, R ist -CH2CH2CH2-(4-Chinolyl);
Verbindung mit der Formel (VII): A, B, D und E sind H, R ist -CH2CH=CH-(5-Chinolyl);
Verbindung mit
der Formel (VII): A, B, D und E sind H, R ist -CH2CH2CH2-(5-Chinolyl);
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist -CH2CH=CH-(4-Benzoxazolyl);
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist -CH2CH=CH-(4-Benzimidazolyl);
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist -CH2CH=CH-(8-Chinolyl);
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist -CH2CH2NHCH2-Phenyl;
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist -CH2CH2NHCH2-(4-Pyridyl);
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist -CH2CH2NHCH2-(4-Chinolyl);
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist -CH2CH2NHCH(CH2-Phenyl)C(O)OCH3;
Verbindung mit der Formel (VII):
A, B, D und E sind H, R ist -CH2CH2NHCH2CH2-(2-Chlorphenyl);
Verbindung
mit der Formel (VII): A, B und E sind H, D ist Benzyl, R ist Allyl;
Verbindung
mit der Formel (VII): A ist Benzyl, B, D und E sind H, R ist Allyl;
Verbindung
mit der Formel (VII): A und E sind Phenyl, B und D sind H, R ist
Allyl;
Verbindung mit der Formel (VII): A ist Methyl, B, D
und E sind H, R ist Allyl;
Verbindung mit der Formel (VII):
A und D sind Methyl, B und E sind H, R ist Allyl;
Verbindung
mit der Formel (VII): A und E zusammengenommen sind -CH2CH2CH2-, B und D sind
H, R ist Allyl;
Verbindung mit der Formel (VII): A, B, D und
E sind H, R ist -CH2CH=CH-(3-Chinolyl) und
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist 3-(3-Chinolyl)propyl.
-
Bevorzugte
Verbindungen mit der Formel VII sind diejenigen in der Gruppe bestehend
aus:
Verbindung mit der Formel (VII): A, B, D und E sind H,
R ist Allyl;
Verbindung mit der Formel (VII): A, B, D und E
sind H, R ist -CH2CH=CH-(3-Chinolyl) und
Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist -CH2CH2CH2-(3-Chinolyl).
-
In
einer anderen Ausführungsform
der Erfindung ist das Verfahren zur Herstellung einer Verbindung mit
der Formel IV
worin R
c,
R, A, B, D und E wie zuvor definiert sind,
wobei das Verfahren
Folgendes umfasst:
(a) Behandeln einer Verbindung mit der Formel
worin R wie zuvor definiert
ist und R
c eine Hydroxyschutzgruppe ist,
durch Behandlung mit Methansulfonanhydrid in Pyridin und anschließende Behandlung
des Methansulfonylderivats mit einer Aminbase, um eine Verbindung
mit folgender Formel zu ergeben:
(b) Behandeln der Verbindung
von Schritt (a) mit einer Alkalimetallhydridbase und Carbonyldiimidazol,
um eine Verbindung mit folgender Formel zu ergeben:
(c) Behandeln der Verbindung
von Schritt (b) mit einem Diamin, das folgende Formel hat:
worin A, B, D und E wie
zuvor definiert sind, um eine Verbindung mit folgender Formel zu
ergeben:
(d) Cyclisieren der Verbindung
von Schritt (c) mit verdünnter
mineralischer oder organischer Säure,
wahlweise Entschützen
und Isolieren der gewünschten
Verbindung.
-
Eine
Alternative zu dem unmittelbar oben beschriebenen Verfahren ist
das Verfahren, worin die Schritte (c) und (d) ersetzt werden durch
die Schritte (c)-(f), bestehend aus:
(c) Behandeln der Verbindung
von Schritt (b) mit einem Amin, das folgende Formel hat:
worin A, B, D und E wie darin
definiert sind und Y Hydroxy ist, um eine Verbindung zu ergeben,
die folgende Formel hat:
(d) Behandeln der Verbindung
von Schritt (c) mit Triphenylphosphin und Diphenylphosphorylazid
und Diethylazodicarboxylat in Tetrahydrofuran, um die analoge Verbindung
zu ergeben, worin Y N
3 ist, und Entfernen
der entschützenden
Gruppe, um die analoge Verbindung zu ergeben, worin Y N
3 und
R
c H ist;
(e) Behandeln der Verbindung
von Schritt (d) mit einem Reduktionsmittel, gewählt aus der Gruppe bestehend aus
Triphenylphosphin-Wasser, Wasserstoff mit einem Katalysator, Natriumborhydrid
und Dialkylaluminiumhydrid, um die Verbindung mit folgender Formel
zu ergeben:
(f) Cyclisieren der Verbindung
von Schritt (e) mit verdünnter
mineralischer oder organischer Säure
und Isolieren der gewünschten
Verbindung.
-
In
einer anderen Ausführungsform
der vorliegenden Erfindung sind Verbindungen mit der Formel IV-A,
worin R, R
c,
A, B, D und E wie zuvor definiert sind.
-
In
einer bevorzugten Ausführungsform
sind Verbindungen mit der Formel IV-A, worin Rc H
ist und R, A, B, D und E wie zuvor definiert sind.
-
In
einer anderen Ausführungsform
der vorliegenden Erfindung sind Verbindungen mit der Formel V,
worin R, R
c und
R
d wie zuvor definiert sind.
-
In
einer bevorzugten Ausführungsform
der Verbindungen mit der Formel V der Erfindung sind Verbindungen
mit der Formel VI,
worin R wie zuvor definiert
ist.
-
Verbindungen,
die repräsentativ
für Verbindungen
mit der Formel VI sind, schließen
Folgendes ein, sind aber nicht darauf beschränkt:
Verbindung mit der
Formel (VI): R ist -CH2CH2CH3,
Verbindung mit der Formel (VI): R
ist -CH2CH=CH,
Verbindung mit der Formel
(VI): R ist -CH2CH=CH-Phenyl,
Verbindung
mit der Formel (VI): R ist -CH2CH2CH2-Phenyl,
Verbindung
mit der Formel (VI): R ist -CH2CH=NOH,
Verbindung
mit der Formel (VI) : R ist -CH2CH2NH2,
Verbindung
mit der Formel (VI): R ist -CH2CH2NHCH2-Phenyl,
Verbindung
mit der Formel (VI) : R ist -CH2CH2NHCH2-(4-Pyridyl),
Verbindung
mit der Formel (VI): R ist -CH2CH2NHCH2-(4-Chinolyl),
Verbindung
mit der Formel (VI): R ist -CH2CH(OH)CN,
Verbindung
mit der Formel (VI) : R ist -CH2CH2NHCH(CO2CH3)CH2-Phenyl,
Verbindung
mit der Formel (VI): R ist -CH2CN,
Verbindung
mit der Formel (VI): R ist -CH2CH=CH-(4-Methoxyphenyl),
Verbindung
mit der Formel (VI): R ist -CH2CH=CH-(4-Chlorphenyl),
Verbindung
mit der Formel (VI): R ist -CH2CH=CH-(4-Fluorphenyl),
Verbindung
mit der Formel (VI): R ist -CH2CH=CH-(3-Chinolyl),
Verbindung
mit der Formel (VI): R ist -CH2CH=CH-(8-Chinolyl)
und
Verbindung mit der Formel (VI): R ist -CH2CH2NHCH2CH2-(2-Chlorphenyl).
-
Eine
andere Ausführungsform
der Erfindung ist das Verfahren zur Herstellung einer Verbindung
mit der Formel
worin R und R
c wie
zuvor definiert sind und R
b gewählt ist
aus der Gruppe bestehend aus Hydroxy, -O-C(O)-NH
2 und
-O-C(O)-Imidazolyl,
wobei
das Verfahren folgendes umfasst:
(a) Behandeln einer Verbindung
mit der Formel
worin R
c eine
Hydroxyschutzgruppe und R wie zuvor definiert ist, mit einer Reagenskombination,
gewählt
aus
(1) einem Alkalimetallhydrid und einem Phosgenreagens,
gewählt
aus Phosgen, Diphosgen und Triphosgen, unter wasserfreien Bedingungen,
gefolgt von wässriger
basekatalysierter Decarboxylierung, und
(2) Reaktion mit Methansulfonanhydrid
in Pyridin, gefolgt von der Behandlung mit einer Aminbase, um die
Verbindung mit der Formel V zu ergeben, worin R
b Hydroxy
ist;
(b) wahlweise Behandeln der Verbindung mit der Formel
V von Schritt (b), worin R
b Hydroxy ist,
mit einer Alkalimetallhydridbase und Carbonyldiimidazol, um die
Verbindung mit der Formel V zu ergeben, worin R
b-O-C(O)-Imidazolyl
ist;
(c) wahlweise Behandeln der Verbindung mit der Formel
V von Schritt (a), worin R
b -O-C(O)-Imidazolyl
ist, mit einem Amin, um die Verbindung mit der Formel V zu ergeben,
worin R
b -O-C(O)-NH
2 ist,
und
(d) wahlweise Entschützen
und Isolieren der gewünschten
Verbindung.
-
Definitionen
-
Wie
in dieser Beschreibung und den beigefügten Ansprüchen verwendet, haben die folgenden
Begriffe die angegebenen Bedeutungen.
-
Die
Begriffe „C1-C3-Alkyl", „C1-C6-Alkyl" und „C1-C12-Alkyl", wie hierin verwendet,
beziehen sich auf gesättigte,
gerad- oder verzweigtkettige Kohlenwasserstoffradikale, abgeleitet
von einem Kohlenwasserstoffanteil, der zwischen eins und drei, eins
und sechs beziehungsweise eins und zwölf Kohlenstoffatome enthält, durch
Entfernen eines einzelnen Wasserstoffatoms. Beispiele für C1-C3-Alkylradikale
schließen
Methyl, Ethyl, Propyl und Isopropyl ein, Beispiele für C1-C6-Alkylradikale schließen Methyl,
Ethyl, Propyl, Isopropyl, n-Butyl, tert-Butyl,
Neopentyl und n-Hexyl ein, sind aber nicht darauf beschränkt. Beispiele
für C1-C12-Alkylradikale schließen alle
oben stehenden Beispiele sowie n-Heptyl, n-Octyl, n-Nonyl, n-Decyl,
n-Undecyl und n-Dodecyl ein, sind aber nicht darauf beschränkt.
-
Der
Begriff „C1-C6-Alkoxy", wie hierin verwendet,
bezieht sich auf eine C1-C6-Alkylgruppe,
wie zuvor definiert, gebunden an den molekularen Stammanteil durch
ein Sauerstoffatom. Beispiele für
C1-C6-Alkoxy schließen Methoxy,
Ethoxy, Propoxy, Isopropoxy, n-Butoxy, tert-Butoxy, Neopentoxy und
n-Hexoxy ein, sind aber nicht darauf beschränkt.
-
Der
Begriff „C1-C12-Alkenyl" bezeichnet eine
monovalente Gruppe, abgeleitet von einem Kohlenwasserstoffanteil,
der von zwei bis zwölf
Kohlenstoffatome enthält
und mindestens eine Kohlenstoff-Kohlenstoff-Doppelbindung hat, durch das Entfernen
eines einzelnen Wasserstoffatoms. Alkenylgruppen schließen zum
Beispiel Ethenyl, Propenyl, Butenyl, 1-Methyl-2-buten-1-yl und dergleichen
ein.
-
Der
Begriff „C1-C12-Alkinyl", wie hierin verwendet,
bezieht sich auf eine monovalente Gruppe, abgeleitet von einem Kohlenwasserstoff,
der von zwei bis zwölf
Kohlenstoffatome enthält
und mindestens eine Kohlenstoff-Kohlenstoff-Dreifachbindung hat, durch das Entfernen
eines einzelnen Wasserstoffatoms. Repräsentative Alkinylgruppen schließen Ethinyl,
2-Propinyl (Propargyl), 1-Propinyl und dergleichen ein.
-
Der
Begriff „Alkylen" bezeichnet eine
divalente Gruppe, abgeleitet von einem gerad- oder verzweigtkettigen
gesättigten
Kohlenwasserstoff durch das Entfernen zweier Wasserstoffatome, zum
Beispiel Methylen, 1,2-Ethylen, 1,1-Ethylen, 1,3-Propylen, 2,2-Dimethylpropylen
und dergleichen.
-
Der
Begriff „C1-C3-Alkylamino", wie hierin verwendet,
bezieht sich auf eine oder zwei C1-C3-Alkylgruppen wie zuvor definiert, gebunden
an den molekularen Stammanteil durch ein Stickstoffatom. Beispiele
für C1-C3-Alkylamino schließen Methylamino,
Dimethylamino, Ethylamino, Diethylamino und Propylamino ein, sind
aber nicht darauf beschränkt.
-
Der
Begriff „Oxo" bezeichnet eine
Gruppe, worin zwei Wasserstoffatome an einem einzigen Kohlenstoffatom
in einer Alkylgruppe wie oben definiert durch ein einzelnes Sauerstoffatom
ersetzt werden (d. h. eine Carbonylgruppe).
-
Der
Begriff „aprotisches
Lösungsmittel", wie hierin verwendet,
bezieht sich auf ein Lösungsmittel,
das relativ inert gegenüber
Protonaktivität
ist, d. h., nicht als Protonengeber wirkt. Beispiele schließen Folgendes ein,
sind aber nicht darauf beschränkt:
Kohlenwasserstoffe, wie z. B. Hexan und Toluen, halogenierte Kohlenwasserstoffe,
wie zum Beispiel Methylenchlorid, Ethylenchlorid, Chloroform und
dergleichen, Heteroarylverbindungen, wie zum Beispiel Tetrahydrofuran
und N-Methylpyrrolidinon,
und Ether, wie zum Beispiel Diethylether, Bis-methoxymethylether.
Solche Verbindungen sind den Fachleuten gut bekannt, und es wird
für den
Fachmann offensichtlich sein, dass einzelne Lösungsmittel oder Mischungen
davon für
bestimmte Verbindungen und Reaktionsbedingungen bevorzugt werden
können,
abhängig
von Faktoren wie zum Beispiel der Löslichkeit von Reagenzien, der
Reaktivität
von Reagenzien und bevorzugten Temperaturbereichen. Weitere Erörterungen über aprotische
Lösungsmittel
sind zu finden in Lehrbüchern über organische
Chemie oder in spezialisierten Monographien, zum Beispiel Organic
Solvents Physical Properties and Methods of Purification, 4. Ausgabe,
herausgegeben von John A. Riddick u.a., Band II, in Techniques of
Chemistry Series, John Wiley & Sons,
NY, 1986.
-
Der
Begriff „Aryl", wie hierin verwendet,
bezeichnet ein mono- oder bicyclisches carbocyclisches Ringsystem
mit einem oder zwei aromatischen Ringen, einschließlich, aber
nicht beschränkt
auf, Phenyl, Naphthyl, Tetrahydronaphthyl, Indanyl, Indenyl u. Ä. Arylgruppen
(einschließlich
bicyclischer Arylgruppen) können
unsubstituiert oder mit einem, zwei oder drei Substituenten substituiert
sein, unabhängig
gewählt
aus Niederalkyl, substituiertem Niederalkyl, Haloalkyl, Alkoxy,
Thioalkoxy, Amino, Alkylamino, Dialkylamino, Acylamino, Cyano, Hydroxy,
Halo, Mercapto, Nitro, Carboxaldehyd, Carboxy, Alkoxycarbonyl und
Carboxamid. Zusätzlich
schließen
substituierte Arylgruppen Tetrafluorphenyl und Pentafluorphenyl
ein.
-
Der
Begriff „C3-C12-Cycloalkyl" bezeichnet eine
monovalente Gruppe, abgeleitet von einer monocyclischen oder bicyclischen
gesättigten
carbocyclischen Ringverbindung durch das Entfernen eines einzelnen Wasserstoffatoms.
Beispiele schließen
Cyclopropyl, Cyclobutyl, Cyclopentyl, Cyclohexyl, Bicyclo[2.2.1]-heptyl und
Bicyclo[2.2.2]-octyl ein.
-
Die
Begriffe „Halo" und „Halogen", wie hierin verwendet,
beziehen sich auf ein Atom, das gewählt ist aus Fluor, Chlor, Brom
und Jod.
-
Der
Begriff „Alkylamino" bezieht sich auf
eine Gruppe mit der Struktur -NHR', worin R' Alkyl ist wie zuvor definiert. Beispiele
für Alkylamino
schließen
Methylamino, Ethylamino, Iso propylamino und dergleichen ein.
-
Der
Begriff „Dialkylamino" bezeichnet eine
Gruppe mit der Struktur -NR'R'', worin R' und R'' unabhängig gewählt sind
aus Alkyl wie zuvor definiert. Zusätzlich können R' und R'' zusammengenommen
wahlweise -(CH2)k- sein, worin k eine ganze
Zahl von 2 bis 6 ist. Beispiele für Dialkylamino schließen Dimethylamino,
Diethylaminocarbonyl, Methylethylamino, Piperidino u. Ä. ein.
-
Der
Begriff „Haloalkyl" bezeichnet eine
Alkylgruppe wie oben definiert, mit ein, zwei oder drei Halogenatomen,
die daran gebunden sind, und wird repräsentiert durch Gruppen wie
Chlormethyl, Bromethyl, Trifluormethyl u. Ä.
-
Der
Begriff „Alkoxycarbonyl" steht für eine Estergruppe,
d. h. eine Alkoxygruppe, gebunden an den molekularen Stammanteil
durch eine Carbonylgruppe wie z. B. Methoxycarbonyl, Ethoxycarbonyl
u. Ä.
-
Der
Begriff „Thioalkoxy" bezieht sich auf
eine Alkylgruppe wie zuvor definiert, gebunden an den molekularen
Stammanteil durch ein Schwefelatom.
-
Der
Begriff „Carboxaldehyd", wie hierin verwendet,
bezeichnet eine Gruppe mit der Formel -CHO.
-
Der
Begriff „Carboxy", wie hierin verwendet,
bezeichnet eine Gruppe mit der Formel -CO2H.
-
Der
Begriff „Carboxamid", wie hierin verwendet,
bezeichnet eine Gruppe mit der Formel -CONHR'R'', worin R' und R'' unabhängig gewählt sind aus Wasserstoff oder
Alkyl oder R' und
R'' zusammengenommen wahlweise
-(CH2)k- sein können, worin k eine ganze Zahl
von 2 bis 6 ist.
-
Der
Begriff „Heteroaryl", wie hierin verwendet,
bezeichnet ein cyclisches aromatisches Radikal mit von fünf bis zehn
Ringatomen, von denen eins gewählt
ist aus S, O und N; null, ein oder zwei Ringatome sind zusätzliche
Heteroatome, unabhängig
gewählt
aus S, O und N; und die übrigen
Ringatome sind Kohlenstoff, wobei das Radikal über ein beliebiges der Ringatome,
wie z. B. Pyridyl, Pyrazinyl, Pyrimidinyl, Pyrrolyl, Pyrazolyl, Imidazolyl,
Thiazolyl, Oxazolyl, Isooxazolyl, Thiadiazolyl, Oxadiazolyl, Thiophenyl,
Furanyl, Chinolinyl, Isochinolinyl u. Ä, mit dem Rest des Moleküls verbunden
ist.
-
Der
Begriff „Heterocycloalkyl", wie hierin verwendet,
bezieht sich auf ein nicht aromatisches teilweise ungesättigtes
oder vollständig
gesättigtes
3- bis 10-gliedriges Ringsystem, das einzelne Ringe mit einer Größe von 3
bis 8 Atomen und bi- oder
tricyclische Ringsysteme einschließt, die aromatische sechsgliedrige
Aryl- oder Heteroarylringe, anelliert an einen nicht aromatischen
Ring, einschließen
können.
Diese Heterocycloalkylringe schließen solche mit ein bis drei
Heteroatomen ein, unabhängig
gewählt
aus Sauerstoff, Schwefel und Stickstoff, worin die Stickstoff- und
Schwefel-Heteroatome wahlweise oxidiert sein können und das Stickstoff-Heteroatom
wahlweise quaternisiert sein kann.
-
Repräsentative
Heterocyclen schließen
Pyrrolidinyl, Pyrazolinyl, Pyrazolidinyl, Imidazolinyl, Imidazolidinyl,
Piperidinyl, Piperazinyl, Oxazolidinyl, Isoxazolidinyl, Morpholinyl,
Thiazolidinyl, Isothiazolidinyl und Tetrahydrofuryl ein, sind jedoch
nicht darauf beschränkt.
-
Spezifische
Heterocycloalkylringe, die als nützlich
bei der Herstellung von Verbindungen der Erfindung betrachtet werden,
schließen
Folgende ein: 3-Methyl-4-(3-methylphenyl)piperazin, 3-Methylpiperidin, 4-(Bis-(4-fluorphenyl)methyl)piperazin,
4-(Diphenylmethyl)piperazin, 4-(Ethoxycarbonyl)piperazin, 4-(Ethoxycarbonylmethyl)piperazin,
4-(Phenylmethyl)piperazin, 4-(1-Phenylethyl)piperazin, 4-(1,1-Dimethylethoxycarbonyl)piperazin,
4-(2-(Bis-(2-propenyl)amino)ethyl)piperazin, 4-(2-(Diethylamino)ethyl)piperazin,
4-(2-Chlorphenyl)piperazin,
4-(2-Cyanophenyl)piperazin, 4-(2-Ethoxyphenyl)piperazin,
4-(2-Ethylphenyl)piperazin, 4-(2-Fluorphenyl)piperazin,
4-(2-Hydroxyethyl)piperazin, 4-(2-Methoxyethyl)piperazin, 4-(2-Methoxyphenyl)piperazin,
4-(2-Methylphenyl)piperazin,
4-(2-Methylthiophenyl)piperazin, 4-(2-Nitrophenyl)piperazin, 4-(2-Nitrophenyl)piperazin,
4-(2-Phenylethyl)piperazin,
4-(2-Pyridyl)piperazin, 4-(2-Pyrimidinyl)piperazin, 4-(2,3-Dimethylphenyl)piperazin,
4-(2,4-Difluorphenyl)piperazin,
4-(2,4-Dimethoxyphenyl)piperazin, 4-(2,4-Dimethylphenyl)piperazin, 4-(2,5-Dimethylphenyl)piperazin, 4-(2,6-Dimethylphenyl)piperazin,
4-(3-Chlorphenyl)piperazin, 4-(3-Methylphenyl)piperazin,
4-(3-Trifluormethylphenyl)piperazin, 4-(3,4-Dichlorphenyl)piperazin,
4-(3,4-Dimethoxyphenyl)piperazin, 4-(3,4-Dimethylphenyl)piperazin,
4-(3,4-Methylendioxyphenyl)piperazin, 4-(3,4,5-Trimethoxyphenyl)piperazin,
4-(3,5-Dichlorphenyl)piperazin, 4-(3,5-Dimethoxyphenyl)piperazin, 4-(4-(Phenylmethoxy)phenyl)piperazin,
4-(4-(1,1-Dimethylethyl)phenylmethyl)piperazin, 4-(4-Chlor-3-trifluormethylphenyl)piperazin,
4-(4-Chlorphenyl)-3-methylpiperazin,
4-(4-Chlorphenyl)piperazin, 4-(4-Chlorphenyl)piperazin, 4-(4-Chlorphenylmethyl)piperazin,
4-(4-Fllorphenyl)piperazin, 4-(4-Methoxyphenyl)piperazin, 4-(4-Methylphenyl)piperazin,
4-(4-Nitrophenyl)piperazin, 4-(4-Trifluormethylphenyl)piperazin,
4-Cyclohexylpiperazin, 4-Ethylpiperazin,
4-Hydroxy-4-(4-chlorphenyl)methylpiperidin, 4-Hydroxy-4-phenylpiperidin, 4-Hydroxypyrrolidin,
4-Methylpiperazin,
4-Phenylpiperazin, 4-Piperidinylpiperazin, 4-((2-Furanyl)carbonyl)piperazin, 4-((1,3-Dioxolan-5-yl)methyl)piperazin,
6-Fluor-1,2,3,4-tetrahydro-2-methylchinolin, 1,4-Diazacycloheptan, 2,3-Dihydroindolyl,
3,3-Dimethylpiperidin, 4,4-Ethylendioxypiperidin, 1,2,3,4-Tetrahydroisochinolin,
1,2,3,4-Tetrahydrochinolin, Azacyclooctan, Decahydrochinolin, Piperazin,
Piperidin, Pyrrolidin, Thiomorpholin und Triazol.
-
Der
Begriff „Heteroarylalkyl", wie hierin verwendet,
bezeichnet eine Heteroarylgruppe wie oben definiert, gebunden an
den molekularen Stammanteil durch eine Alkylengruppe, worin die
Alkylengruppe ein bis vier Kohlenstoffatome hat.
-
„Hydroxyschutzgruppe", wie hierin verwendet,
bezeichnet eine leicht entfernbare Gruppe, von der im Fachgebiet
bekannt ist, dass sie eine Hydroxylgruppe vor unerwünschter
Reaktion während
synthetischer Verfahren schützt
und selektiv entfernbar ist. Die Verwendung von Hydroxyschutzgruppen
ist im Fachgebiet dafür gut
bekannt, dass sie Gruppen während
eines synthetischen Verfahrens vor unerwünschten Reaktionen schützt, und
viele solche Schutzgruppen sind bekannt, siehe z. B. T.H. Greene
und P.G.M. Wuts, Protective Groups in Organic Synthesis, 2. Ausgabe,
John Wiley & Sons,
New York (1991). Beispiele für Hydroxyschutzgruppen
schließen
Folgendes ein, sind aber nicht darauf beschränkt: Methylthiomethyl, Tert-dimethylsilyl, Tertbutyldiphenylsilyl,
Ether, wie z. B. Methoxymethyl, und Ester, einschließlich Acetylbenzoyl,
u. Ä.
-
Der
Begriff „Ketonschutzgruppe", wie hierin verwendet,
bezeichnet eine leicht entfernbare Gruppe, von der im Fachgebiet
bekannt ist, dass sie eine Ketongruppe während synthetischer Verfahren
vor unerwünschten
Reaktionen schützt
und selektiv entfernbar ist. Die Verwendung von Ketonschutzgruppen
ist im Fachgebiet gut dafür
bekannt, dass sie Gruppen während
eines synthetischen Verfahrens vor unerwünschten Reaktionen schützt, und
viele solcher Schutzgruppen sind bekannt, siehe z.B. T.H. Greene
und P.G.M. Wuts, Protective Groups in Organic Synthesis, 2. Ausgabe,
John Wiley & Sons,
New York (1991). Beispiele für
Ketonschutzgruppen schließen
Folgendes ein, sind aber nicht darauf beschränkt: Ketale, Oxime, O-substituierte
Oxime, z. B. O-Benzyloxim, O-Phenylthiomethyloxim, 1-Isopropoxycyclohexyloxim
u. Ä.
-
Der
Begriff „geschütztes Hydroxy" bezeichnet eine
Hydroxylgruppe, geschützt
mit einer Hydroxyschutzgruppe wie oben definiert, einschließlich z.
B. Benzoyl-, Acetyl-, Trimethylsilyl-, Triethylsilyl-, Methoxymethylgruppen.
-
Der
Begriff „protogenes
organisches Lösungsmittel", wie hierin verwendet,
bezeichnet ein Lösungsmittel,
das dazu neigt, Protonen zu liefern, wie z. B. ein Alkohol, z. B.
Methanol, Ethanol, Propanol, Isopropanol, Butanol, t-Butanol u.Ä. Solche
Lösungsmittel
sind dem Fachmann gut bekannt, und es wird für den Fachmann offensichtlich
sein, dass einzelne Lösungsmittel
oder Mischungen davon für
bestimmte Verbindungen und Reaktionsbedingungen bevorzugt werden
können,
abhängig
von Faktoren wie z. B. der Löslichkeit
von Reagenzien, Reaktivität
von Reagenzien und bevorzugten Temperaturbereichen. Weitere Abhandlungen über protogene
Lösungsmittel
sind in Lehrbüchern
für organische
Chemie oder in spezialisierten Monographien zu finden, z. B.: Organic
Solvents Physical Properties and Methods of Purification, 4. Ausgabe,
herausgegeben von John A. Riddick u. a., Band II, in der Techniques
of Chemistry Series, John Wiley & Sons,
NY, 1986.
-
Der
Begriff „substituiertes
Aryl", wie hierin
verwendet, bezeichnet eine Arylgruppe wie hierin definiert, substituiert
durch unabhängiges
Ersetzen von einem, zwei oder drei der Wasserstoffatome daran durch
Cl, Br, F, I, OH, CN, C1-C3-Alkyl, C1-C6-Alkoxy, C1-C6-Alkoxy substituiert
mit Aryl, Haloalkyl, Thioalkoxy, Amino, Alkylamino, Dialkylamino,
Mercapto, Nitro, Carboxaldehyd, Carboxy, Alkoxycarbonyl und Carboxamid.
Zusätzlich kann
jeder beliebige Substituent eine Aryl-, Heteroaryl- oder Heterocycloalkylgruppe
sein. Außerdem
schließen
substituierte Arylgruppen Tetrafluorphenyl und Pentafluorphenyl
ein.
-
Der
Begriff „substituiertes
Heteroaryl", wie
hierin verwendet, bezeichnet eine Heteroarylgruppe wie hierin definiert,
substituiert durch unabhängiges
Ersetzen von einem, zwei oder drei der Wasserstoffatome daran durch
Cl, Br, F, I, OH, CN, C1-C3-Alkyl,
C1-C6-Alkoxy, C1-C6-Alkoxy substituiert
mit Aryl, Haloalkyl, Thioalkoxy, Amino, Alkylamino, Dialkylamino,
Mercapto, Nitro, Carboxaldehyd, Carboxy, Alkoxycarbonyl und Carboxamid.
Zusätzlich
kann jeder beliebige Substituent eine Aryl-, Heteroaryl- oder Heterocycloalkylgruppe
sein.
-
Der
Begriff „substituiertes
Heterocycloalkyl",
wie hierin verwendet, bezieht sich auf eine Heterocycloalkylgruppe
wie oben definiert, substituiert durch unabhängiges Ersetzen von einem,
zwei oder drei der Wasserstoffatome daran durch Cl, Br, F, I, OH,
CN, C1-C3-Alkyl,
C1-C6-Alkoxy, C1-C6-Alkoxy substituiert
mit Aryl, Haloalkyl, Thioalkoxy, Amino, Alkylamino, Dialkylamino,
Mercapto, Nitro, Carboxaldehyd, Carboxy, Alkoxycarbonyl und Carboxamid.
Zusätzlich
kann ein beliebiger Substituent eine Aryl-, Heteroaryl- oder Heterocycloalkylgruppe
sein.
-
In
den Verbindungen der vorliegenden Erfindung können zahlreiche Asymmetriezentren
existieren. Soweit nicht anders vermerkt, berücksichtigt die vorliegende
Erfindung die verschiedenen Stereoisomere und Mischungen davon.
Dementsprechend ist immer dann, wenn eine Bindung durch eine Wellenlinie
dargestellt ist, gemeint, dass eine Mischung aus Stereo-Orientierungen
oder ein einzelnes Isomer mit zugeordneter oder nicht zugeordneter
Orientierung vorhanden sein kann.
-
Wie
hierin verwendet, bezeichnet der Begriff „pharmazeutisch verträgliches
Salz" solche Salze,
die, innerhalb des Bereichs der fundierten medizinischen Beurteilung,
geeignet sind zur Verwendung im Kontakt mit den Geweben von Menschen
und niederen Tieren ohne unerwünschte
Toxizität,
Reizung, allergische Reaktion u. Ä., und die mit einem vernünftigen
Nutzen-Risiko-Verhältnis
im Einklang stehen. Pharmazeutisch verträgliche Salze sind im Fachgebiet
gut bekannt. Zum Beispiel beschreiben S. M. Berge u. a. pharmazeutisch verträgliche Salze
im Detail in J. Pharmaceutical Sciences, 66: 1-9 (1977). Die Salze
können
in situ während der
abschließenden
Isolierung und Reinigung der Verbindungen der Erfindung hergestellt
werden, oder separat durch Reagieren der freien Basenfunktion mit
einer geeigneten organischen Säure.
Beispiele für
pharmazeutisch verträgliche,
nicht toxische Säureadditionssalze
sind Salze einer Aminogruppe, gebildet mit anorganischen Säuren, wie
z. B. Salzsäure,
Bromwasserstoffsäure,
Phosphorsäure,
Schwefelsäure
und Perchlorsäure,
oder mit organischen Säuren,
wie z. B. Essigsäure,
Oxalsäure,
Maleinsäure,
Weinsäure,
Zitronensäure, Bernsteinsäure oder
Malonsäure,
oder durch Anwendung anderer Verfahren, die im Fachgebiet angewandt werden,
wie z. B. Ionenaustausch. Andere pharmazeutisch verträgliche Salze
schließen
Folgendes ein: Adipat, Alginat, Ascorbat, Aspartat, Benzensulfonat,
Benzoat, Bisulfat, Borat, Butyrat, Camphorat, Camphorsulfonat, Citrat,
Cyclopentanpropionat, Digluconat, Dodecylsulfat, Ethansulfonat,
Formiat, Fumarat, Glucoheptonat, Glycerophosphat, Gluconat, Hemisulfat,
Heptanoat, Hexanoat, Hydroiodid, 2-Hydroxy-ethansulfonat, Lactobionat,
Lactat, Laurat, Laurylsulfat, Malat, Maleat, Malonat, Methansulfonat,
2-Naphthalensulfonat,
Nicotinat, Nitrat, Oleat, Oxalat, Palmitat, Pamoat, Pectinat, Persulfat,
3-Phenylpropionat, Phosphat, Picrat, Pivalat, Propionat, Stearat,
Succinat, Sulfat, Tartrat, Thiocyanat, p-Toluensulfonat, Undecanoat,
Valaratsalze u. Ä.
Repräsentative
Alkali- oder Erdalkalimetallsalze schließen Natrium, Lithium, Kalium,
Kalzium, Magnesium u. Ä.
ein. Weitere pharmazeutisch verträgliche Salze schließen, wenn
angemessen, nicht toxisches Ammonium, quaternäres Ammonium und Aminkationen
ein, die mit Hilfe von Gegenionen gebildet werden, wie z. B. Halogenid, Hydroxid,
Carboxylat, Sulfat, Phosphat, Nitrat, Niederalkylsulfonat und Arylsulfonat.
-
Wie
hierin verwendet, bezeichnet der Begriff „pharmazeutisch verträglicher
Ester" Ester, die
in vivo hydrolysieren und solche einschließen, die im menschlichen Körper schnell
abgebaut werden, um die Stammverbindung oder ein Salz davon zu hinterlassen.
Geeignete Estergruppen schließen
zum Beispiel solche ein, die von pharmazeutisch verträglichen
aliphatischen Carbonsäuren
abgeleitet sind, insbesondere Alkan-, Alken-, Cycloalkansäuren und
Alkan-Dioic Acids, in denen jeder Alkyl- oder Alkenylanteil vorteilhafterweise
nicht mehr als 6 Kohlenstoffatome hat. Beispiele für spezielle
Ester schließen
Formiate, Acetate, Propionate, Butyrate, Acrylate und Ethylsuccinate
ein.
-
Der
Begriff „pharmazeutisch
verträgliche
Prodrugs", wie hierin
verwendet, bezeichnet solche Prodrugs der Verbindungen der vorliegenden
Erfindung, die, innerhalb des Bereichs der fundierten medizinischen
Beurteilung, geeignet sind zur Verwendung im Kontakt mit den Geweben
von Menschen und niederen Tieren ohne unerwünschte Toxizität, Reizung,
allergische Reaktion u. Ä.,
in Übereinstimmung
mit einem vernünftigen
Nutzen-Risiko-Verhältnis
und wirksam für
ihren beabsichtigten Gebrauch, ebenso wie die zwitterionischen Formen,
soweit möglich,
der Verbindungen der Erfindung. Der Begriff „Prodrug" bezieht sich auf Verbindungen, die
schnell in vivo umgewandelt werden, um die Stammverbindung mit der
obigen Formel zu ergeben, z. B. durch Hydrolyse in Blut. Eine gründliche
Erörterung
ist zu finden in T. Higuchi und V. Stella, Pro-drugs as Novel Delivery
Systems, Band 14 der A.C.S. Symposium Series, und in Edward B. Roche,
Hrsg., Bioreversible Carriers in Drug Design, American Pharmaceutical
Association and Pergamon Press, 1987.
-
Antibakterielle Aktivität
-
Repräsentative
Verbindungen der vorliegenden Erfindung wurden in vitro auf antibakterielle
Aktivität getestet
wie folgt: Zwölf
Petrischalen, die sukzessive wässerige
Verdünnungen
der Testverbindung, gemischt mit 10 ml sterilisiertem Brain Heart
Infusion (BHI)-Agar (Difco 0418-01-5), enthielten, wurden hergestellt.
Jede Schale wurde mit 1:100 (oder 1:10, bei langsam wachsenden Stämmen, wie
z. B. Micrococcus und Streptococcus,)-Verdünnungen mit bis zu 32 verschiedenen
Mikroorganismen unter Verwendung eines Steers-Replikatorblocks beimpft. Die beimpften
Schalen wurden 20 bis 24 Stunden lang bei 35-37°C inkubiert. Zusätzlich wurde
unter Verwendung von BHI-Agar, das keine Testverbindung enthielt,
eine Kontrollschale hergestellt und am Anfang und Ende jedes Tests
inkubiert.
-
Eine
zusätzliche
Schale mit einer Verbindung, die bekannte Empfindlichkeitsmuster
in Bezug auf die getesteten Organismen aufwies und zu derselben
Klasse von Antibiotika gehörte
wie die Testverbindung, wurde ebenfalls hergestellt und inkubiert,
als zusätzliche
Kontrolle und um Vergleichbarkeit zwischen den Tests zu ermöglichen.
Zu diesem Zweck wurde Erythromycin A verwendet.
-
Nach
der Inkubation wurde jede Schale visuell überprüft. Die minimale inhibitorische
Konzentration (minimum inhibitory concentration, MIC) wurde definiert
als die niedrigste Konzentration von Arzneistoff, die im Vergleich
zur Wachstumskontrolle zu keinem Wachstum, einer leichten Trübung oder
spärlichen
isolierten Kolonien am Beimpfungspunkt führte. Die Ergebnisse dieses
Tests, dargestellt unten in Tabelle 2, zeigen die antibakterielle
Aktivität
der Verbindungen der Erfindung. Tabelle
1 Antibakterielle
Aktivität
(MICs) ausgewählter
Verbindungen
Tabelle
1 (Forts.)
Tabelle
1 (Forts.)
Tabelle
1 (Forts.)
Tabelle
1 (Forts.)
Tabelle
1 (Forts.)
Tabelle
1 (Forts.)
Tabelle
1 (Forts.)
Tabelle
1 (Forts.)
Tabelle
1 (Forts.)
Tabelle
1 (Forts.)
Tabelle
1 (Forts.)
Tabelle
1 (Forts.)
Tabelle
1 (Forts.)
Tabelle
1 (Forts.)
Tabelle
1 (Forts.)
Tabelle
1 (Forts.)
Tabelle
1 (Forts.)
Tabelle
1 (Forts.)
Tabelle
1 (Forts.)
Tabelle
1 (Forts.)
Tabelle
1 (Forts.)
-
Pharmazeutische Zusammensetzungen
-
Die
pharmazeutischen Zusammensetzungen der vorliegenden Erfindung umfassen
eine therapeutisch wirksame Menge einer Verbindung der vorliegenden
Erfindung, formuliert zusammen mit einem oder mehreren pharmazeutisch
verträglichen
Trägern.
Wie hierin verwendet, bezeichnet der Begriff „pharmazeutisch verträglicher
Träger" einen nicht toxischen,
inerten, festen, halbfesten oder flüssigen Füllstoff, ein Verdünnungsmittel,
Verkapselungsmaterial oder einen Formulierungshilfsstoff beliebiger
Art. Einige Beispiele für
Materialien, die als pharmazeutisch verträgliche Träger dienen können, sind
Zucker, wie z. B. Laktose, Glukose und Saccharose; Stärken, wie
z. B. Maisstärke
und Kartoffelstärke;
Zellulose und deren Derivate, wie z. B. Natriumcarboxymethylzellulose,
Ethylzellulose und Zelluloseacetat; pulverisierter Tragant; Malz;
Gelatine; Talk; Bindemittel, wie z. B. Kakaobutter und Suppositorienwachse; Öle, wie
z. B. Erdnussöl,
Baumwollsamenöl,
Safloröl,
Sesamöl,
Olivenöl,
Maiskeimöl
und Sojabohnenöl;
Glykole, wie z. B. Propylenglykol; Ester, wie z. B. Ethyloleat und
Ethyllaurat; Agar; Puffersubstanzen, wie z. B. Magnesiumhydroxid
und Aluminiumhydroxid; Alginsäure;
pyrogenfreies Wasser; isotonische Salzlösung; Ringer-Lösung; Ethylalkohol
und Phosphatpufferlösungen,
ebenso wie andere nicht toxische verträgliche Schmiermittel, wie z.
B. Natriumlaurylsulfat und Magnesiumstearat, ebenso wie Farbstoffe,
Freisetzungsmittel, Beschichtungsmittel, Süß-, Geschmacks- und Duftstoffe,
Konservierungsstoffe und Antioxidantien können ebenfalls in der Zusammensetzung
vorhanden sein, je nach Beurteilung des Herstellers. Die pharmazeutischen
Zusammensetzungen dieser Erfindung können Menschen und anderen Tieren
oral, rektal, parenteral, intrazisternal, intravaginal, intraperitoneal,
topisch (z. B. durch Pulver, Salben oder Tropfen), bukkal oder als
orales oder nasales Spray verabreicht werden.
-
Flüssige Dosierformen
zur oralen Verabreichung schließen
pharmazeutisch verträgliche
Emulsionen, Mikroemulsionen, Lösungen,
Suspensionen, Sirupe und Elixiere ein. Zusätzlich zu den aktiven Verbindungen können die
flüssigen
Dosierformen inerte Verdünnungsmittel
enthalten, die allgemein im Fachgebiet verwendet werden, wie z.
B. Wasser oder andere Lösungsmittel,
Lösungsvermittler
und Emulgatoren, wie z. B. Ethylalkohol, Isopropylalkohol, Ethylcarbonat,
Ethylacetat, Benzylalkohol, Benzylbenzoat, Propylenglykol, 1,3-Butylenglykol,
Dimethylformamid, Öle
(insbesondere Baumwollsamen-, Erdnuss-, Mais-, Keim-, Oliven-, Rizinus- und
Sesamöle),
Glycerol, Tetrahydrofurfurylalkohol, Polyethylenglykole und Fettsäureester
von Sorbitan, und Mischungen davon. Außer inerten Verdünnungsmitteln
können
die oralen Zusammensetzungen auch Hilfsstoffe einschließen, wie
z. B. Benetzungsmittel, Emulgatoren und Suspendiermittel, Süß-, Geschmacks-
und Duftstoffe.
-
Injizierbare
Präparate,
z. B. sterile injizierbare wässerige
oder ölige
Suspensionen, können
gemäß dem bekannten
Wissensstand unter Verwendung geeigneter Dispergier- oder Benetzungsmittel
und Suspendiermittel formuliert werden. Das sterile injizierbare
Präparat
kann auch eine sterile injizierbare Lösung, Suspension oder Emulsion
in einem nicht toxischen parenteral verträglichen Verdünnungsmittel
oder Lösungsmittel
sein, z. B. als Lösung
in 1,3-Butandiol. Unter den verträglichen Bindemitteln und Lösungsmitteln,
die verwendet werden können,
sind Wasser, Ringer-Lösung,
U.S.P. und isotonische Natriumchloridlösung. Zusätzlich werden sterile fette Öle herkömmlicherweise
als Lösungsmittel
oder Suspendiermittel verwendet. Zu diesem Zweck kann jedes milde
fette Öl
verwendet werden, einschließlich
synthetischer Mono- oder
Diglyceride. Außerdem
werden Fettsäuren,
wie z. B. Ölsäure, bei
der Herstellung von Injektabilia verwendet.
-
Die
injizierbaren Formulierungen können
sterilisiert werden, z. B. durch Filtration durch einen Bakterien
zurückhaltenden
Filter oder durch Einschluss von Sterilisierungsmitteln in der Form
steriler fester Zusammensetzungen, die vor dem Gebrauch in sterilem
Wasser oder einem anderen sterilen injizierbaren Medium aufgelöst oder
dispergiert werden können.
-
Um
die Wirkung eines Arzneistoffs zu verlängern, ist es häufig wünschenswert,
die Absorption des Arzneistoffs aus subkutaner oder intramuskulärer Injektion
zu verlangsamen. Dies kann erreicht werden durch die Verwendung
einer flüssigen
Suspension von kristallinem oder amorphem Material mit schwacher
Wasserlöslichkeit.
Die Absorptionsgeschwindigkeit des Arzneistoffs hängt dann
von seiner Auflösungsgeschwindigkeit ab,
die wiederum von der Kristallgröße und der
kristallinen Form abhängen
kann. Alternativ wird die verzögerte Absorption
einer parenteral verabreichten Arzneimittelform durch Auflösen oder
Suspendieren des Arzneimittels in einem öligen Bindemittel erzielt.
Injizierbare Depotformen werden hergestellt durch Bilden mikroverkapselter
Matrizen des Arzneistoffs in biologisch abbaubaren Polymeren, wie
z. B. Polylaktid-Polyglykolid. Je nach Mengenverhältnis von
Arzneistoff zu Polymer und der Art des speziellen verwendeten Polymers
kann die Geschwindigkeit der Arzneimittelfreisetzung kontrolliert
werden. Beispiele für
andere biologisch abbaubare Polymere schließen Poly(orthoester) und Poly(anhydride)
ein. Depot-injizierbare Formulierungen werden auch hergestellt durch
Einschließen
des Arzneistoffs in Liposome oder Mikroemulsionen, die mit Körpergeweben
verträglich
sind.
-
Zusammensetzungen
zur rektalen oder vaginalen Verabreichung sind vorzugsweise Suppositorien, die
hergestellt werden können
durch Mischen der Verbindungen dieser Erfindung mit geeigneten nicht
reizenden Bindemitteln oder Trägern,
wie z.B. Kakaobutter, Polyethylenglykol oder einem Suppositorienwachs,
die bei Raumtemperatur fest, aber bei Körpertemperatur flüssig sind
und daher im Rektum oder in der Vaginalhöhle schmelzen und die aktive
Verbindung freisetzen.
-
Feste
Dosierformen zur oralen Verabreichung schließen Kapseln, Tabletten, Pillen,
Pulver und Granulate ein. In solchen festen Dosierformen wird die
aktive Verbindung mit mindestens einem inerten, pharmazeutisch verträglichen
Bindemittel oder Träger
gemischt, wie z. B. Natriumcitrat oder Dicalciumphosphat, und/oder a)
Füllstoffen
oder Streckmitteln, wie z. B. Stärken,
Laktose, Saccharose, Glukose, Mannitol und Kieselsäure, b)
Bindemitteln, wie z. B. Carboxymethylzellulose, Alginaten, Gelatine,
Polyvinylpyrrolidinon, Saccharose und Akaziengummi, c) Feuchthaltemitteln,
wie z. B. Glycerol, d) Desintegrationsmitteln, wie z. B. Agar-Agar,
Calciumcarbonat, Kartoffel- oder Tapiokastärke, Alginsäure, bestimmten Silikaten und
Natriumcarbonat, e) Lösungsverzögerungsmitteln,
wie z. B. Paraffin, f) Absorptionsbeschleunigern, wie z. B. quaternären Ammoniumverbindungen,
g) Benetzungsmitteln, wie z. B. Cetylalkohol und Glycerolmonostearat,
h) Absorptionsmitteln, wie z. B. Kaolin und Bentonitton, und i)
Schmiermitteln, wie z. B. Talk, Calciumstearat, Magnesiumstearat,
festen Polyethylenglykolen, Natriumlaurylsulfat und Mischungen davon.
Im Falle von Kapseln, Tabletten und Pillen kann die Dosierform auch
Puffersubstanzen umfassen.
-
Feste
Zusammensetzungen ähnlicher
Art können
auch als Füllstoffe
in weich und hart gefüllten
Gelatinekapseln eingesetzt werden, unter Verwendung von Bindemitteln
wie z. B. Laktose oder Milchzucker, ebenso wie hochmolekulargewichtigen
Polyethylenglykolen und dergleichen.
-
Die
festen Dosierformen von Tabletten, Dragees, Kapseln, Pillen und
Granulaten können
mit Schichten und Hüllen,
wie z. B. magensaftresistenten und anderen Beschichtungen hergestellt
werden, die im Fachgebiet der pharmazeutischen Formulierung gut
bekannt sind. Sie können
wahlweise Trübungsmittel
enthalten und außerdem
eine solche Zusammensetzung haben, dass sie den (die) aktiven Bestandteil
(e) nur oder vorzugsweise in einem bestimmten Teil des Magen-Darm-Trakts freisetzen,
wahlweise in verzögerter
Art und Weise. Beispiele für
Einbettungszusammensetzungen, die verwendet werden können, schließen polymere
Substanzen und Wachse ein.
-
Feste
Zusammensetzungen ähnlicher
Art können
auch als Füllstoffe
in weich und hart gefüllten
Gelatinekapseln eingesetzt werden, unter Verwendung von Bindemitteln
wie z. B. Laktose oder Milchzucker ebenso wie hochmolekulargewichtigen
Polyethylenglykolen und dergleichen.
-
Die
aktiven Verbindungen können
auch in mikroverkapselter Form mit einem oder mehreren Bindemitteln
wie oben erwähnt vorliegen.
Die festen Dosierformen von Tabletten, Dragees, Kapseln, Pillen
und Granulaten können
mit Schichten und Hüllen,
wie z. B. magensaftresistenten Beschichtungen, freisetzungskontrollierenden
Beschichtungen und anderen Beschichtungen hergestellt werden, die
im Fachgebiet der pharmazeutischen Formulierung gut bekannt sind.
In solchen festen Dosierformen kann die aktive Verbindung mit mindestens
einem inerten Verdünnungsmittel
gemischt werden, wie z. B. Saccharose, Laktose oder Stärke. Solche
Dosierformen können
auch, wie es normale Praxis ist, weitere Substanzen außer inerten
Verdünnungsmitteln
umfassen, z. B. Tablettierungs-Schmiermittel
und andere Tablettierungshilfen, wie z. B. Magnesiumstearat und
mikrokristalline Zellulose. Im Falle von Kapseln, Tabletten und
Pillen können
die Dosierformen auch Puffersubstanzen umfassen. Sie können wahlweise
Trübungsmittel
enthalten und außerdem
eine solche Zusammensetzung haben, dass sie den (die) aktiven Bestandteil
e) nur oder vorzugsweise in einem bestimmten Teil des Magen-Darm-Trakts
freisetzen, wahlweise in verzögerter
Art und Weise. Beispiele für
Einbettungszusammensetzungen, die verwendet werden können, schließen polymere
Substanzen und Wachse ein.
-
Dosierformen
zur topischen oder transdermalen Verabreichung einer Verbindung
dieser Erfindung schließen
Salben, Pasten, Cremes, Lotionen, Gele, Puder, Lösungen, Sprays, Inhalationsmittel
oder Pflaster ein. Der aktive Bestandteil wird unter sterilen Bedingungen
mit einem pharmazeutisch verträglichen
Träger
und allen eventuell benötigten
Konservierungsstoffen oder Puffern gemischt. Ophthalmologische Formulierungen, Ohrentropfen,
Augentropfen werden ebenfalls als innerhalb des Schutzumfangs dieser
Erfindung liegend betrachtet.
-
Die
Salben, Pasten, Cremes und Gele können, zusätzlich zu einer aktiven Verbindung
dieser Erfindung, Bindemittel enthalten, wie z. B. tierische und
pflanzliche Fette, Öle,
Wachse, Paraffine, Stärke,
Tragant, Zellulosederivate, Polyethylenglykole, Silikone, Bentonite,
Kieselsäure,
Talk und Zinkoxid oder Mischungen davon.
-
Puder
und Sprays können,
zusätzlich
zu den Verbindungen dieser Erfindung, Bindemittel enthalten, wie
z. B. Laktose, Talk, Kieselsäure,
Aluminiumhydroxid, Calciumsilikate und Polyamidpulver oder Mischungen dieser
Substanzen. Sprays können
außerdem
herkömmliche
Treibmittel enthalten, wie z. B. Fluorchlorkohlenwasserstoffe.
-
Transdermale
Pflaster haben den zusätzlichen
Vorteil, dass sie eine kontrollierte Freigabe einer Verbindung an
den Körper
bereitstellen. Solche Dosierformen können hergestellt werden durch
Auflösen
oder Dispensieren der Verbindung in dem geeigneten Medium. Absorptionsbeschleuniger
können
ebenfalls verwendet werden, um den Fluss der Verbindung durch die
Haut zu erhöhen.
Die Geschwindigkeit kann entweder durch Bereitstellung einer geschwindigkeitskontrollierenden
Membran oder durch Dispergieren der Verbindung in einer Polymermatrix
oder einem Gel gesteuert werden.
-
Gemäß den Behandlungsverfahren
der vorliegenden Erfindung werden bakterielle Infektionen bei einem
Patienten, wie z. B. einem Menschen oder niederen Säugetier,
behandelt oder verhindert durch Verabreichung einer therapeutisch
wirksamen Menge einer Verbindung der Erfindung an den Patienten,
in solchen Mengen und über
einen solchen Zeitraum, wie nötig
ist, um das gewünschte
Ergebnis zu erzielen. Mit einer „therapeutisch wirksamen Menge" einer Verbindung
der Erfindung ist eine Menge der Verbindung gemeint, die ausreicht,
um bakterielle Infektionen zu behandeln, bei einem vernünftigen
Nutzen-Risiko-Verhältnis, das
auf jede medizinische Behandlung anwendbar ist. Es versteht sich
jedoch, dass über
die Gesamt-Tagesdosis der Verbindungen und Zusammensetzungen der
vorliegenden Erfindung innerhalb des Bereichs der fundierten medizinischen
Beurteilung der behandelnde Arzt entscheiden wird. Die spezifische
therapeutisch wirksame Dosis für
einen bestimmten Patienten hängt
ab von einer Vielzahl von Faktoren, einschließlich der behandelten Erkrankung
und deren Schweregrad, der Wirksamkeit der spezifischen verwendeten
Verbindung, der spezifischen verwendeten Zusammensetzung, des Alters,
Körpergewichts,
allgemeinen Gesundheitszustands, Geschlechts und der Ernährung des
Patienten, der Verabreichungszeit, des Verabreichungswegs und der
Ausscheidungsrate der spezifischen verwendeten Verbindung, der Behandlungsdauer,
Arzneimitteln, die in Kombination oder gleichzeitig mit der spezifischen
verwendeten Verbindung eingesetzt werden, und ähnlicher Faktoren, die im medizinischen
Fachgebiet gut bekannt sind.
-
Die
Gesamt-Tagesdosis der Verbindungen dieser Erfindung, die einem Menschen
oder anderen Säugetier
in einzelnen oder geteilten Dosen verabreicht werden, kann z. B.
von 0,01 bis 50mg/kg Körpergewicht oder
häufiger
von 0,1 bis 25 mg/kg Körpergewicht
betragen. Einzeldosiszusammensetzungen können solche Mengen oder Teilmengen
davon enthalten, um die Tagesdosis zu bilden. Im Allgemeinen umfassen
Behandlungsregime gemäß der vorliegenden
Erfindung die Verabreichung von ungefähr 10 mg bis ungefähr 2000
mg der Verbindung(en) dieser Erfindung pro Tag in Einzel- oder Mehrfachdosen
an einen Patienten, der eine solche Behandlung benötigt.
-
Abkürzungen
-
Abkürzungen,
die in den Beschreibungen des Schemas und den folgenden Beispielen
verwendet wurden, sind: AIBN für
Azobisisobutyronitril; Bu3SnH für Tributylzinnhydrid;
CDI für
Carbonyldiimidazol; DBU für 1,8-Diazabicyclo[5.4.0]undec-7-en;
DEAD für
Diethylazodicarboxylat; DMF für
Dimethylformamid; DMSO für Dimethylsulfoxid;
DPPA für
Diphenylphosphorylazid; Et3N für Triethylamin;
EtOAc für
Ethylacetat; Et2O für Diethylether; EtOH für Ethanol;
HOAc für
Essigsäure;
MeOH für
Methanol; NaN(TMS)2 für Natrium-bis(trimethylsilyl)amid;
NMMO für
N-Methylmorpholin-N-oxid;
TEA für
Triethylamin; THF für
Tetrahydrofuran und TPP für Triphenylphosphin.
-
Synthetische Verfahren
-
Die
Verbindungen und Verfahren der vorliegenden Erfindung sind besser
verständlich
im Zusammenhang mit den folgenden synthetischen Schemata I-VI (zu
finden nach dem Text, der die Schemata beschreibt), die die Verfahren
veranschaulichen, durch welche die Verbindungen der Erfindung hergestellt
werden können.
-
Die
Verbindungen der vorliegenden Erfindung werden hergestellt durch
die repräsentativen
Verfahren, die unten beschrieben sind. Die Gruppen A, B, D, E, W,
X, Y, Z, Ra, Rb,
Rc und Rd sind wie
oben definiert, soweit unten nicht anders angegeben.
-
Die
Herstellung der Verbindungen der Erfindung mit der Formel VIII aus
Erythromycin A ist in den Schemata Ia und Ib skizziert. Die Herstellung
von geschütztem
Erythromycin A ist in folgenden United States-Patenten beschrieben:
US 4,990,602 ;
US 4,331,803 ;
US 4,680,368 ;
US 4,670,549 ; und in der Europäischen Patentanmeldung
EP 260 938 . Im Allgemeinen
wird die C-9-Carbonylgruppe
der Verbindung 1 als ein Oxim geschützt (V ist =N-O-R
3 oder
=N-O-C(R
8) (R
9)-O-R
3, worin R
3 oben
definiert ist und R
8 und R
9 jeweils unabhängig gewählt sind
aus der Gruppe bestehend aus (a) Wasserstoff, (b) unsubstituiertem
C
1-C
12-Alkyl, (c) C
1-C
12-Alkyl, substituiert
mit Aryl, und (d) C
1-C
12-Alkyl,
substituiert mit substituiertem Aryl, oder R
9 und
R
10, zusammengenommen mit dem Kohlenstoff,
an welchen sie gebunden sind, einen C
3-C
12-Cycloalkylring
bilden). Eine besonders bevorzugte Carbonylschutzgruppe V ist O-(1-Isopropoxycyclohexyl)oxim.
-
Die
2'- und 4''-Hydroxygruppen von 2 werden geschützt durch
Reaktion mit einem geeigneten Hydroxyschutzreagens, wie z.B. denen,
die von T.W. Greene und P.G.M. Wuts in Protective Groups in Organic
Synthesis, 2. Ausgabe, John Wiley & Son, Inc., 1991, beschrieben sind.
Hydroxyschutzgruppen schließen
z. B. Essigsäureanhydrid,
Benzoesäureanhydrid,
Benzylchlorformiat, Hexarnethyldisilazan oder ein Trialkylsilylchlorid
in einem aprotischen Lösungsmittel
ein. Beispiele für
aprotische Lösungsmittel
sind Dichlormethan, Chloroform, DMF, Tetrahydrofuran (THF), N-Methylpyrrolidinon,
Dimethylsulfoxid, Diethylsulfoxid, N,N-Dimethylformamid, N,N-Dimethylacetamid,
Hexamethylphosphortriamid, eine Mischung davon oder eine Mischung eines
dieser Lösungsmittel
mit Ether, Tetrahydrofuran, 1,2-Dimethoxyethan, Acetonitril, Ethylacetat,
Aceton und dergleichen. Aprotische Lösungsmittel beeinträchtigen
die Reaktion nicht und sind vorzugsweise Dichlormethan, Chloroform,
DMF, Tetrahydrofuran (THF), N-Methylpyrrolidinon oder eine Mischung
davon. Der Schutz der 2'-
und 4''-Hydroxygruppen von
2 kann sequenziell oder gleichzeitig durchgeführt werden, um Verbindung 3
zu ergeben, worin Rp eine Hydroxyschutzgruppe
ist. Eine bevorzugte Schutzgruppe Rp ist
Trimethylsilyl.
-
Die
6-Hydroxygruppe der Verbindung 3 wird dann alkyliert durch Reaktion
mit einem Alkylierungsmittel in Gegenwart einer Base, um die Verbindung
4 zu ergeben. Alkylierungsmittel schließen Alkylchloride, -bromide,
-iodide oder Alkylsulfonate ein. Spezifische Beispiele für Alkylierungsmittel
schließen
Folgendes ein: Allylbromid, Propargylbromid, Benzylbromid, 2-Fluorethylbromid,
4-Nitrobenzylbromid, 4-Chlorbenzylbromid, 4-Methoxybenzylbromid, α-Brom-p-tolunitril,
Cinnamylbromid, Methyl-4-bromcrotonat, Crotylbromid, 1-Brom-2-penten,
3-Brom-1-propenylphenylsulfon,
3-Brom-1-trimethylsilyl-1-propin, 3-Brom-2-octin, 1-Brom-2-butin, 2-Picolylchlorid,
3-Picolylchlorid, 4-Picolylchlorid,
4-Brommethylchinolin, Bromacetonitril, Epichlorhydrin, Bromfluormethan,
Bromnitromethan, Methylbromacetat, Methoxymethylchlorid, Bromacetamid, 2-Bromacetophenon,
1-Brom-2-butanon, Bromchlormethan, Brommethylphenylsulfon, 1,3-Dibrom-1-propen u.Ä. Beispiele
für Alkylsulfonate
sind: Allyl-O-tosylat, 3-Phenylpropyl-O-trifluormethansulfonat, n-Butyl-O-methansulfonat
u. Ä. Beispiele
für die
verwendeten Lösungsmittel
sind aprotische Lösungsmittel,
wie z. B. Dimethylsulfoxid, Diethylsulfoxid, N,N-Dimethylformamid, N,N-Dimethylacetamid,
N-Methyl-2-pyrrolidon, Hexamethylphosphortriamid, eine Mischung
davon oder eine Mischung eines dieser Lösungsmittel mit Ether, Tetrahydrofuran,
1,2-Dimethoxyethan, Acetonitril, Ethylacetat, Aceton u. Ä. Beispiele
für die
Base, die verwendet werden kann, schließen Kaliumhydroxid, Cäsiumhydroxid,
Tetraalkylammoniumhydroxid, Natriumhydrid, Kaliumhydrid, Kaliumisopropoxid,
Kalium-tertbutoxid, Kalium-isobutoxid u. Ä. ein.
-
Das
Entschützen
der 2'- und 4''-Hydroxylgruppen wird dann durchgeführt gemäß Verfahren,
die in der Literatur beschrieben sind, z. B. von T.W. Greene und
P.G.M. Wuts in Protective Groups in Organic Synthesis, 2. Ausgabe,
John Wiley & Son,
Inc., 1991. Die Bedingungen, die zum Entschützen der 2'- und 4''-Hydroxylgruppen
verwendet werden, führen
normalerweise zur Umwandlung von X in =N-OH. (Zum Beispiel führt die Verwendung
von Essigsäure
in Acetonitril und Wasser zum Entschützen der 2'- und
4''-Hydroxylgruppen
und zur Umwandlung von X von =N-O-R3 oder
=N-O-C(R8) (R9)-O-R3, worin R3, R8 und R9 wie oben
definiert sind, in =N-OH.) Wenn dies nicht der Fall ist, wird die
Umwandlung in einem separaten Schritt durchgeführt.
-
Die
Desoximierungsreaktion kann gemäß den Verfahren
durchgeführt
werden, die in der Literatur beschrieben sind, z.B. von Greene (op.
cit.) und anderen. Beispiele für
das Desoximierungsmittel sind anorganische Schwefeloxidverbindungen,
wie z. B. Natriumhydrogensulfit, Natriumpyrosulfat, Natriumthiosulfat,
Natriumsulfat, Natriumsulfat, Natriumhydrosulfit, Natriummetabisulfit,
Natriumdithionat, Kaliumthiosulfat, Kaliummetabisulfit u. Ä. Beispiele
für die
verwendeten Lösungsmittel
sind erotische Lösungsmittel,
wie z.B. Wasser, Methanol, Ethanol, Propanol, Isopropanol, Trimethylsilanol
oder eine Mischung aus einem oder mehreren der erwähnten Lösungsmittel
u. Ä. Die
Desoximierungsreaktion ist einfacher in Gegenwart einer organischen
Säure durchzuführen, wie
z. B. Ameisensäure,
Essigsäure
und Trifluoressigsäure.
Die Menge der verwendeten Säure
beträgt
von ungefähr
1 bis ungefähr
10 Äquivalente
der verwendeten Menge der Verbindung 5. In einer bevorzugten Ausführungsform
wird die Desoximierung unter Verwendung einer organischen Säure, wie
z. B. Ameisensäure,
in Ethanol und Wasser durchgeführt,
um das gewünschte
Produkt 6 zu ergeben.
-
Die
Umwandlung des 6-substituierten Erythromycinderivats in das 6-substituierte
Ketolid ist in Schema 1b beschrieben. Der Cladinoseanteil von Makrolid
6 wird entweder durch schwache wässerige
Säurehydrolyse oder
durch enzymatische Hydrolyse entfernt, um 7 zu ergeben. Repräsentative
Säuren
schließen
verdünnte Salzsäure, Schwefelsäure, Perchlorsäure, Chloressigsäure, Dichloressigsäure oder
Trifluoressigsäure
ein. Geeignete Lösungsmittel
für die
Reaktion schließen
Methanol, Ethanol, Isopropanol, Butanol u. Ä. ein. Reaktionszeiten sind
typischerweise 0,5 bis 24 Stunden. Die Reaktionstemperatur beträgt vorzugsweise
-10 bis 35°C.
Die 2'-Hydroxygruppe
von 7 wird geschützt
durch Verwendung eines geeigneten Hydroxyschutzreagens, wie z. B.
Essigsäureanhydrid,
Benzoylanhydrid, Benzylchlorformiat oder Trialkylsilylchlorid, in
einem aprotischen Lösungsmittel
wie oben definiert, vorzugsweise Dichlormethan, Chloroform, DMF,
Tetrahydrofuran (THF), N-Methylpyrrolidinon oder einer Mischung
davon. Eine besonders bevorzugte Schutzgruppe Rp ist
Benzoat. Es ist möglich,
die Reihenfolge der Schritte umzukehren, um die Cladinose zu entfernen
und die Hydroxylgruppen zu schützen,
ohne den Ertrag des Verfahrens zu beeinflussen.
-
Die
3-Hydroxylgruppe von 8 wird unter Anwendung eines modifizierten
Swern-Oxidationsverfahrens zum Keton 9 oxidiert. Geeignete Oxidationsmittel
sind N-Chlorsuccinimid-dimethylsulfid oder Carbodiimid-dimethylsulfoxid.
In einem typischen Beispiel wird 8 in einem chlorierten Lösungsmittel,
wie z. B. Methylenchlorid, bei -10°C bis 25°C zu einem als Vorprodukt gebildeten
N-Chlorsuccinimid- und Dimethylsulfid-Komplex gegeben. Nach 0,5-4-stündigem Rühren wird
ein tertiäres
Amin, wie z. B. Triethylamin oder Hunig's Base, hinzugefügt, um das entsprechende Keton
zu erzeugen. Die 2'-Hydroxyschutzgruppe
von 9 wird dann durch Standardverfahren entfernt, um das gewünschte Ketolid
VIII zu ergeben. Wenn Rp ein Ester wie z.
B. Acetat oder Benzoat ist, kann die Verbindung durch Behandlung
mit Methanol oder Ethanol entschützt
werden. Wenn Rp eine Trialkylsilylgruppe
ist, kann die Verbindung durch Behandlung mit Fluorid in THF oder
Acetonitril entschützt
werden.
-
Das
Oximderivat kann dann hergestellt werden durch Reaktion der Verbindung
VIII, worin X O ist, mit Hydroxylammoniumchlorid in Gegenwart einer
Base oder Hydroxylamin in Gegenwart einer Säure, wie im US-Patent Nr. 5,274,085
beschrieben, um die Verbindungen zu bilden, worin R1 H
ist. Reaktion mit dem substituierten Hydroxylamin R1ONH2 führt
zur Bildung von Verbindungen, in denen R1 nicht
H ist. Alternativ können Verbindungen,
worin R1 nicht H ist, hergestellt werden
durch anfängliche
Bildung des unsubstituierten Oxims wie oben beschrieben, gefolgt
von Reaktion mit R1X', worin X' eine geeignete Abgangsgruppe, wie z.
B. Halogen, ist.
-
Die
Herstellung der Verbindungen dieser Erfindung mit der Formel (IX),
worin L CO ist und T -NH- oder -N(W-Rd)-
ist, ist in den Schemata 1c und 4 beschrieben. Gemäß Schema
1c wird die 6-O-substituierte
Verbindung 6 zunächst
mit einer geeigneten Hydroxyschutzgruppe geschützt, um durch die oben erwähnten Verfahren
Verbindung 6A zu ergeben. Verbindung 6A wird dann mit Natriumhexamethyldisilazid
und Carbonyldiimidazol behandelt, um Verbindung 6B zu ergeben. Insbesondere
führt die
Behandlung von Verbindung 6B mit wässerigem Ammoniak zur Bildung
des zyklischen Carbamats 6C, worin Re H
ist. Ebenso führt
die Reaktion von Verbindung 6B mit einer Aminoverbindung mit der
Formel H2N-W-Rd zur
Bildung des zyklischen Carbamats, in dem Re -W-Rd ist.
-
Alternative
oder zusätzliche
Verfahren können
angewandt werden, um Verbindungen mit der Formel (IX) herzustellen,
worin L CO ist und T -N(W-Rd)- ist. Zum
Beispiel ergibt die Behandlung einer Verbindung 6C, worin Re H ist, mit einem Alkylierungsmittel, das
die Formel Rd-Halogen hat, worin Rd wie zuvor definiert ist, eine Verbindung
6C, worin Re W-Rd ist,
W abwesend ist und Rd wie zuvor definiert
ist.
-
Reaktion
der Verbindung 6B mit einer Hydrazinverbindung mit der Formel H2N-NH-Rd führt zur
Bildung des zyklischen Carbamats und ergibt eine Verbindung 6C,
worin Re W-Rd ist,
W -NH- ist und Rd wie oben definiert ist.
Wenn unsubstituiertes Hydrazin das Reagens ist, ist das Endprodukt
eine Verbindung 6C, worin Re -N(W-Rd)- ist, worin (W-Rd)
(NH2) ist.
-
Die
Behandlung einer Verbindung 6C, worin Re -N(W-Rd)- ist, worin (W-Rd)
(NH2) ist, mit einem Alkylierungsmittel,
das die Formel Rd-Halogen hat, worin Rd wie zuvor definiert ist, ergibt eine Verbindung
6C, worin Re W-Rd ist,
W -NH- ist und Rd wie zuvor definiert ist.
-
Die
Behandlung von Verbindung 6C mit einem Acylierungsmittel, das gewählt ist
aus der Gruppe bestehend aus Rd-C(CO)-Halogen
oder (Rd-C(CO)-O)2,
ergibt eine Verbindung 6C, worin Re ist
W ist -NH-CO- und Rd wie zuvor definiert
ist.
-
Die
Behandlung einer Verbindung 6C, worin Re -N(W-Rd)- ist, worin (W-Rd)
(NH2) ist, mit einem Aldehyd Rd-CHO,
worin Rd wie zuvor definiert ist, ergibt
eine Verbindung 6C, worin W -N=CH- ist und Rd wie
zuvor definiert ist.
-
Die
Behandlung einer Verbindung mit der Formel (IX), worin L CO ist
und T -N(W-Rd)- ist, worin (W-Rd) (NH2) ist, mit einem Alkylierungsmittel, das
die Formel Rd-Halogen hat, worin Rd wie zuvor definiert ist, ergibt die Verbindung
Formel (IX), worin L CO ist, T -N(W-Rd)-
ist, W abwesend ist und Rd wie definiert
ist.
-
Die
Reaktion der Verbindung 6B mit einer Hydroxylaminverbindung mit
der Formel H2N-O-Rd führt zur Bildung
des zyklischen Carbamats, in dem Re -O-Rd ist.
-
Das
Entfernen des Cladinoseanteils durch Säurehydrolyse wie zuvor beschrieben
ergibt die Verbindung 6D, worin Z' H ist. Die Verbindung 6D wird dann
durch das modifizierte Swern-Oxidationsverfahren,
das für
das Schema 1b oben zur Umwandlung der Verbindung 8 in das Keton
9 beschrieben ist, zu 6E oxidiert.
-
Das
Entschützen
der 2'-Hydroxylgruppe,
wie oben beschrieben, ergibt das gewünschte Ketolid IX.
-
Gemäß dem alternativen
Verfahren, das in Schema 1d dargestellt ist, wird die Verbindung
2A, welche die 9-Oximverbindung
von Erythromycin A ist, Säurehydrolyse
mit verdünnter
mineralischer oder organischer Säure
ausgesetzt wie oben beschrieben, um den Cladinoseanteil zu entfernen
und Verbindung 7A zu ergeben. Die Oximverbindung 7A wird dann in
die geschützte
Oximverbindung 7B umgewandelt, worin V =N-O-R
1 (dargestellt)
oder =N-O-C(R
5) (R
6)-O-R
1 ist, worin R
1,
R
5 und R
6 wie zuvor
definiert sind, durch Reaktion mit dem entsprechend substituierten
Oximschutzreagens. Die 3- und 2'-Hydroxylgruppen
von 7B werden dann geschützt
wie zuvor beschrieben, vorzugsweise mit einer Trimethylsilylschutzgruppe,
um Verbindung 7C zu ergeben. Verbindung 7C wird dann alkyliert wie
zuvor für
Schema 1a beschrieben, um Verbindung 7D zu ergeben, und Verbindung
7D wird zunächst
deoximiert, wie oben für
Schema 1a beschrieben; dann wird das deoximierte Produkt durch die
Verfahren, die für
die Herstellung der Verbindung 6C aus Verbindung 6A in Schema 1c
beschrieben sind, in die Verbindung 7E umgewandelt. Die Verbindung
7E wird dann entschützt
und zur 3-Ketolidderivatverbindung
mit der Formel IX oxidiert, worin X O ist, L CO ist und T -NH- oder
-N(W-R
d)- ist, und zwar durch Verfahren,
die zuvor beschrieben wurden. Schema
1a
Schema
1b
Schema
1c
Schema
1d
-
Die
Herstellung der Verbindungen dieser Erfindung mit der Formel (IX),
worin L CO ist und T Oist, und der Verbindungen mit der Formel VI,
ist in Schema 2 beschrieben. In Schema 2 folgt die Herstellung dem
Verfahren, das von Baker u. a., J. Org. Chem., 1988, 53, 2340, beschrieben
wurde. Im Speziellen wird das 2'-geschützte Ketolidderivat
9, hergestellt wie in Schema 1 oben beschrieben, durch Reaktion
mit Carbonyldiimidazol und Natriumhexamethyldisilazid in das zyklische
Carbonat 10 umgewandelt. Das Entschützen wie oben beschrieben ergibt
die Verbindung IX, worin L CO und T O ist.
-
Verbindungen
mit der Formel VI werden aus 9 durch Reaktion mit Natriumhydrid
oder Lithiumhydrid und Phosgen, Diphosgen oder Triphosgen unter
wasserfreien Bedingungen hergestellt, gefolgt von wässeriger Aufarbeitung
(wässeriger
basekatalysierter Decarboxylierung). Alternativ wird 9 durch Reaktion
mit Methansulfonanhydrid in Pyridin in sein entsprechendes Mesylat
umgewandelt. Das Mesylat wird dann durch Behandlung mit einer Aminbase,
wie z. B. DBU oder Dimethylaminopyridin in Aceton oder Acetonitril,
in 11 umgewandelt. Die 2'-Schutzgruppe
wird dann entfernt wie oben beschrieben, um die Verbindung VI zu
ergeben.
-
Verbindungen
mit der Formel VI werden auch aus 10 hergestellt, durch Behandlung
mit einer Aminbase, wie z. B. 1,8-Diazobicyclo[5.5.0]undec-7-en (DBU)
oder 4-Dimethylaminopyridin (DMAP) in einem Lösungsmittel wie z. B. Benzen
oder Acetonitril, oder durch Reaktion mit Natrium- oder Lithiumhydrid
in Tetrahydrofuran oder N,N-Dimethylformamid (DMF), um 11 zu ergeben,
welches dann entschützt
wird wie oben beschrieben, um die gewünschte Verbindung zu ergeben.
-
Verbindungen
mit der Formel VII werden hergestellt wie in den Schemata 3a und
3b beschrieben. Gemäß Schema
3a wird das Ketolid 11, hergestellt wie in Schema 2, durch Reaktion
mit Carbonyldiimidazol und einer Alkalimetallhydridbase, wie z.
B. Natriumhydrid, Lithiumhydrid oder Kaliumhydrid, in einem geeigneten aprotischen
Lösungsmittel
bei von ungefähr
0°C bis
Raumtemperatur in 12 umgewandelt. Verbindung 12 kann auch hergestellt
werden durch Reaktion von Diol 9 oder zyklischem Carbonat 10, hergestellt
wie in Schema 2 oben beschrieben, durch Reaktion mit Carbonyldiimidazol
und Natrium- oder Lithiumhydrid unter ähnlichen Bedingungen. Verbindung
12 wird dann mit Diamin 13 zur Reaktion gebracht, das die Substituenten
A, B, D und E wie oben definiert hat, in einem geeigneten Lösungsmittel,
wie z. B. wässerigem
Acetonitril, DMF oder wässerigem
DMF, um die bizyklische Verbindung 14 zu ergeben. Die Verbindung
14 wird dann zyklisiert durch Behandlung mit verdünnter Säure, wie
z. B. Essigsäure
oder HCl, in einem geeigneten organischen Lösungsmittel, wie z. B. Ethanol
oder Propanol, und entschützt
wie oben beschrieben, um das trizyklische Ketolid VII zu ergeben.
Alternativ kann die 2'-Schutzgruppe
des bizyklischen Ketolids 14 vor der Zyklisierung entfernt werden,
unter Anwendung der Verfahren, die in Schema 1 beschrieben sind.
Verbindungen mit der Formel IV oder VII können zu Verbindungen mit der
Formel IV-A reduziert werden, durch Behandeln mit einem Reduktionsmittel,
das gewählt
ist aus Wasserstoff in Gegenwart von Palladiumkatalysator, Alkylborhydrid
und Lithiumaluminiumhydrid in einem geeigneten organischen Lösungsmittel.
-
Das
Schema 3b veranschaulicht eine alternative Herstellung von Verbindungen
mit der Formel VII. Das Ausgangsmaterial 12 wird mit einem Beta-Aminoalkohol
15 (Y=OH) in einem geeigneten Lösungsmittelsystem,
wie z. B. wässerigem
Acetonitril, DMF oder wässerigem
DMF, bei 0-70°C
zur Reaktion gebracht, um 16 zu ergeben, das mit einer Mitsunobu-Reaktion
unter Verwendung von Triphenylphosphin und Diphenylphosphorylazid
und DEAD in Tetrahydrofuran in das Azid umgewandelt wird. Alternativ
kann die Hydroxylgruppe in 16 durch Behandlung mit Sulfonylchlorid,
Alkyl- oder Arylsulfonanhydrid oder Trifluormethansulfonanhydrid
in einem aprotischen Lösungsmittel
aktiviert werden. Die aktivierte Hydroxylgruppe wird dann durch
Reaktion mit Lithiumazid oder Natriumazid in einem aprotischen Lösungsmittel
in das entsprechende Azid umgewandelt. Die 2'-Schutzgruppe wird dann entfernt wie
oben beschrieben, und das Azid wird zum Amin 17 reduziert. Geeignete
Reduktionsmittel sind Triphenylphosphin-Wasser, Wasserstoff mit einem
Katalysator, Natriumborhydrid oder Dialkylaluminiumhydrid im passenden
Lösungsmittel
für diese
Reaktionen, wie im Fachgebiet gut bekannt ist. Die Verbindung 17
wird dann zyklisiert wie in Schema 3a oben beschrieben.
-
Verbindungen
mit der Formel IX, worin L CO und T NH oder N-W-Rd ist,
werden hergestellt wie in Schema 4 gezeigt. Die Herstellung folgt
dem Verfahren, das von Baker u. a., J. Org. Chem., 1988, 53, 2340, beschrieben
wurde. Im Speziellen führt
die Behandlung von Verbindung 12, hergestellt mit wässerigem
Ammoniak wie in Schema 3 oben beschrieben, zur Bildung des zyklischen
Carbamats 18, worin Re H ist. Ebenso führt die
Reaktion von Verbindung 12 mit einer Aminoverbindung mit der Formel
H2N-W-Rd zur Bildung
des zyklischen Carbamats, in dem Re -W-Rd ist.
-
Das
Entschützen
der 2'-Hydroxylgruppe
wie oben beschrieben liefert das gewünschte Ketolid IX. Im Speziellen
führt die
Behandlung der Verbindung 6B mit wässerigem Ammoniak zur Bildung
des zyklischen Carbamats 6C, worin R
e H
ist. Ebenso führt
die Reaktion von Verbindung 6B mit einer Aminoverbindung mit der Formel
H
2N-W-R
d zur Bildung
des zyklischen Carbamats, in dem R
e -W-R
d ist. Schema
2
Schema
3a
Schema
3b
Schema
4
-
Die
gewünschte
6-O-substituierte Verbindung kann direkt wie oben beschrieben hergestellt
oder aus chemischer Modifikation einer zunächst hergestellten 6-O-substituierten Verbindung
gewonnen werden. Repräsentative
Beispiele für
weitere Bearbeitung der 6-Position sind in Schema 5 dargestellt.
Zum Beispiel kann die Verbindung 20, worin R 6-O-CH2CH=CH2 ist und M' das Makrolidringsystem darstellt, weiter
derivatisiert werden. Die Doppelbindung der Allylverbindung kann
(a) katalytisch reduziert werden, um die 6-O-Propylverbindung 27
zu ergeben; (b) mit Osmiumtetroxid behandelt werden, um die 2,3-Dihydroxypropylverbindung
31 zu ergeben, die wiederum funktionalisiert werden kann, z. B.
durch Veresterung mit einem Acylierungsmittel, wie z. B. einem Acylhalogenid
oder Acylanhydrid, an jedem Sauerstoffatom, um 32 zu ergeben; (c)
mit m-Chlorperoxybenzoesäure
in einem aprotischen Lösungsmittel
oxidiert werden, um die Epoxidmethylverbindung 29 zu ergeben, die
mit nucleophilen Verbindungen, z. B. Aminen oder N-enthaltenden Heteroarylverbindungen,
geöffnet
werden kann, um Verbindungen mit N enthaltenden Seitenketten 30
zu ergeben; (d) unter Wacker-Bedingungen, wie von Henry in „Palladium
Catalyzed Oxidation of Hydrocarbons", Reidel Publishing Co., Dordrecht,
Holland (1980) beschrieben, oxidiert werden, um die 6-O-CH2-C(O)-CH3-Verbindung 28 zu ergeben; und (e) ozonisiert
werden, um das Aldehyd 21 zu ergeben, das wiederum (1) durch Reaktion
mit H2NOR3 bzw.
H2NOH in die Oxime 22 und 24 umgewandelt
oder (2) reduktiv aminiert werden kann, z. B. mit einem geeigneten
Amin in Gegenwart eines Boronat-Reduktionsmittels oder durch Bildung
des Imins und anschließende
katalytische Reduktion, um das Amin 23 zu ergeben. Reaktion des
Oxims 24 mit Diisopropylcarbodiimid in einem aprotischen Lösungsmittel
in Gegenwart von CuCl ergibt das Nitril 25. Die Reaktion von 20 mit
einem Arylhalogenid unter Heck-Bedingungen (Pd(II) oder Pd(O), Phosphin
und Amin oder anorganischer Base, siehe Organic Reactions, 1982,
27, 345-390) ergibt 26. Die Reduktion der Doppelbindung in 26, z.
B. unter Verwendung von H2 und Palladium
auf Kohlenstoff, ergibt 33.
-
Schema
6 beschreibt alternative Verfahren zur Herstellung von Verbindungen
mit der Formel XI, worin L CO ist, T -NH- oder -N(W-Rd)-
ist und R substituiertes Alkenyl ist. Die 6-O-Allylerythromycinverbindung 33 wird
in die Verbindung mit der Formel XI umgewandelt, worin L CO ist,
T -NH- oder -N(W-Rd)- ist und R Allyl ist,
durch Entfernen der Cladinose und Oxidation der 3-Hydroxylgruppe,
wie in früheren
Schemata beschrieben. Die anschließende Reaktion der Verbindung
mit der Formel XI, worin L CO ist, T -NH- oder -N(W-Rd)-
ist und R Allyl ist, mit einer Verbindung, die die Formel R**-Halogen
hat, worin R** Aryl, substituiertes Aryl, Heteroaryl oder substituiertes
Heteroaryl ist, unter Heck-Bedingungen mit Pd(II) oder Pd(O), Phosphin
und Amin oder anorganischer Base (siehe Organic Reactions, 1982,
27, 345-390) ergibt das gewünschte
Produkt mit der Formel XI, worin L CO, T N(Rd)
und R substituiertes Alkenyl ist.
-
Alternativ
wird die Verbindung 33 in die 6-O-(substituiertes Alkenyl)-Verbindung
mit der Formel 34 umgewandelt durch Reaktion mit einem Arylhalogenid,
einem substituierten Arylhalogenid, einem Heteroarylhalogenid oder
substituierten Heteroarylhalogenid unter Heck-Bedingungen mit Pd
(II) oder Pd(O), Phosphin und Amin oder anorganischer Base, wie
soeben beschrieben. Die Verbindung 34 kann dann in das gewünschte Produkt
mit der Formel XI umgewandelt werden, worin L CO, T -NH- oder -N(W-R
d)- und R substituiertes Alkenyl ist, durch
Entfernen der Cladinose und Oxidation der 3-Hydroxylgruppe wie in
früheren
Schemata beschrieben. Schema
5
Schema
6
-
Repräsentative
Beispiele für
wiederum eine weitere Ausarbeitung der 6-Position sind in Schema
7 dargestellt. Die gewünschte
6-O-substituierte Verbindung kann durch chemische Modifikation einer
zunächst
hergestellten 6-O-Propargylverbindung
hergestellt werden. Zum Beispiel kann Verbindung 35, worin R 6-O-CH2-C≡CH
ist und M' das Makrolidringsystem
darstellt, weiter derivatisiert werden. Die Dreifachbindung der
Alkinverbindung 35 kann behandelt werden mit einem Arylhalogenid,
einem substituierten Arylhalogenid, einem Heteroarylhalogenid oder
substituierten Heteroarylhalogenid in Gegenwart von Pd(triphenylphosphin)2Cl2und CuI in Gegenwart
eines organischen Amins, wie z. B. Triethylamin, um die Verbindung
36 zu ergeben. Verbindung 35 kann auch mit einem Boronsäurederivat
HB(OR22) behandelt werden, worin R22 H oder C1-C10-Alkyl ist, in einem aprotischen Lösungsmittel
bei 0°C
bis Raumtemperatur, um die Verbindungen 37 zu ergeben, die dann
behandelt werden mit Pd (triphenylphosphin)4 und
einem Arylhalogenid, einem substituierten Arylhalogenid, einem Heteroarylhalogenid
oder substituierten Heteroarylhalogenid unter Suzuki-Reaktionsbedingungen,
um die Verbindungen 38 zu ergeben. Verbindung 35 kann auch mit N-Halosuccinimid
in Essigsäure
behandelt werden, um die Verbindungen 39 zu ergeben. Außerdem kann
Verbindung 35 mit einem substituierten Alkenylhalogenid, wie z.
B. Ar-CH=CH-Halogen, behandelt werden, worin Ar Aryl, substituiertes Aryl,
Heteroaryl oder substituiertes Heteroaryl ist, in Gegenwart von
Pd(triphenylphosphin)2Cl2 und
CuI in Gegenwart eines organischen Amins, wie z. B. Triethylamin,
um die entsprechend substituierten Verbindungen 41 zu ergeben. Weiterhin
kann Verbindung 36 selektiv zu der entsprechenden cis-Olefinverbindung
40 reduziert werden, und zwar durch katalytische Hydrierung in Ethanol
bei atmosphärischem
Druck in Gegenwart von 5% Pd/BaSO4 und Chinolin
(Rao u. a., J. Org. Chem., (1986), 51: 4158-4159).
-
Schema
8 beschreibt alternative Verfahren zur Herstellung von Verbindungen
mit der Formel XI, worin L CO ist, T -NH- oder -N(W-Rd)-
ist und R substituiertes Alkinyl ist. Die 6-O-Propargylerythromycinverbindung 42 kann
in die Verbindung mit der Formel XI umgewandelt werden, worin L
CO ist, T N(Rd) ist und R Propargyl ist,
durch Entfernen der Cladinose und Oxidierung der 3-Hydroxylgruppe,
wie in früheren
Schemata beschrieben. Die anschließende Reaktion der Verbindung
mit der Formel XI, worin L CO ist, T N(Rd)
ist und R Propargyl ist, mit einer Verbindung, die die Formel R**-Halogen
hat, worin R** Aryl, substituiertes Aryl, Heteroaryl oder substituiertes
Heteroaryl ist, in Gegenwart von Pd(triphenylphosphin)2Cl2 und CuI in Gegenwart eines organischen
Amins, wie z. B. Triethylamin, ergibt das gewünschte Produkt mit der Formel
XI, worin L CO ist, T -NH- oder -N(W-Rd)-
ist und R substituiertes Alkinyl ist.
-
Verbindung
42 wird umgewandelt in die 6-O-(substituiertes Alkinyl)-Verbindung
mit der Formel 43, durch Reaktion mit einer Verbindung, die die
Formel R**-Halogen hat, worin R** Aryl, substituiertes Aryl, Heteroaryl
oder substituiertes Heteroaryl ist, in Gegenwart von Pd(triphenylphosphin)
2Cl
2 und CuI in Gegenwart eines
organischen Amins, wie z. B. Triethylamin, wie soeben beschrieben.
Verbindung 43 wird dann in das gewünschte Produkt mit der Formel
XI umgewandelt, worin L CO ist, T -NH- oder -N(W-R
d)-
ist und R substituiertes Alkinyl ist, und zwar durch Entfernen der
Cladinose und Oxidation der 3-Hydroxygruppe wie in früheren Schemata
beschrieben. Schema
7
Schema
8
-
Das
oben Stehende wird besser verständlich
durch Bezugnahme auf die folgenden Beispiele, die zur Veranschaulichung
geliefert werden und nicht dazu dienen, den Schutzumfang des erfinderischen
Konzepts einzuschränken.
-
Beispiel 1
-
Verbindung mit der Formel
(VIII): X ist O, R ist Allyl
-
Schritt 1a: Verbindung
4 aus Schema 1a; V ist N-O-(1-Isopropoxycyclohexyl),
R ist Allyl, Rp ist Trimethylsilyl.
-
Zu
einer 0°C-Lösung aus
2',4''-bis-O-Trimethylsilylerythromycin A 9-[O-(1-Isopropoxycyclohexyl)oxim (1,032
g, 1,00 mmol), hergestellt nach dem Verfahren von U.S. Pat. Nr.
4,990,602 in 5 ml DMSO und 5 ml THF, wurde frisch destilliertes
Allylbromid (0,73 ml, 2,00 mmol) gegeben. Nach ungefähr 5 Minuten
wurde eine Lösung
aus Kalium-tert-butoxid (1M 2,0 ml, 2,0 ml) in 5 ml DMSO und 5 ml
THF tropfenweise über
einen Zeitraum von 4 Stunden hinzugegeben. Die Reaktionsmischung
wurde in Ethylacetat aufgenommen und mit Wasser und Salzlösung gewaschen.
Die organische Phase wurde in vacuo konzentriert, um die gewünschte Verbindung
(1,062 g) als weißen
Schaum zu ergeben.
-
Schritt 1b: Verbindung
5 aus Schema 1a; V ist NOH, R ist Allyl.
-
Zu
einer Lösung
der Verbindung, die aus Schritt 1a resultiert (1,7 g), in 17 ml
Acetonitril und 8,5 ml Wasser wurden bei Raumtemperatur 9 ml Essigsäure hinzugegeben.
Nach mehreren Stunden bei Raumtemperatur wurde die Reaktionsmischung
mit 200 ml Toluen verdünnt
und in vacuo konzentriert. Es wurde festgestellt, dass der gewonnene
Rückstand
nicht umgesetztes Ausgangsmaterial enthielt, daher wurden zusätzliches
Acetonitril (15 ml), Wasser (70 ml) und HOAc (2 ml) hinzugefügt. Nach
2 Stunden wurde eine zusätzliche 1
ml-Aliquote von HOAc hinzugefügt.
Nach ungefähr
drei weiteren Stunden wurde die Reaktionsmischung über Nacht
in den Gefrierapparat gestellt. Die Reaktionsmischung wurde auf
Raumtemperatur erwärmen
gelassen, mit 200 ml Toluen verdünnt
und in vacuo konzentriert. Der Rückstand
wurde zweimal mit Toluen ausgetrieben und auf konstantes Gewicht
(1,524 g) getrocknet.
-
Schritt 1c: Verbindung
6 aus Schema 1a; R ist Allyl.
-
Die
Verbindung, die aus Schritt 1b resultiert (1,225 g), in 16 ml 1:1
Ethanol-Wasser wurde mit NaHSO3 (700 mg)
und Ameisensäure
(141 μl)
behandelt und bei 86°C
2,5 Stunden lang erwärmt.
Die Reaktionsmischung wurde auf Raumtemperatur abkühlen gelassen,
mit 5-6 ml Wasser verdünnt,
mit 1 N NaOH auf pH 9-10 alkalisiert und mit Ethylacetat extrahiert.
Die kombinierten organischen Extrakte wurden mit Salzlösung gewaschen
(2x), über
MgSO4 getrocknet, filtriert und in vacuo
konzentriert. Das rohe Material wurde durch Säulenchromatographie gereinigt,
unter Elution mit 1% MeOH in Methylenchlorid, das 1% Ammoniumhydroxid
enthielt, um 686 mg (57%) der Titelverbindung zu ergeben.
13C NMR (CDCl3) δ 219.3 (C-9),
174.8 (C-1), 135.5 (C-17),
116.3 (C-18), 101.9 (C-1'),
95.9 (C-1''), 79.7 (C-5), 78.8
(C-6), 78.5 (C-3), 74.1 (C-12), 72.4 (C-3''),
70.6 (C-11), 68.1 (C-5'),
65.5 (C-16), 65.1 (C2'),
49.0 (C-3'' O-CH3),
45.0 (C-2), 44.1 (C-8), 39.7 (NMe2), 37.9
(C-4), 37.1 (C-10), 34.6 (C-2''), 28.4 (C-4'), 21.0, 20.6 (C-3'' CH3, C-6' CH3),
20.8 (C-14), 18.3 (C-6''), 18.1 (C-8 CH3). 15.7, 15.6 (C-2 CH3,
C-6 CH3), 11.9 (C-10 CH3),
10.1 (C-15), 8.9 (C-4 CH3). MS (FAB)+ m/e
774 (M+H)+, 812 (M+K)+.
-
Schritt 1d: Verbindung
7 aus Schema 1b; R ist Allyl.
-
Zu
einer Suspension der in Schritt 1c hergestellten Verbindung (7,73
g, 10,0 mmol) in Ethanol (25 ml) und Wasser (75ml) wurde über einen
Zeitraum von 10 Minuten wässeriges
1 M HCl (18 ml) gegeben. Die Reaktionsmischung wurde 9 Stunden lang
bei Raumtemperatur gerührt
und dann über
Nacht im Kühlschrank
stehen gelassen. Wässerige
2 M NaOH (9 ml, 18 mmol) führte
zur Bildung eines weißen
Niederschlags. Die Mischung wurde mit Wasser verdünnt und
filtriert. Der Feststoff wurde mit Wasser gewaschen und unter Vakuum getrocknet,
um die Des-Cladinosylverbindung
7 (3,11 g) zu ergeben.
-
Schritt 1e: Verbindung
8 aus Schema 1b; R ist Allyl, Rp ist Benzoyl.
-
Zu
einer Lösung
des Produkts aus Schritt 1d (2,49 g, 4,05mmol) in Dichlormethan
(20 ml) wurden Benzoesäureanhydrid
(98%, 1, 46 g, 6, 48 mmol) und Triethylamin (0,90 ml, 6, 48 mmol)
gegeben, und die weiße Suspension
wurde 26 Stunden lang bei Raumtemperatur gerührt. Wässeriges 5%iges Natriumcarbonat
wurde hinzugegeben, und die Mischung wurde 20 Minuten lang gerührt. Die
Mischung wurde mit Dichlormethan extrahiert. Die organische Phase
wurde mit wässerigem
5%igem Natriumbicarbonat und Salzlösung gewaschen, über Natriumsulfat
getrocknet und in vacuo konzentriert, um einen weißen Schaum
zu ergeben. Chromatographie auf Silikagel (30% Aceton-Hexane) ergab
die Titelverbindung (2,46 g) als einen weißen Feststoff.
-
Schritt 1f: Verbindung
9 aus Schema 1b; R ist Allyl, Rp ist Benzoyl;
identisch mit Verbindung mit der Formel (II), Ra ist
OH, Rc ist Benzoyl.
-
Zu
einer -10°C-Lösung unter
N2 von N-Chlorsuccinimid (0,68 g, 5,07 mmol)
in Dichlormethan (20 ml) wurde über
einen Zeitraum von 5 Minuten Dimethylsulfid (0,43 ml, 5,92 mmol)
hinzugefügt.
Die resultierende weiße
Aufschlämmung
wurde 20 Minuten lang bei -10°C
gerührt,
und dann wurde eine Lösung
der Verbindung, die aus Schritt 1e resultierte (2,43 g, 3,38 mmol)
in Dichlormethan (20 ml) hinzugefügt, und die Reaktionsmischung
wurde 30 Minuten lang bei -10 bis -5°C gerührt. Triethylamin (0,47 ml,
3, 38 mmol) wurde tropfenweise über
einen Zeitraum von 5 Minuten hinzugefügt, und die Reaktionsmischung
wurde 30 Minuten lang bei 0°C gerührt. Die
Reaktionsmischung wurde mit Dichlormethan extrahiert. Die organische
Phase wurde zweimal mit wässerigem
5%igem Natriumbicarbonat und einmal mit Salzlösung gewaschen, über Natriumsulfat
getrocknet und in vacuo konzentriert, um einen weißen Schaum
zu ergeben. Chromatographie auf Silikagel (30% Aceton-Hexane) ergab
die Titelverbindung (2,27 g) als einen weißen Schaum.
-
Schritt 1a: Verbindung
mit der Formel (VIII): X ist O, R ist Allyl.
-
Eine
Lösung
aus der Verbindung, die aus Schritt 1f resultierte (719 mg, 1,0
mmol), in Methanol (20 ml) wurde unter Rückfluss 6 Stunden lang gerührt. Die
Reaktionsmischung wurde in vacuo konzentriert, und der Rückstand
wurde durch Chromatographie auf Silikagel gereinigt (95:5:0,5 Dichlormethan-Methanol-Ammoniak),
um die gewünschte
Verbindung (577 mg) als weißen
Schaum zu ergeben.
13C NMR (CDCl3) δ 219.2
(C-9), 206.0 (C-3), 169.8 (C-1), 135.3, 117.5, 102.8, 78.4, 78.0,
75.9, 74.4, 70.3, 69.5, 69.0, 65.9, 64.6, 50.6, 45.4, 45.1, 40.2,
38.6, 37.8, 31.6, 28.4, 21.8, 21.3, 20.3, 18.1, 16.5, 14.7, 12.8,
12.3, 10.6. MS (FAB)+ m/e 614 (M+H)+.
-
Beispiel 2
-
Verbindung mit der Formel
(VIII): X ist NOH, R ist Allyl.
-
Zu
einer Lösung
der Verbindung, die aus Beispiel 1 resultierte (122 mg, 0,2 mmol),
in Ethanol wurden Hydroxylammoniumchlorid (76 mg, 1,1 mmol) und
Triethylamin (56μl,
0,4 mmol) hinzugegeben, und die Reaktionsmischung wurde über Nacht
bei 80°C
gerührt.
Die Reaktionsmischung wurde konzentriert, und der Rückstand
wurde in Ethylacetat aufgenommen. Die organische Phase wurde mit
wässerigem
5%igem Natriumbicarbonat und Salzlösung gewaschen, über Natriumsulfat
getrocknet und in vacuo konzentriert. Chromatographie auf Silikagel
(95:5:0,5 Dichlormethan-Methanol-Ammoniak) ergab das E-Oxim (42
mg) und das Z-Oxim (38 mg) als weiße Schäume.
13C
NMR (CDCl3) δ 206.3 (C-3), 170.1 (C-9), 169.8
(C-1), 136.1, 116.5, 102.7, 78.6, 78.2, 75.5, 74.1, 70.3, 70.2, 69.4.
65.9, 64.7. 50.6, 45.2, 40.2, 37.3, 33.1, 28.4, 25.4, 21.9, 21.3,
20.3, 18.6, 16.5, 14.9. 14.7, 12.8, 10.7. MS (FAB)+ m/e 629 (M+H)+.
-
Beispiel 3
-
Verbindung mit der Formel
(VIII): X ist O, R ist Propyl.
-
Eine
Lösung
der Verbindung, die aus Beispiel 1 resultierte (122 mg, 0,2 mmol),
in Ethanol wurde mit Stickstoff gespült, und 10% Palladium auf Kohlenstoff
(20 mg) wurde hinzugefügt.
Die Mischung wurde dann mit Wasserstoff gespült, und die Reaktionsmischung
wurde über
Nacht unter positivem Wasserstoffdruck gerührt. Die Reaktionsmischung
wurde filtriert und in vacuo konzentriert, um ein Glas zu ergeben.
Chromatographie auf Silikagel (95:5:0,5 Dichlormethan-Methanol-Ammoniak) ergab die
Titelverbindung als einen weißen Feststoff.
13C NMR (CDCl3) δ 220.2 (C-9),
206.5 (C-3), 169.9 (C-1), 102.7, 78.1, 77.7, 75.7, 74.1, 70.3, 69.4,
65.9, 64.5, 50.6, 45.4, 44.7, 40.2. 38.8, 37.5, 28.4, 22.3, 21.9,
21.3, 20.3, 183, 16.5, 14.9, 14.7, 12.4, 10.6, 10.2. MS (FAB)+ m/e
616 (M+H)+.
-
Beispiel 4
-
Verbindung mit der Formel
(VIII): X ist O, R ist -CH2CHO.
-
Schritt 4a: Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CHO-N-Oxid.
-
Ozon
wurde 45 Minuten lang durch eine -78°C-Lösung in Dichlormethan (100
ml) der Verbindung, die aus Beispiel 1 resultierte (2,45 g, 4,0
mmol) hindurchgeführt.
Die Reaktionsmischung wurde dann 10 Minuten lang mit Stickstoff
gespült.
Dimethylsulfid (1,46 ml, 20 mmol) wurde bei -78°C hinzugefügt, und die Reaktionsmischung
wurde 30 Minuten lang bei 0°C
gerührt.
Die Reaktionsmischung wurde in vacuo konzentriert, um einen weißen Schaum
(2,78 g) zu ergeben, der ohne weitere Reinigung verwendet wurde.
-
Schritt 4b: Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CHO.
-
Die
gewünschte
Verbindung wurde hergestellt durch Erhitzen einer Lösung in
THF (40 ml) der Verbindung, die aus Schritt 4a resultierte (2,78
g, 4,0 mmol), und Triphenylphosphin (2,62 g, 10,0 mmol) bei 55°C für 2,5 Stunden.
Die Reaktionsmischung wurde in vacuo konzentriert, um einen weißen Schaum
zu ergeben. Chromatographie auf Silikagel (1:1 Aceton-Hexan, dann 75:25:0,5
Aceton-Hexan-Triethylamin) ergab die gewünschte Verbindung (1,29 g)
als einen weißen
Feststoff. MS (FAB)+ m/e 616 (M+H)+.
-
Beispiel 5
-
Verbindung mit der Formel
(VIII): X ist O, R ist -CH2CH=NOH.
-
Zu
einer Lösung
in Methanol (5 ml) der in Beispiel 4 hergestellten Verbindung (46
mg, 0,08 mmol) wurden Triethylamin (31 μl, 0,225 mmol) und Hydroxylammoniumchlorid
(7,7 mg, 0,112 mmol) gegeben, und die Reaktionsmischung wurde 6
Stunden lang bei Raumtemperatur gerührt. Die Reaktionsmischung
wurde in Ethylacetat aufgenommen und mit wässerigem 5%igem Natriumbicarbonat
und Salzlösung
gewaschen, über Natriumsulfat
getrocknet und in vacuo konzentriert, um ein klares Glas zu ergeben.
Chromatographie auf Silikagel (95:5:0,5 Dichlormethan-Methanol-Ammoniak)
ergab die Titelverbindung (29 mg) als einen weißen Feststoff. MS (FAB)+ m/e 631 (M+H)+.
-
Beispiel 6
-
Verbindung mit der Formel
(VIII): X ist NOH, R ist -CH2CH=NOH.
-
Die
Titelverbindung (7,0 mg) wurde aus der Chromatographie gewonnen,
die in Beispiel 5 beschrieben ist. MS (FAB)+ m/e
631 (M+H)+. MS (FAB)+ m/e
645 (M+H)+.
-
Beispiel 7
-
Verbindung mit der Formel
(VIII): X ist O, R ist -CH2CN.
-
Zu
einer Lösung
unter Stickstoff der Verbindung, die in Beispiel 5 hergestellt wurde
(168 mg, 0, 2 67 mmol) in THF (5 ml) wurden Diisopropylcarbodiimid
(83 μl,
0,534 mmol) und CuCl (2,7mg, 0,027 mmol) hinzugegeben, und die Reaktionsmischung
wurde über
Nacht bei Raumtemperatur gerührt.
Die Reaktionsmischung wurde in Ethylacetat aufgenommen und mit wässerigem
5%igem Natriumbicarbonat und Salzlösung gewaschen, über Natriumsulfat
getrocknet und in vacuo konzentriert, um ein klares Glas zu ergeben.
Chromatographie auf Silikagel (95:5:0,5 Dichlormethan-Methanol-Ammoniak)
ergab die Titelverbindung (63mg) als einen weißen Feststoff.
13C NMR(CDCl3) δ 219.5(C-9), 205.6 (C-3),
169.9 (C-1), 103.4, 81.3, 78.2, 77.4, 77.1, 74.0, 70.2, 69.7, 69.1, 65.9,
51.1, 48.6, 46.7, 44.3, 40.2, 38.0, 37.6, 28.2, 23.5, 21.2, 19.7,
17.8, 16.1, 14.4, 11.9, 10.5, 10.5. MS (FAB)+ m/e 613 (M+H)+.
-
Beispiel 8
-
Verbindung mit der Formel
(VIII): X ist O, R ist -CH2CH2NH2.
-
Zu
einer Lösung
in Methanol (10 ml) der in Beispiel 4 hergestellten Verbindung (170
mg, 0,276 mmol) wurde Ammoniumacetat (212 mg, 2,76 mmol) hinzugefügt, und
die Mischung wurde auf 0°C
gekühlt.
Natriumcyanoborhydrid (34 mg, 0,553 mmol) wurde hinzugefügt, und
die Reaktionsmischung wurde 30 Stunden lang bei 0°C gerührt. Die
Reaktionsmischung wurde in Ethylacetat aufgenommen und mit wässerigem
5%igem Natriumcarbonat, wässerigem
2%igem Tris(hydroxymethyl)aminomethan und Salzlösung gewaschen, über Natriumsulfat
getrocknet, filtriert und in vacuo konzentriert. Chromatographie
auf Silikagel (90:10:0,5 Dichlormethan-Methanol-Ammoniak) ergab
die Titelverbindung (90mg) als einen weißen Feststoff.
13C NMR (CDCl3) δ 217.0 (C-9),
206.3 (C-3), 170.6 (C-1), 102.7, 78.9, 78.5, 75.1. 74.9, 70.3, 69.4,
67.8, 65.9, 63.1, 50.8, 45.8, 44.9, 41.7, 40.3, 38.8, 38.2, 28.4,
22.2, 21.3. 20.7, 19.2, 16.6, 14.9, 12.8, 12.4, 10.9. MS (FAB)+
m/e 617 (M+H)+.
-
Beispiel 9
-
Verbindung mit der Formel
(VIII): X ist O, R ist -CH2CH2NHCH2-Phenyl.
-
Zu
einer 0°C-Lösung in
Methanol (10 ml) der in Beispiel 4 hergestellten Verbindung (121,3
mg, 0,200 mmol) wurden Essigsäure
(114 μl,
2,00 mmol) und Benzylamin (218 μl,
2,00 mmol) hinzugefügt,
und die Mischung wurde 10 Minuten lang gerührt. Natriumcyanoborhydrid
(24,8 mg, 0,400 mmol) wurde hinzugefügt, und die Reaktionsmischung
wurde 16 Stunden lang gerührt.
Zusätzliches
Natriumcyanoborhydrid (24,8 mg, 0,400mmol) wurde dann hinzugegeben,
und das Rühren
wurde für
5 Stunden fortgesetzt. Die Reaktionsmischung wurde in Ethylacetat
aufgenommen und mit wässerigem
5%igem Natriumcarbonat, wässerigem 2%igem
Tris(hydroxymethyl)aminomethan und Salzlösung gewaschen, über Natriumsulfat
getrocknet, filtriert und in vacuo konzentriert. Chromatographie
auf Silikagel (95:5:0,5 Dichlormethan-Methanol-Ammoniak), gefolgt
von einer zweiten Chromatographie (50:50:0,5 Aceton-Hexane-Triethylamin)
ergab die Titelverbindung (82 mg) als einen weißen Schaum.
13C
NMR (CDCl3) δ 216.6 (C-9), 206.3 (C-3), 170.5
(C-1), 139.0, 128.6, 128.3, 126,9, 102.4, 78.9, 78.4, 75.1, 74.8,
702, 69.4, 67.8, 65.9, 61.7, 53.2, 50.7, 48.2, 45.6, 44.8, 40.2,
38.8, 38.0, 28.3, 21.9, 21.3, 20.6, 18.8, 16.6, 14.6, 12.6, 12.3,
10.7. MS (FAB)+ m/e 707 (M+H)+.
-
Beispiel 10
-
Verbindung mit der Formel
(VIII): X ist O, R ist -CH2CH2NHCH2CH2-Phenyl.
-
Zu
einer 0°C-Lösung in
Methanol (10 ml) der in Beispiel 4 hergestellten Verbindung (121,3
mg, 0,200 mmol) wurden Essigsäure
(114 μl,
2,00 mmol) und Phenethylamin (218 μl, 2,00 mmol) hinzugegeben,
und die Mischung wurde 10 Minuten lang gerührt. Natriumcyanoborhydrid
(24,8 mg, 0,400 mmol) und die Reaktionsmischung wurden 16 Stunden
lang gerührt.
Die Reaktionsmischung wurde in Ethylacetat aufgenommen und mit wässerigem
5%igem Natriumcarbonat, wässerigem
2%igem Tris (hydroxymethyl)aminomethan und Salzlösung gewaschen, über Natriumsulfat
getrocknet, filtriert und in vacuo konzentriert. Chromatographie
auf Silikagel (90:10:0,5 Dichlormethan-Methanol-Ammoniak) ergab die Titelverbindung
(60,1 mg) als einen weißen Schaum.
MS (FAB)+ m/e 721 (M+H)+.
-
Beispiel 11
-
Verbindung mit der Formel
(VIII): x ist O, R ist -CH2CH2NHCH
(CO2CH3)CH2-Phenol.
-
Zu
einer 0°C-Lösung in
Methanol (10 ml) der in Beispiel 4 hergestellten Verbindung (121,3
mg, 0,200 mmol) wurde L-Phenylalaninmethylesterhydrochlorid
(129 mg, 0,600 mmol) hinzugefügt,
und die Mischung wurde 10 Minuten lang gerührt. Natriumcyanoborhydrid
(24,8 mg, 0,400 mmol) und die Reaktionsmischung wurden 22 Stunden
lang gerührt.
Die Reaktionsmischung wurde in Ethylacetat aufgenommen und mit wässerigem
5%igem Natriumcarbonat, wässerigem
2%igem Tris (hydroxymethyl)aminomethan und Salzlösung gewaschen, über Natriumsulfat
getrocknet, filtriert und in vacuo konzentriert. Chromatographie
auf Silikagel (95:5:0,5 Dichlormethan-Methanol- Ammoniak) ergab die Titelverbindung
(60,1 mg) als weißen
Schaum.
13C NMR (CDCl3) δ 217.8 (C-9),
206.4 (C-3), 170.5 (C-1), 170.4, 137.5, 129.4, 128.2, 126,4, 102.4,
78.8, 78.4, 75.2. 74.9, 70.2. 69.4, 68.5, 65.9, 63.1, 61.6, 51.4,
50.7, 47.1, 45.5. 44.7, 40.2, 39.2, 38.4. 28.4, 21.8. 21.2, 20.6,
18.7. 16.6, 14.7, 12.6, 12.2, 10.7. MS (FAB)+ m/e
779 (M+H)+.
-
Beispiel 12
-
Verbindung mit der Formel
(VIII): X ist O, R ist -CH2CH2NHCH2-(4-Pyridyl).
-
Die
gewünschte
Verbindung wurde hergestellt gemäß dem Verfahren
von Beispiel 10, außer
dass Phenethylamin durch 4-Aminomethylpyridin
ersetzt wurde.
13C NMR (CDCl3) δ 217.8
(C-9), 206.2 (C-3), 170.6 (C-1), 149.7, 148.2, 123.3, 102.5, 78.9,
78.4, 75.0, 74.9, 70.2, 69.5, 68.4, 65.9, 61.7, 52.4. 50.7, 48.7,
45.7, 44.8, 40.2. 39.2, 38.5, 38.2, 28.4, 21.8, 21.3, 20.6, 18.7, 16.6,
14.6, 12.6, 12.2, 10.7. MS (FAB)+ m/e 708
(M+H)+.
-
Beispiel 13
-
Verbindung mit der Formel
(VIII): X ist O, R ist -CH2CH2NHCH2-(4-Chinolyl).
-
Zu
einer Lösung
aus der in Beispiel 8 hergestellten Verbindung (90 mg, 0,15 mmol)
in Methanol (2 ml) wurden 4-Chinolincarboxaldehyd
(23 mg, 0,15 mmol), Essigsäure
(8,6 μl,
0,15 mmol) und Natriumcyanoborhydrid (9,4 mg, 0,15 mmol) hinzugefügt, und
die Reaktionsmischung wurde 15 Stunden lang gerührt. Die Reaktionsmischung
wurde in Ethylacetat aufgenommen und mit wässerigem 5%igem Natriumcarbonat,
wässerigem
2%igem Tris(hydroxymethyl)aminomethan und Salzlösung gewaschen, über Natriumsulfat
getrocknet, filtriert und in vacuo konzentriert. Chromatographie
auf Silikagel (90:10:0,5 Dichlormethan-Methanol-Ammoniak) ergab die Titelverbindung
(32 mg) als einen gebrochen weißen
Feststoff. MS (FAB)+ m/e 758 (M+H)+.
-
Beispiel 14
-
Verbindung mit der Formel
(VIII): X ist O, R ist -CH2CH=CH-Phenyl.
-
Schritt 14a: Verbindung
9 aus Schema 2; X ist O, R ist -CH2CH=CH-Phenyl, Rp ist Benzoyl.
-
Zu
einer Lösung
unter Stickstoff der in Beispiel 1, Schritt 6, hergestellten Verbindung
(717 mg, 1,00 mmol), Palladium(II)acetat (22 mg, 0,100 mmol) und
Triphenylphosphin (52 mg, 0,200 mmol) in Acetonitril (5 ml) wurden
Iodbenzen (220μl,
2,00 mmol) und Triethylamin (280 μl,
2,00 mmol) hinzugefügt,
und die Mischung wurde auf -78°C
abgekühlt,
entgast und versiegelt. Die Reaktionsmischung wurde dann 0,5 Stunden
lang auf 60°C
erwärmt
und 12 Stunden lang bei 80°C
gerührt.
Die Reaktionsmischung wurde in Ethylacetat aufgenommen und zweimal
mit wässerigem
5%igem Natriumbicarbonat, einmal mit wässerigem 2%igem Tris(hydroxymethyl)aminomethan
und einmal mit Salzlösung
gewaschen, über
Natriumsulfat getrocknet, filtriert und in vacuo konzentriert. Chromatographie
auf Silikagel (95:5:0,5 Dichlormethan-Methanol-Ammoniak) ergab die
Titelverbindung (721mg) als einen gebrochen weißen Schaum.
-
Schritt 14b: Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH=CH-Phenyl.
-
Das
Entschützen
der in Schritt 14a hergestellten Verbindung wurde erreicht durch
Erhitzen in Methanol gemäß dem Verfahren
von Beispiel 1, Schritt g.
13C NMR
(CDCl3) δ 219.4
(C-9), 206.0 (C-3),
169.8 (C-1), 137.0, 132.6, 128.3, 127.3. 128.7, 126.6, 102.7, 78.4, 78.2,
75.9, 74.3, 70.3, 69.5, 69.1, 65.9, 64.2, 50.6, 45.4, 45.3, 40.2,
38.7, 37.7, 28.3, 21.9, 21.2, 20.3, 18.1, 16.5, 14.6, 13.0, 12.3,
10.8. MS (FAB)+ m/e 690 (M+H)+.
-
Beispiel 15
-
Verbindung mit der Formel
(VIII) : X ist O, R ist -CH2CH2CH2-Phenyl.
-
Eine
Lösung
aus der in Beispiel 14 hergestellten Verbindung (170 mg, 0,247 mmol)
in Methanol (10 ml) wurde mit Stickstoff gespült. 10% Palladium auf Kohlenstoff
(50 mg) wurde hinzugefügt,
und die Mischung wurde mit Wasserstoff gespült und 18 Stunden lang unter
positivem Wasserstoffdruck gerührt.
Die Reaktionsmischung wurde durch Celit filtriert, und der Filterkuchen
wurde mit Dichlormethan gespült.
Das Filtrat wurde in vacuo konzentriert, um ein farbloses Glas zu
ergeben. Das Glas wurde in Ether aufgenommen, Hexan wurde hinzugefügt, und
die Lösungsmittel
wurden in vacuo entfernt, um die Titelverbindung (67 mg) als einen
weißen Feststoff
zu ergeben.
13C NMR (CDCl3) δ 220.2 (C-9), 206.5 (C-3),
170.0 (C-1), 142.3, 128.4, 128.1, 125.4, 102.6, 78.2, 78.0, 75.6, 74.2,
70.3, 69.5, 69.4, 65.9, 62.1, 50.6, 45.4, 44.6, 40.2, 38.8, 37.5,
32.1, 30.3, 28.4, 21.9, 21.3. 20.2, 18.4, 16.5, 14.9, 12.4, 10.6.
MS (FAB)+ m/e 692 (M+H)+.
-
Beispiel 16
-
Verbindung mit der Formel
(VIII): X ist O, R ist -CH2CH=CH-(4-Methoxyphenyl).
-
Die
gewünschte
Verbindung wurde hergestellt nach dem Verfahren von Beispiel 14,
außer
dass Iodbenzen durch 4-Iodanisol
ersetzt wurde. MS (FAB)+ m/e 720 (M+H)+.
-
Beispiel 17
-
Verbindung mit der Formel
(VIII): X ist O, R ist -CH2CH=CH-(4-Chlorphenyl).
-
Die
gewünschte
Verbindung wurde hergestellt gemäß dem Verfahren
von Beispiel 14, außer
dass Iodbenzen durch 1-Chlor-4-iodbenzen
ersetzt wurde.
13C NMR (CDCl3) δ 219.6
(C-9), 206.0 (C-3), 169.8 (C-1), 139.6, 135.5, 131.3, 128.5, 127.9,
127.3, 102.7, 78.4, 78.2, 75.9, 74.2, 70.3, 69.5, 69.2. 65.9, 64.1,
50.6, 45.4, 45.3, 40.2, 38.6, 37.6, 28.4, 21.8, 21.2, 20.3, 18.0, 16.5,
14.6, 13.0, 12.2, 10.8. MS (FAB)+ m/e 724 (M+H)+.
-
Beispiel 18
-
Verbindung mit der Formel
(VIII): X ist O, R ist -CH2CH=CH-(3-Chinolyl).
-
Schritt 18a: Verbindung
9 aus Schema 2; X ist O, R ist -CH2CH=CH-(3-Chinolyl), Rp
ist Benzoyl.
-
Eine
Mischung aus der Verbindung, die in Beispiel 1, Schritt f, hergestellt
wurde (1,80 g, 0,25 mmol), Palladium(II) acetat (11 mg, 0,05 mmol)
und Tri-o-tolylphosphin (30 mg, 0,10 mmol) und 3-Bromchinolin (68 μl, 0,5 mmol)
in Acetonitril (2 ml) wurde auf -78°C gekühlt, entgast und versiegelt.
Die Reaktionsmischung wurde dann 2 Stunden lang auf 50°C erhitzt
und 16 Stunden lang bei 80°C
gerührt.
Die Reaktionsmischung wurde in Ethylacetat aufgenommen und mit wässerigem
5%igem Natriumcarbonat, wässerigem
2%igem Tris(hydroxymethyl)aminomethan und Salzlösung gewaschen, über Natriumsulfat
getrocknet, filtriert und in vacuo konzentriert. Chromatographie
auf Silikagel (98:2 Dichlormethan-Methanol) ergab die Titelverbindung
(186 mg) als einen gebrochen weißen Schaum. MS (FAB)+ m/e 845 (M+H)+.
-
Schritt 18b: Verbindung
mit der Formel (VIII): X ist O, R ist -CH2CH=CH-(3-Chinolyl).
-
Entschützen der
in Schritt 18a hergestellten Verbindung wurde erzielt durch Erhitzen
in Methanol gemäß dem Verfahren
von Beispiel 1, Schritt g.
13C NMR
(CDCl3) δ 319.7
(C-9), 205.9 (C-3),
169.8 (C-1), 152.1, 150.0, 147.5, 140.2, 132.6, 130.0, 129.2, 129.1,
128.8, 128.1, 127.9, 126.5, 102.8, 78.5. 18.2, 75.9, 74.2, 70.2,
69.4, 69.2, 65.9, 64.1, 50.6, 45.4, 45.3. 40.2, 38.7, 37.6, 28.4,
21.8, 212, 20.3, 18.0, 16.5, 14.6, 13.0, 12.2, 10.8. MS (FAB)+ m/e
741 (M+H)+.
-
Unter
Anwendung der Verfahren, die in den obigen Beispielen und Schemata
beschrieben sind, und Verfahren, die im Fachgebiet der synthetischen
organischen Chemie bekannt sind, können die folgenden Verbindungen
mit der Formel VIII, worin X O ist, hergestellt werden. Diese Verbindungen,
bei denen der R-Substituent
wie in der Tabelle unten beschrieben ist, haben die Formel
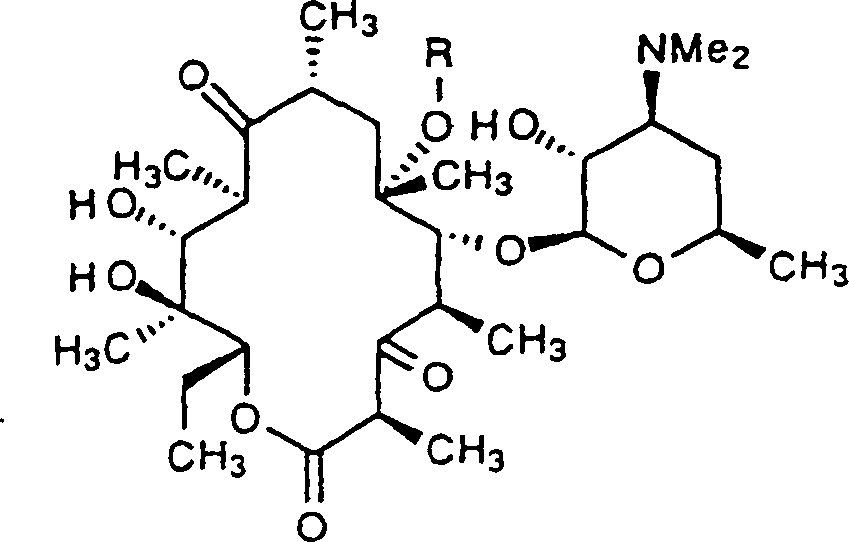
| Beispiel
Nr. | Substituent |
| 19 | R
ist -CH2CH2CH2OH |
| 20 | R
ist -CH2C(O)OH |
| 21 | R
ist -CH2CH2NHCH3 |
| 22 | R
ist -CH2CH2NHCH2OH |
| 23 | R
ist -CH2CH2N(CH3)2 |
| 24 | R
ist -CH2CH2(1-Morpholinyl) |
| 25 | R
ist -CH2C(O)NH2 |
| 26 | R
ist -CH2NHC(O)NH2 |
| 27 | R
ist -CH2NHC(O)CH3 |
| 28 | R
ist -CH2F |
| 29 | R
ist -CH2CH2OCH3 |
| 30 | R
ist -CH2CH3 |
| 31 | R
ist -CH2CH=CH(CH3)2 |
| 32 | R
ist -CH2CH2CH(CH3)CH3 |
| 33 | R
ist -CH2CH2OCH2CH2OCH3 |
| 34 | R
ist -CH2SCH3 |
| 35 | R
ist -Cyclopropyl |
| 36 | R
ist -CH2OCH3 |
| 37 | R
ist -CH2CH2F |
| 38 | R
ist -CH2-Cyclopropyl |
| 39 | R
ist -CH2CH2CHO |
| 40 | R
ist -C(O)CH2CH2CH3 |
| 41 | R
ist -CH2-(4-Nitrophenyl) |
| 42 | R
ist -CH2-(4-Chlorphenyl) |
| 43 | R
ist -CH2-(4-Methoxyphenyl) |
| 44 | R
ist -CH2-(4-Cyanophenyl) |
| 45 | R
ist -CH2CH=CHC(O)OCH3 |
| 46 | R
ist -CH2CH=CHC (O)OCH2CH3 |
| 47 | R
ist -CH2CH=CHCH3 |
| 48 | R
ist -CH2CH=CHCH2CH3 |
| 49 | R
ist -CH2CH=CHCH2CH2CH3 |
| 50 | R
ist -CH2CH=CHSO2-Phenyl |
| 51 | R
ist -CH2C≡C-Si(CH3)3 |
| 52 | R
ist -CH2C≡CCH2CH2CH2CH2CH2CH3 |
| 53 | R
ist -CH2C≡CCH3 |
| 54 | R
ist -CH2-(2-Pyridyl) |
| 55 | R
ist -CH2-(3-Pyridyl) |
| 56 | R
ist -CH2-(4-Pyridyl) |
| 57 | R
ist -CH2-(4-Chinolyl) |
| 58 | R
ist -CH2NO2 |
| 59 | R
ist -CH2C(O)OCH3 |
| 60 | R
ist -CH2C(O)-Phenyl |
| 61 | R
ist -CH2C(O)CH2CH3 |
| 62 | R
ist -CH2Cl |
| 63 | R
ist -CH2S(O)2-Phenyl |
| 64 | R
ist -CH2CH=CHBr |
| 65 | R
ist -CH2CH=CH-(4-Chinolyl) |
| 66 | R
ist -CH2CH2CH2-(4-Chinolyl) |
| 67 | R
ist -CH2CH=CH-(5-Chinolyl) |
| 68 | R
ist -CH2CH2CH2-(5-Chinolyl) |
| 69 | R
ist -CH2CH=CH-(4-Benzoxazolyl) |
| 70 | R
ist -CH2CH=CH-(7-Benzimidazolyl) |
-
Beispiel 71
-
Verbindung mit der Formel
(IX): L ist CO, T ist O, R ist -CH2CH=CH2.
-
Schritt 71a: Verbindung
10 aus Schema 2; R ist -CH2CH=CH2, Rp ist Benzoyl.
-
Zu
einer -35°C-Lösung unter
Stickstoff in THF (60 ml) der in Beispiel 1, Schritt f, hergestellten
Verbindung (3,58 g, 5,00mmol) wurde Natriumhexamethyldisilazid (1,0
M in THF, 5,5ml, 5,5 mmol) gegeben, und die resultierende weiße Suspension
wurde 30 Minuten lang gerührt.
Eine Lösung
aus Carbonyldiimidazol (4,05 g, 25 mmol) in THF (40 ml) wurde bei
-35°C über einen
Zeitraum von 20 Minuten tropfenweise hinzugefügt, und dann wurde das Kältebad entfernt,
und die Reaktionsmischung wurde 30 Minuten lang gerührt. Die
Reaktionsmischung wurde in Ethylacetat aufgenommen und mit wässerigem
5%igem Natriumbicarbonat und Salzlösung gewaschen, über Natriumsulfat
getrocknet, filtriert und in vacuo konzentriert. Chromatographie
auf Silikagel (30% Aceton-Hexan) ergab die Titelverbindung (2,6
g) als weißen
Schaum. MS (FAB)+ m/e 744 (M+H)+.
-
Schritt 71b: Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH=CH2.
-
Das
Entschützen
der in Schritt 71a hergestellten Verbindung wurde erreicht durch
Erhitzen in Methanol gemäß dem Verfahren
von Beispiel 1, Schritt g.
13C NMR
(CDCl3) δ 212.1
(C-9), 25.0 (C-3),
168.9 (C-1), 153.8. 134.4. 118.4, 103.1, 84.7, 80.5, 78.7, 77.1,
76.9, 70.3, 69.5, 65.9, 64.8, 50.8, 46.5, 44.1, 40.2, 38.8, 35.1.
25.4, 22.7, 21.2, 20.5, 18.3, 14.5, 13.6, 12.6, 10.6. MS (FAB)+
m/e 640 (M+H)+.
-
Beispiel 72
-
Verbindung mit der Formel
(IX): L ist CO, T ist O, R ist -CH2CH=CH-Phenyl.
-
Schritt 72a: Verbindung
10 aus Schema 2; R ist -CH2CH=CH-Phenyl,
Rp ist Benzoyl.
-
Eine
Lösung
der in Beispiel 14, Schritt a, hergestellten Verbindung (150 mg,
0,20 mmol) in THF (5 ml) wurde auf -35°C gekühlt und mit Stickstoff gespült. Lithiumhexamethyldisilazid
(1,0 M in THF, 0,22 ml, 0,22 mmol) über einen Zeitraum von 2 Minuten
bei -35°C.
Die Reaktionsmischung wurde 10 Minuten lang bei -35°C gerührt, und
dann wurde eine Lösung
aus Carbonyldiimidazol (162 mg, 1,00 mmol) in THF (3 ml) tropfenweise über einen
Zeitraum von 2 Minuten hinzugegeben. Das Kältebad wurde entfernt, und
die Reaktionsmischung wurde 30 Minuten lang gerührt. Die Reaktionsmischung
wurde auf 0°C
gekühlt,
und wässeriges
0,5 M KH2PO4 wurde
hinzugefügt.
Die Mischung wurde mit Ethylacetat extrahiert, und die organische
Phase wurde mit Salzlösung
gewaschen, über
Natriumsulfat getrocknet und in vacuo konzentriert. Chromatographie
auf Silikagel (30% Aceton-Hexan) ergab die Titelverbindung (87 mg)
als einen weißen
Feststoff. MS (FAB)+ m/e 820 (M+H)+.
-
Schritt 72b: Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH=CH-Phenyl.
-
Das
Entschützen
der in Schritt 72a hergestellten Verbindung wurde erzielt durch
Erhitzen in Methanol gemäß dem Verfahren
von Beispiel 1, Schritt g.
13C NMR
(CDCl3) δ 212.4
(C-9), 205.2 (C-3),
168.3 (C-1), 153.3, 136.4, 134.9, 128.3, 127.6, 127.0, 124.7, 103.2,
84.5, 80.8, 78.7, 78.0, 70.3,69.6, 65.9, 64.5, 50.9, 46.9, 44.4,
40.2, 39.1, 37.8, 28.3, 23.0, 21.2, 20.4, 18.1, 14.8, 14.4, 13.7,
12.6, 10.8. MS (FAB)+ m/e 716 (M+H)+.
-
Beispiel 73
-
Verbindung mit der Formel
(IX): L ist CO, T ist O, R ist -CH2CH2CH2-Phenyl.
-
Schritt 73a: Verbindung
8 aus Schema 1b; R ist -CH2CH2CH2-Phenyl, Rp ist Benzoyl.
-
Die
gewünschte
Verbindung wurde hergestellt durch Reaktion der Verbindung aus Beispiel
15 mit Benzoesäureanhydrid
gemäß dem Verfahren
von Beispiel 1, Schritt e.
-
Schritt 73b: Verbindung
10 aus Schema 1b; R ist -CH2CH2CH2-Phenyl, Rp ist
Benzoyl.
-
Eine
Lösung
aus der in Schritt 73a hergestellten Verbindung (104 mg, 0,13 mmol)
in THF (5 ml) wurde auf -35°C
gekühlt
und mit Stickstoff gespült.
Natriumhexamethyldisilazid (1,0 M in THF, 0,16 ml, 0,16 mmol) über einen
Zeitraum von 1 Minute bei -35°C.
Die Reaktionsmischung wurde 10 Minuten lang bei -35°C gerührt, und
dann wurde eine Lösung
aus Carbonyldiimidazol (105 mg, 0,65 mmol) in THF (3 ml) tropfenweise über einen
Zeitraum von 1 Minute hinzugegeben. Das Kältebad wurde entfernt, und
die Reaktionsmischung wurde 30 Minuten lang gerührt. Die Mischung wurde mit
Ethylacetat extrahiert, und die organische Phase wurde mit wässerigem
5%igem Natriumbicarbonat und Salzlösung gewaschen, über Natriumsulfat
getrocknet und in vacuo konzentriert, um ein farbloses Glas zu ergeben.
Chromatographie auf Silikagel (30% Aceton-Hexan) ergab die Titelverbindung
(63 mg) als einen weißen
Feststoff. MS (FAB)+ m/e 822 (M+H)+.
-
Schritt 73c: Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH2CH2-Phenyl.
-
Das
Entschützen
der in Schritt 73b hergestellten Verbindung wurde durchgeführt durch
Erhitzen in Methanol gemäß dem Verfahren
von Beispiel 1, Schritt g.
13C NMR
(CDCl3) δ 211.8
(C-9), 205.1 (C-3),
169.6 (C-1), 153.6, 241.9, 128.5, 128.1, 125.5, 102.7, 84.6, 80.5, 78.3,
76.0, 70.2, 69.5, 65.9, 62.4, 50.7, 45.5, 44.5, 40.2, 38,6, 37.9,
31.9, 30.4, 28.4, 22.6. 21.2, 203, 18.5, 14.6, 13.4, 13.3, 12.6,
10.4. MS (FAB)+ m/e 718 (M+H)+.
-
Beispiel 74
-
Verbindung mit der Formel
(IX): L ist CO, T ist O, R ist -CH2CH=CH-(4-Chlorphenyl).
-
Schritt 74a: Verbindung
10 aus Schema 1b; R ist -CH2CH=CH-(4-Chlorphenyl), Rp ist Benzoyl.
-
Eine
Lösung
der Verbindung mit der Formel 10 (R ist -CH2CH=CH-(4-Chlorphenyl),
Rp ist Benzoyl), hergestellt wie in Beispiel
17 (165 mg, 0,20 mmol), in THF (5 ml) wurde auf -35°C gekühlt und
mit Stickstoff gespült.
Lithiumhexamethyldisilazid (1,0 M in THF, 0,22 ml, 0,22 mmol) über 2 Minuten
bei -35°C.
Die Reaktionsmischung wurde 10 Minuten lang bei -35°C gerührt, und
dann wurde eine Lösung
aus Carbonyldiimidazol (105 mg, 0,65mmol) in THF (3 ml) tropfenweise über einen
Zeitraum von 2 Minuten hinzugegeben. Das Kältebad wurde entfernt, und
die Reaktionsmischung wurde 30 Minuten lang gerührt. Die Mischung wurde mit
Ethylacetat extrahiert, und die organische Phase wurde mit wässerigem
5%igem Natriumbicarbonat und Salzlösung gewaschen, über Natriumsulfat
getrocknet und in vacuo konzentriert, um ein farbloses Glas (219
mg) zu ergeben, das ohne weitere Reinigung verwendet wurde. MS (FAB)+ m/e 854 (M+H)+.
-
Schritt 74b: Verbindung
mit der Formel (IX): L ist CO, T ist O, R ist -CH2CH=CH-(4-Chlorphenyl).
-
Das
Entschützen
der in Schritt 74a hergestellten Verbindung wurde durchgeführt durch
Erhitzen in Methanol gemäß dem Verfahren
von Beispiel 1, Schritt g.
13C NMR
(CDCl3) δ 212.4
(C-9), 205.1 (C-3),
168.6 (C-1), 153.3, 2 35.0, 133.5, 133.2, 128.5, 128.3. 125.5, 103.2,
84.5, 80.7, 78.0, 78.0, 70.3. 69.6, 66.0, 64.3, 50.9, 46.9, 44.4,
40.2, 39.1, 37.8, 28.4, 23.0, 21.2, 20.4, 18.1, 14.8, 14.4, 13.6,
12.6, 10.7. MS (FAB)+ m/e 750 (M+H)+.
-
Beispiel 75
-
Verbindung mit der Formel
(IX): L ist CO, T ist O, R ist -CH2CH=CH-(3-Chinolyl).
-
Die
Verbindung mit der Formel 10 (R ist -CH2CH=CH-(3-Chinolyl), Rp ist Benzoyl), hergestellt wie in Beispiel
18, wurde unter Anwendung des Verfahrens von Beispiel 71, Schritte
a und b, in die Titelverbindung umgewandelt.
13C
NMR (CDCl3) δ 212.4 (C-9), 205.2 (C-3), 168.7
(C-1), 153.4, 150.3, 147.6, 132.7, 131.1, 129.6, 129.0, 128.9, 128.4,
128.1, 127.7, 126.6, 103.2, 84.5, 80.6, 78.9, 77.5, 77.0, 70.3,
69.6, 65.9, 64.3, 50.9, 46.9, 44.5, 40.3, 39.0, 37.8, 28.4, 22.8,
21.2, 20.4, 18.1, 14.7, 14.4, 13.5, 12.6, 10.6. MS (FAB)+ m/e 767
(M+H)+.
-
Unter
Anwendung der Verfahren, die in den obigen Beispielen und Schemata
beschrieben sind, und Verfahren, die im Fachgebiet der synthetischen
organischen Chemie bekannt sind, können die folgenden Verbindungen
mit der Formel IX, worin L CO ist und T Oist, hergestellt werden.
Diese Verbindungen, bei denen der R-Substituent wie in der Tabelle
unten beschrieben ist, haben die Formel
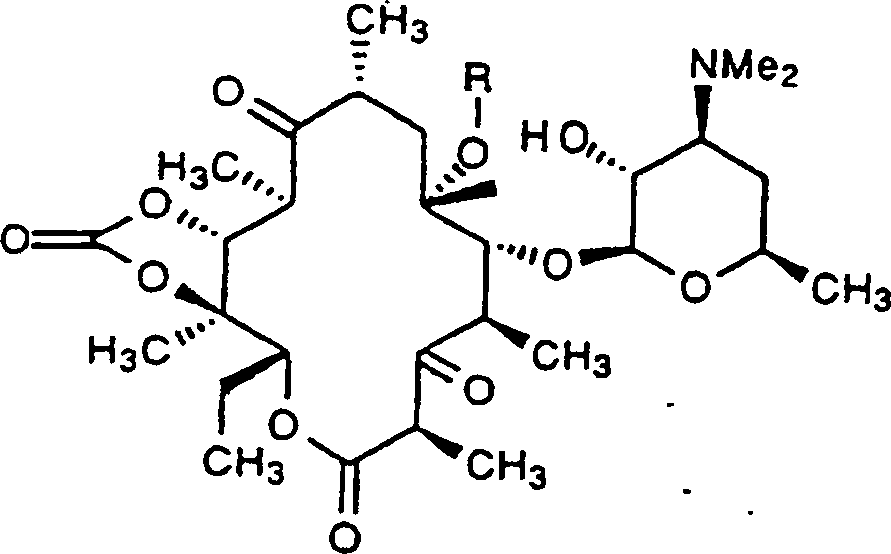
| Beispiel
Nr. | Substituent |
| 76 | R
ist -CH2CH2CH3 |
| 77 | R
ist -CH2CH2CH2 |
| 78 | R
ist -CH2CH=NOH |
| 79 | R
ist -CH2CH2CH2OH |
| 80 | R
ist -CH2F |
| 81 | R
ist -CH2CH2-Phenyl |
| 82 | R
ist -CH2CH2- (4-Pyridyl) |
| 83 | R
ist -CH2CH2-(4-Chinolyl) |
| 84 | R
ist -CH2CH(OH)CN |
| 85 | R
ist -CH(C(O)OCH3)CH2-Phenyl |
| 86 | R
ist -CH2CN |
| 87 | R
ist -CH2CH=CH-(4-Methoxyphenyl) |
| 88 | R
ist -CH2CH=CH-(4-Fluorphenyl) |
| 89 | R
ist -CH2CH=CH-(8-Chinolyl) |
| 90 | R
ist -CH2CH2NHCH2-Phenyl |
| 91 | R
ist -CH2-Phenyl |
| 92 | R
ist -CH2-(4-Pyridyl) |
| 93 | R
ist -CH2-(4-Chinolyl) |
| 94 | R
ist -CH2CH=CH-(4-Pyridyl) |
| 95 | R
ist -CH2CH2CH2- (4-Pyridyl) |
| 96 | R
ist -CH2CH=CH-(4-Chinolyl) |
| 97 | R
ist -CH2CH2CH2-(4-Chinolyl) |
| 98 | R
ist -CH2CH=CH-(5-Chinolyl) |
| 99 | R
ist -CH2CH2CH2- (5-Chinolyl) |
| 100 | R
ist -CH2CH=CH-(4-Benzoxazolyl) |
| 101 | R
ist -CH2CH=CH-(4-Benzimidazolyl) |
-
Beispiel 102
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH=CH2.
-
Schritt 102a: Verbindung
11 aus Schema 2; R ist -CH2CH=CH2, Rp ist Benzoyl.
-
Zu
einer Lösung
der Verbindung 10 (R ist -CH2CH=CH2, Rp ist Benzoyl),
hergestellt wie in Beispiel 71, Schritt a (2,59 g, 3,48 mmol), in
Benzol (100 ml) wurde 1,8-Diazabicyclo[5.4.0] undec-7-en (DBU, 5,0
ml, 34 mmol) gegeben. Die Reaktionsmischung wurde mit Stickstoff
gespült,
auf 80°C
erwärmt
und 3,5 Stunden lang gerührt.
Die Reaktionsmischung wurde auf 0°C
gekühlt,
und wässeriges
0,5 M NaH2PO4 (100
ml) wurde hinzugefügt.
Die Mischung wurde zweimal mit Ethylacetat extrahiert, und die kombinierten
organischen Schichten wurden mit Salzlösung gewaschen, über Natriumsulfat
getrocknet und in vacuo konzentriert, um einen weißen Schaum
zu ergeben. Chromatographie auf Silikagel (30% Aceton-Hexane) ergab
die Titelverbindung (1,74 g) als einen weißen Feststoff. MS (FAB)+ m/e
700 (M+H)+.
-
Schritt 102b: Verbindung
12 aus Schema 3a: R ist -CH2CH=CH2, Rp ist Benzoyl.
-
Eine
Lösung
in THF (30 ml) der in Schritt 102a hergestellten Verbindung (1,74
g, 2,49 mmol) wurde auf -10°C
gekühlt
und mit Stickstoff gespült.
Natriumhydrid (80% in Mineralöl,
150 mg, 5,00 mmol) wurde hinzugefügt, und die Reaktionsmischung
wurde 10 Minuten lang gerührt.
Eine Lösung
aus Carbonyldiimidazol (1,22 g, 7, 50 mmol) in THF (20 ml) wurde über einen
Zeitraum von 10 Minuten bei -10°C
hinzugegeben. Das Kältebad
wurde entfernt, und die Reaktionsmischung wurde 1 Stunde lang gerührt. Die
Reaktionsmischung wurde mit Ethylacetat extrahiert, und die organische
Phase wurde mit wässerigem
5%igem Natriumbicarbonat und Salzlösung gewaschen, über Natriumsulfat
getrocknet und in vacuo konzentriert, um einen weißen Schaum
zu ergeben. Chromatographie auf Silikagel (30% Aceton-Hexane) ergab
die Titelverbindung (1,58 g) als einen weißen Feststoff. MS (FAB)+ m/e 794 (M+H)+.
-
Schritt 102c: Verbindung
18 aus Schema 4: R ist -CH2CH=CH2, Rp ist Benzoyl.
-
Die
in Schritt 102b hergestellte Verbindung (1,19 g, 1,5mmol) wurde
in THF (2 ml) und Acetonitril (20 ml) aufgelöst, und die Lösung wurde
mit Stickstoff gespült.
Wässeriges
Ammoniumhydroxid (28%, 21 ml) wurde hinzugefügt, und die Reaktionsmischung
wurde unter Stickstoff 24 Stunden lang gerührt. Die Reaktionsmischung
wurde mit Ethylacetat extrahiert, und die organische Phase wurde
mit wässerigem
5%igem Natriumbicarbonat und Salzlösung gewaschen, über Natriumsulfat
getrocknet und in vacuo konzentriert, um einen weißen Schaum
zu ergeben. Chromatographie auf Silikagel (30% Aceton-Hexane) ergab
die Titelverbindung (0,56 g) als einen weißen Feststoff. MS (FAB)+ m/e
743 (M+H)+.
-
Schritt 102d: Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH2.
-
Die
Titelverbindung wurde hergestellt durch Entschützen der in Schritt 102c hergestellten
Verbindung durch Erhitzen in Methanol gemäß dem Verfahren von Beispiel
1, Schritt g.
13C NMR (CDCl3) δ 216.9
(C-9), 205.3 (C-3), 169.5 (C-1), 158.0, 134.4, 118.2, 102.8, 83.7,
78.4, 77.1, 76.1, 70.2, 69.5, 65.9, 64.7, 57.8, 50.8, 45.9, 45.1,
40.2, 38.9, 37.3, 28.3, 22.6, 21.2, 20.2. 18.1, 14.5, 13.8, 13.7, 10.6.
MS (FAB)+ m/e 639 (M+H)+.
-
Beispiel 103
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH=CH-Phenyl.
-
Die
gewünschte
Verbindung wurde hergestellt unter Anwendung des Verfahrens von
Beispiel 18, außer
dass die darin verwendete Verbindung aus Beispiel 1, Schritt f,
durch die in Beispiel 102, Schritt c, hergestellte Verbindung (d.
h. Verbindung 18 in Schema 4, worin R Allyl ist und Rp Benzoyl
ist) ersetzt wurde, und dass 3-Bromchinolin durch Iodbenzen ersetzt
wurde.
13C NMR (CDCl3) δ 217.1 (C-9),
205.3 (C-3), 169.5 (C-1), 157.4, 136.5, 133.7, 128.6, 127.8, 126.5,
125.4, 102.9, 83.4, 78.4, 77.7, 76.4, 70.3, 69.5, 65.9, 64.3, 58.2,
50.9, 46.3, 45.1, 40.2, 39.1, 37.3, 31.5, 28.3, 22.8, 21.2, 20.3,
18.1, 14.4, 14.2, 13.7, 10.8. MS (FAB)+ m/e 715 (M+H)+.
-
Beispiel 104
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH=CH-
(3-Chinolyl).
-
Die
gewünschte
Verbindung wurde hergestellt unter Anwendung des Verfahrens von
Beispiel 18, außer
dass die darin verwendete Verbindung aus Beispiel 1, Schritt f,
durch die in Beispiel 102, Schritt c, hergestellte Verbindung (d.
h. die Verbindung 18 in Schema 4, worin R Allyl ist und Rp Benzoyl ist) ersetzt wurde.
13C NMR (CDCl3) δ 217.4 (C-9),
205.3 (C-3), 164.6 (C-1), 157.7. 144.7, 147.6, 132.5. 129.9, 124.6,
129.2, 129.1, 128.6, 128.1, 126.7, 102.9, 83.5, 78.8, 77.5, 76.5,
70.2, 69.5, 65.9, 64.3, 58.2, 50.9, 46.3, 45.1, 40.2, 39.1, 37.4,
28.2, 22.6, 21.2, 20.2, 18.1, 14.4, 14.2, 13.7, 10.7. MS (FAB)+
m/e 766 (M+H)+.
-
Unter
Anwendung der Verfahren, die in den obigen Beispielen und Schemata
beschrieben sind, und Verfahren, die im Fachgebiet der synthetischen
organischen Chemie bekannt sind, können die folgenden Verbindungen
mit der Formel IX, worin L CO ist und T NH ist, hergestellt werden.
Diese Verbindungen, bei denen der R-Substituent wie in der Tabelle
unten beschrieben ist, haben die Formel
| Beispiel
Nr. | Substituent |
| 105 | R
ist -CH2CH2CH3 |
| 106 | R
ist -CH2CH2NH2 |
| 107 | R
ist -CH2CH=NOH |
| 108 | R
ist -CH2CH2CH2OH |
| 109 | R
ist -CH2F |
| 110 | R
ist -CH2CH2NHCH2-Phenyl |
| 111 | R
ist -CH2CH2NHCH2-(4-Pyridyl) |
| 112 | R
ist -CH2CH2NHCH2-(4-Chinolyl) |
| 113 | R
ist -CH2CH(OH)CN |
| 114 | R
ist -CH(C(O)OCH3) CH2-Phenyl |
| 115 | R
ist -CH2CN |
| 116 | R
ist -CH2CH=CH-(4-Chlorphenyl) |
| 117 | R
ist -CH2CH=CH-(4-Fhlorphenyl) |
| 118 | R
ist -CH2CH=CH-(4-Methoxyphenyl) |
| 119 | R
ist -CH2CH2CH2-(4-Ethoxyphenyl) |
| 120 | R
ist -CH2CH=CH-(3-Chinolyl) |
| 121 | R
ist -CH2CH2NHCH2CH2-(2-Chlorphenyl) |
| 122 | R
ist -CH2-Phenyl |
| 123 | R
ist -CH2-(4-Pyridyl) |
| 124 | R
ist -CH2-(4-Chinolyl) |
| 125 | R
ist -CH2CH=CH- (4-Pyridyl) |
| 126 | R
ist -CH2CH2CH2-(4-Pyridyl) |
| 127 | R
ist -CH2CH=CH-(4-Chinolyl) |
| 128 | R
ist -CH2CH2CH2-(4-Chinolyl) |
| 129 | R
ist -CH2CH=CH-(5-Chinolyl) |
| 130 | R
ist -CH2CH2CH2-(5-Chinolyl) |
| 131 | R
ist -CH2CH=CH-(4-Benzoxazolyl) |
| 132 | R
ist -CH2CH=CH-(4-Benzimidazolyl) |
| 133 | R
ist -CH2CH=CH-(8-Chinolyl) |
-
Beispiel 134
-
Verbindung mit der Formel
(VII): A, B, D und E sind H, R ist Allyl.
-
Schritt 134a: Verbindung
mit der Formel 14 (Schema 3a): A, B, D und E sind H, R ist Allyl,
Rp ist Benzoyl.
-
Zu
einer Lösung
unter Stickstoff aus einer Verbindung mit der Formel 12 (R ist Allyl,
Rp ist Benzoyl, 385 mg, 0, 485 mmol), hergestellt
wie in Beispiel 102, Schritt b, in Acetonitril, wurde Ethylendiamin
(291 mg, 4,85 mmol) hinzugegeben, und die Reaktionsmischung wurde
67 Stunden lang gerührt.
Die Reaktionsmischung wurde mit Ethylacetat extrahiert, und die
organische Phase wurde mit wässerigem
5%igem Natriumbicarbonat und Salzlösung gewaschen, über Natriumsulfat
getrocknet und in vacuo konzentriert, um die Titelverbindung (401
mg) als farbloses Öl
zu ergeben, das ohne weitere Reinigung verwendet wurde.
-
Schritt 134b: Verbindung
mit der Formel (VII): A, B, D und E sind H, R ist Allyl.
-
Das
in Schritt 134a hergestellte rohe Öl wurde in Methanol (5 ml)
aufgelöst,
Essigsäure
(60 μl)
wurde hinzugefügt,
und die Reaktionsmischung wurde 15 Stunden lang bei Raumtemperatur
gerührt.
Die Reaktionsmischung wurde mit Ethylacetat extrahiert, und die
organische Phase wurde mit wässerigem
5%igem Natriumbicarbonat und Salzlösung gewaschen, über Natriumsulfat
getrocknet und in vacuo konzentriert, um ein leicht gelbes Glas
(347 mg) zu ergeben. Chromatographie auf Silikagel (95:5:0,5 Dichlormethan-Methanol-Ammoniak)
ergab die Titelverbindung (126 mg) als weißen Schaum. MS m/e 664 (M+H)+.
-
Unter
Anwendung der Verfahren, die in den obigen Beispielen und Schemata
beschrieben sind, und Verfahren, die im Fachgebiet der synthetischen
organischen Chemie bekannt sind, können die folgenden Verbindungen
mit der Formel VII, worin A, B, D und E H sind, hergestellt werden.
Diese Verbindungen, bei denen der R-Substituent wie in der Tabelle
unten beschrieben ist, haben die Formel
| Beispiel
Nr. | Substituent |
| 135 | R
ist -CH2CH2CH3 |
| 136 | R
ist -CH2CH2NH2 |
| 137 | R
ist -CH2CH=NOH |
| 138 | R
ist -CH2CH2CH2OH |
| 139 | R
ist -CH2F |
| 140 | R
ist -CH2CN |
| 141 | R
ist -CH2CH(OH)CN |
| 142 | R
ist -CH2-Phenyl |
| 143 | R
ist -CH2-(4-Pyridyl) |
| 144 | R
ist -CH2-4-Chinolyl) |
| 145 | R
ist -CH2CH=CH-(4-Pyridyl) |
| 146 | R
ist -CH2CH=CH-(4-Chlorphenyl) |
| 147 | R
ist -CH2CH=CH-(4-Fluorphenyl) |
| 148 | R
ist -CH2CH=CH-(4-Methoxyphenyl) |
| 149 | R
ist -CH2CH2CH2-Phenyl |
| 150 | R
ist -CH2CH=CH-(4-Pyridyl) |
| 151 | R
ist -CH2CH2CH2-(4-Pyridyl) |
| 152 | R
ist -CH2CH=CH-(4-Chinolyl) |
| 153 | R
ist -CH2CH2CH2- (4-Chinolyl) |
| 154 | R
ist -CH2CH=CH-(5-Chinolyl) |
| 155 | R
ist -CH2CH2-CH2-(5-Chinolyl) |
| 156 | R
ist -CH2CH=CH-(4-Benzoxazolyl) |
| 157 | R
ist -CH2CH=CH-(4-Benzimidazolyl)) |
| 158 | R
ist -CH2CH=CH-(8-Chinolyl) |
| 159 | R
ist -CH2CH2NHCH2-Phenyl |
| 160 | R
ist -CH2CH2NHCH2-(4-Pyridyl) |
| 161 | R
ist -CH2CH2NHCH2-(4-Chinolyl) |
| 162 | R
ist -CH2CH2NHCH(CH2-Phenyl)C(O)OCH3 |
| 163 | R
ist -CH2CH2NHCH2CH2-(2-Chlorphenyl) |
-
Beispiel 164
-
Verbindung mit der Formel
(VII): A, B und E sind H, D ist Benzyl, R ist Allyl.
-
Schritt 164a: 2-(R)-(BOC-Amino)-3-phenyl-1-propanol.
-
Zu
einer 5,2 g (23,8 mmol)-Probe von Di-t-butyldicarbonat in 20 ml
Methylenchlorid, die bei 0°C
gehalten wurde, wurde (R)-2-Amino-3-phenyl-1-propanol
(3,0 g, 19,8 mmol, Aldrich) hinzugefügt, und die Reaktionsmischung
wurde 1,5 Stunden lang bei Raumtemperatur gerührt. Das Lösungsmittel wurde entfernt,
und der Rückstand
wurde unter hohem Vakuum getrocknet und direkt zum nächsten Schritt
geführt.
-
Schritt 164b: 2-(R)-(BOC-Amino)-1-O-methansulfonyloxy-3-phenylpropan.
-
Das
Material aus Schritt 164a wurde in 20 ml Methylenchlorid und 5 ml
THF aufgelöst,
und die Lösung wurde
auf 0°C
gekühlt.
Triethylamin (4,1 ml, 29,4 mmol) wurde hinzugefügt; dann wurde langsam Methansulfonylchlorid
(1,9 ml, 24,5 mmol) hinzugegeben. Die Mischung wurde 45 Minuten
lang bei Raumtemperatur gerührt;
dann wurde das Lösungsmittel
unter Vakuum entfernt. Der Rückstand
wurde in Ethylacetat aufgelöst, und
die Lösung
wurde mit Wasser und Salzlösung
gewaschen, getrocknet (Na2SO4)
und filtriert. Das Lösungsmittel
wurde unter Vakuum entfernt, um 6,38 g der Titelverbindung zu ergeben.
MS m/z (M+H)+: 330. MS m/z (M+NH4)+: 347.
-
Schritt 164c: 1-Azido-2-R–BOC-amino)-3-phenylopropan.
-
Die
Verbindung aus Schritt 164b oben (6,36 g, 193 mmol) wurde in 25
ml DMF aufgelöst,
und 2,5 g (38 mmol) NaN3 wurden hinzugefügt. Die
Reaktionsmischung wurde 24 Stunden lang bei 62° C gerührt. Die Lösung wurde auf Raumtemperatur
gekühlt,
dann mit Ethylacetat extrahiert. Der organische Extrakt wurde mit Wasser
und Salzlösung
gewaschen, getrocknet (Na2SO4)
und filtriert. Das Lösungsmittel
wurde unter Vakuum entfernt, um 4,34 g der Titelverbindung zu ergeben.
MS m/z (M+H)+: 277. MS m/z (M+NH4)+: 294.
-
Schritt 164d: 1-Azido-2-(R)-amino-3-phenylpropan.
-
Die
Verbindung aus Schritt 164c (4,3 g, 15,6 mmol) wurde in 30 ml 4
N HCl in Ethanol aufgelöst,
und die Reaktionsmischung wurde 1,5 Stunden lang bei Raumtemperatur
gerührt.
Das Lösungsmittel
wurde ausgetrieben und mit Ether verfolgt. Der Rückstand wurde in Wasser aufgelöst, NaCl
wurde hinzugefügt,
und die Mischung wurde mit Ethylether extrahiert, der verworfen
wurde. Die wässerige
Schicht wurde mit K2CO3 auf pH
12 eingestellt, mit NaCl gesättigt,
dann mit CHCl3 extrahiert. Der organische
Extrakt wurde mit Salzlösung gewaschen,
getrocknet (Na2SO4)
und filtriert. Das Lösungsmittel
wurde unter Vakuum entfernt, um 2,17 g der Titelverbindung zu ergeben.
MS m/z (M+H)+: 177. MS m/z (M+NH4)+: 194.
-
Schritt 164e: 1,2-(R)-Diamino-3-phenylpropan.
-
Eine
Probe der Verbindung aus Schritt 164d (1,2 g, 6,8mmol) wurde in
Ethanol über
1,2 g 10%igem Pd/C 21,5 Stunden lang bei Raumtemperatur hydriert
(4 atm). Die Mischung wurde filtriert, um den Katalysator zu entfernen,
und das Lösungsmittel
wurde entfernt, um die Titelverbindung (1,055 g) zu ergeben. MS
m/z (M+H)+: 151. MS m/z (M+NH4)+: 168.
-
Schritt 164f: Verbindung
14 aus Schema 3a: A, B und E sind H, D ist Benzol, R ist Allyl,
Rp ist Benzoyl.
-
Die
gewünschte
Verbindung wird hergestellt durch Rühren einer Lösung der
Verbindung, die hergestellt wurde wie in Beispiel 102, Schritt b,
(d. h. der Verbindung 12 aus Schema 3a, worin R Allyl ist, Rp Benzoyl ist) und 1,2-(R)-Diamino-3-phenylpropan, hergestellt
wie in Schritt 164e oben, in wässerigem
Acetonitril für
einen Zeitraum, der ausreicht, um praktisch das gesamte Ausgangsmaterial
zu verbrauchen.
-
Schritt 164g: Verbindung
14 aus Schema 3a: A, B und E sind H, D ist Benzyl, R ist Allyl,
Rp ist H.
-
Die
Titelverbindung wird hergestellt durch Entschützen der in Schritt 164f hergestellten
Verbindung durch Erhitzen in Methanol gemäß dem Verfahren von Beispiel
1, Schritt g.
-
Schritt 164h: Verbindung
mit der Formel (VII): A, B und E sind H, D ist Benzol, R ist Allyl.
-
Die
gewünschte
Verbindung wird hergestellt durch Erhitzen einer Lösung der
in Schritt 164g hergestellten Verbindung in Ethanol-Essigsäure.
-
Beispiel 165
-
Verbindung mit der Formel
(VII): A ist Benzol, B, D und E sind H, R ist Allyl.
-
Schritt 165a: Verbindung
16 aus Schema 3b: A ist Benzol, B, D und E sind H, Y ist OH, R ist
Allyl, Rp ist Benzoyl.
-
Die
gewünschte
Verbindung wird hergestellt gemäß dem Verfahren
von Beispiel 164, Schritt f, außer dass
1,2-(R)-Diamino-3-phenylpropan
durch (S)-2-Amino-3-phenyl-1-propanol (Aldrich Chemical Co.) ersetzt wird.
-
Schritt 165b: Verbindung
16 aus Schema 3b; A ist Benzyl, B, D und E sind H, Y ist N3, R ist Allyl, Rp ist
Benzoyl.
-
Die
gewünschte
Verbindung wird hergestellt durch Behandeln einer Lösung in
THF der Verbindung aus Schritt 165a mit Triphenylphosphin, Diethylazodicarboxylat
und Diphenylphosphorylazid.
-
Schritt 165c: Verbindung
16 aus Schema 3b: A ist Benzol, B, D und E sind H, Y ist N3, R ist Allyl, Rp ist
H.
-
Die
gewünschte
Verbindung wird hergestellt durch Entschützen der in Schritt 165b hergestellten
Verbindung durch Erhitzen in Methanol gemäß dem Verfahren von Beispiel
1, Schritt g.
-
Schritt 165d: Verbindung
17 aus Schema 3b; R ist Allyl.
-
Die
gewünschte
Verbindung wird hergestellt durch Erhitzen einer Lösung in
THF des Produkts aus Schritt 165d und Triphenylphosphin unter Rückfluss.
-
Schritt 165e: Verbindung
mit der Formel (VII): A ist Benzyl, B, D und E sind H, R ist Allyl.
-
Die
gewünschte
Verbindung wird hergestellt durch Erhitzen einer Lösung der
in Schritt 165d hergestellten Verbindung in Ethanol-Essigsäure.
-
Beispiel 166
-
Verbindung mit der Formel
(VII): A und E sind Phenol, B und D sind H, R ist Allyl.
-
Die
gewünschte
Verbindung wird hergestellt gemäß dem Verfahren
von Beispiel 164, Schritte f-h, außer dass 1,2-(R)- Diamino-3-phenylpropan
durch 1,2-Diphenyl-1,2-ethylendiamin (Aldrich Chemical Co.) ersetzt
wird.
-
Beispiel 167
-
Verbindung mit der Formel
(VII): A ist Methyl, B, D und E sind H, R ist Allyl.
-
Die
gewünschte
Verbindung wird hergestellt gemäß dem Verfahren
von Beispiel 165, außer
dass (S)-2-Amino-3-phenyl-1-propanol
durch (S)-2-Amino-1-propanol (Aldrich Chemical Co.) ersetzt wird.
-
Beispiel 168
-
Verbindung mit der Formel
(VII): A und D sind Methyl, B und E sind H, R ist Allyl.
-
Schritt 168a: Meso-2,3-bis(methansulfonyloxy)butan.
-
Proben
von Meso-2,3-butandiol (10 g, 111 mmol, Aldrich) und Triethylamin
(92,8 ml, 666 mmol) wurden in Methylenchlorid aufgelöst. Die
Lösung
wurde auf -78°C
gekühlt,
und Methansulfonylchlorid (25,8 ml, 333 mmol) wurde tropfenweise
hinzugefügt.
Es bildete sich ein Niederschlag. Die Mischung wurde mit zusätzlichem
Methylenchlorid verdünnt,
und die Mischung wurde 20 Minuten lang bei -78°C und 2 Stunden lang bei 0°C gerührt. Die
Reaktionsmischung wurde auf Raumtemperatur erwärmt, mit zusätzlichem
Lösungsmittel
verdünnt
und mit H2O, wässerigem NaHCO3 und
wässerigem
NaCl gewaschen. Die organische Lösung
wurde über
MgSO4 getrocknet, und das Lösungsmittel
wurde entfernt, um die Titelverbindung (25,01 g) zu liefern.
1H NMR (300 MHz, CDCl3): δ 4:91 (q,
2H), 3.10 (s, 6H), 1.45 (d, 6H).
-
Schritt 168b: Meso-2,3-diazidobutan.
-
Eine
Probe der Verbindung aus Schritt 168a (25 g) wurde in 250 ml DMF
aufgelöst,
und NaN3 (40 g) wurde hinzugefügt. Die
Mischung wurde bei 85°C
24 Stunden lang kräftig
gerührt
und dann auf Raumtemperatur abgekühlt. Die Mischung wurde mit
800 ml Ether verdünnt,
mit H2O, wässerigem NaHCO3 und
wässerigem
NaCl gewaschen, dann über
MgSO4 getrocknet. Die Lösung wurde filtriert und konzentriert,
um die Titelverbindung (13,00 g) zu ergeben.
1H
NMR (300 MHz, CDCl3): δ 3.50 (m, 2H), 1.30 (d, 6H).
-
Schritt 168c: Meso-2,3-butandiamin.
-
Eine
Probe der Verbindung aus Schritt 168b (13,0 g, 125mmol) wurde in
Ethanol aufgelöst
und 20 Stunden lang bei 4 atm und Raumtemperatur über 10%
Pd/C hydriert. Der Katalysator wurde durch Filtration entfernt,
und das Lösungsmittel
wurde unter Vakuum entfernt, um die Titelverbindung zu liefern.
1H NMR (300 MHz, CDCl3): δ 2.70 (m,
2H), 1.45 (br, 4H), 1.05 (d, 6H).
MS (m/z): 89 (M+H)+.
-
Schritt 168d: Verbindung
mit der Formel (VII): A und D sind Methyl, B und E sind H, R ist
Allyl.
-
Die
gewünschte
Verbindung wird hergestellt gemäß dem Verfahren
von Beispiel 164, Schritte c-h, außer dass Meso-2,3-butandiamin, hergestellt
wie in Schritt 168c, das 1,2-(R)-Diamino-3-phenylpropan
davon ersetzte.
-
Beispiel 169
-
Verbindung mit der Formel
(VII): A und E zusammengenommen sind -CH2CH2CH2-, B und D sind
H, R ist Allyl.
-
Die
gewünschte
Verbindung wird hergestellt gemäß dem Verfahren
von Beispiel 168, außer
dass Meso-2,3-butandiol durch 1,2-Cyclopentandiol (Aldrich Chemical
Co.) ersetzt wurde.
-
Beispiel 170
-
Verbindung mit der Formel
(VII): A, B, D und E sind H, R ist -CH2CH=CH-(3-Chinolyl).
-
Die
gewünschte
Verbindung wurde hergestellt durch Koppeln von 3-Bromchinolin mit
dem Produkt von Beispiel 134 gemäß dem Verfahren
von Beispiel 18. MS (FAB)+ m/e 791 (M+H)+.
-
Beispiel 171
-
Verbindung mit der Formel
(VII): A, B, D und E sind H, R ist -CH2CH2CH2-(3-Chinolyl).
-
Zu
einer Probe der Verbindung aus Beispiel 170 (110 mg) in Methanol
(10 ml), gespült
mit Stickstoff, wurde 10%iges Pd/C (50mg) gegeben, und die Mischung
wurde 16 Stunden lang bei Raumtemperatur unter 1 atm gerührt. Die
Mischung wurde filtriert und konzentriert, und der Rückstand
wurde durch Chromatographie auf Silikagel unter Eluierung mit 95:5:0,5
bis 90:10:0,5 Dichlormethan/Methanol/Dimethylamin gereinigt, um die
Titelverbindung (106 mg) zu ergeben.
High Res. MS m/e (M+H)+ Calcd for C44H64N4O9:
793.4752; Found 743.4766.
-
Beispiel 172
-
Verbindung mit der Formel
(VIII): X ist O, R ist CH2-(3-Iodphenyl)
-
Gemäß den Verfahren
von Beispiel 1, außer
dass das Allylbromid von Schritt 1f durch 3-Iodbenzylbromid ersetzt
wurde, wurde die Titelverbindung hergestellt. MS (FAB)+ m/e 949
(M+H)+.
-
Beispiel 173
-
Verbindung mit der Formel
(VIII): X ist O, R ist CH2-(2-Naphthyl)
-
Gemäß den Verfahren
von Beispiel 1, außer
dass das Allylbromid von Schritt 1a durch (2-Naphthyl)methylbromid
und das Benzoesäureanhydrid
in Schritt 1e durch Essigsäureanhydrid
ersetzt wurde, wurde die Titelverbindung hergestellt.
MS (FAB)+ m/e 714 (M+H)+;
Anal. Calcd. for C40H59NO10: C, 67.30; H. 8.33; N, 1.96; Found: C,
66.91; H, 8.29; N, 1.64.
-
Beispiel 174
-
Verbindung mit der Formel
(VIII): X ist O, R ist CH2-CH=CH-(4-Fluorphenyl)
-
Gemäß den Verfahren
von Beispiel 172, außer
dass das Iodbenzen von Schritt 14a durch 4-Fluor-1-iodbenzen ersetzt
wurde, wurde die Titelverbindung hergestellt.
-
Beispiel 175
-
Verbindung mit der Formel
(VIII): X ist O, R ist CH2-CH(OH)-CN
-
Die
Titelverbindung wurde gewonnen durch chromatographische Trennung
des Rohprodukts von Beispiel 8 aus der Reaktionsmischung. MS (FAB)+
m/e 643 (M+H)+.
-
Beispiel 176
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2-(2-Naphthyl)
-
Schritt 176a. Verbindung
6 aus Schema 1a; R ist -CH2-(2-Naphthyl).
-
Gemäß den Verfahren
von Beispiel 1, Schritte a-c, außer dass das Allylbromid von
Schritt 1a durch (2-Naphthyl) methylbromid ersetzt wurde, wurde
die Titelverbindung hergestellt. MS (FAB)+ m/e 874 (M+H)+.
-
Schritt 176b. Verbindung
6A aus Schema 1c; R ist -CH2-(2-Naphthyl), Rp ist
Acetyl
-
Die
Verbindung aus Schritt 176a (2,0 g) wurde gemäß dem Verfahren von Beispiel
1, Schritt e, behandelt, außer
dass das Benzoesäureanhydrid
dieses Beispiels durch Essigsäureanhydrid
ersetzt wurde. MS (FAB)+ m/e 958 (M+H)+.
-
Schritt 176c. Verbindung
6B aus Schema 1c; R ist -CH2-(2-Naphthyl), Rp ist Acetyl
-
Die
Verbindung aus Schritt 176b (500 mg) wurde gemäß dem Verfahren von Beispiel
102, Schritt b, mit NaH und Carbonyldiimidazol behandelt, um die
Titelverbindung (58 mg) zu ergeben. MS (FAB)+ m/e 1034 (M+H)+.
-
Schritt 176d. Verbindung
6C aus Schema 1c; R ist -CH2-(2-Naphthyl), Rp ist Acetyl, Rd ist
H
-
Die
Verbindung aus Schritt 176c (58 mg) wurde mit Ammoniak in Acetonitril
gemäß dem Verfahren
von Beispiel 102, Schritt c, behandelt, um die Titelverbindung zu
ergeben. MS (FAB)+ m/e 983 (M+H)+.
-
Schritt 176e Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-(2-Naphthyl).
-
Die
Verbindung aus Schritt 176d wurde gemäß den Verfahren von Beispiel
1, Schritte 1d, 1f und 1g, behandelt, um die Titelverbindung zu
ergeben. MS (FRB)+ m/e 739 (M+H)+.
-
Beispiel 177
-
Verbindung mit der Formel
(III): Rc ist Acetyl, L ist CO, T ist NH, R ist -CH2CH=CH2
-
Schritt 177a Verbindung
6A aus Schema 1c; R ist -CH2CH=CH2, Rp ist Acetyl
-
Zu
einer Probe der Verbindung aus Beispiel 1, Schritt c, (405,2 g,
528 mmol) in Dichlormethan (20 ml) wurden Dimethylaminopyridin (0,488
g, 4 mmol) und Essigsäureanhydrid
(3,39 ml, 36 mmol) gegeben, und die Mischung wurde 3 Stunden lang
bei Raumtemperatur gerührt.
Die Mischung wurde mit Methylenchlorid verdünnt, dann mit 5%igem wässerigen
Natriumbicarbonat und Salzlösung
gewaschen und über
Na2SO4 getrocknet.
Der Rückstand
wurde getrocknet und aus Acetonitril umkristallisiert, um die Titelverbindung
(491 g) zu ergeben. MS m/e 857 (M+H)+.
-
Schritt 177b Verbindung
6B aus Schema 1c; R ist -CH2CH=CH2, Rp ist Acetyl
-
Zu
einer Probe der Verbindung aus Schritt 177a (85,8 g, 100 mmol) in
trockenem THF (500 ml), gekühlt
auf -40°C
und mit Stickstoff gespült,
wurde über
einen Zeitraum von 20 Minuten Natrium-bis(trimethylsilyl)amid (125
ml, 125 mmol) gegeben, und die Mischung wurde bei -40°C 40 Minuten
lang gerührt.
Zu dieser Mischung wurde unter Stickstoff bei -40°C über einen
Zeitraum von 30 Minuten eine Lösung
aus Carbonyldiimidazol (3,65 g, 22,56mmol) in 5:3 THF/DMF (800 ml)
gegeben, und die Mischung wurde bei -20°C 30 Minuten lang gerührt. Die
Mischung wurde bei Raumtemperatur 27 Stunden lang gerührt und
dann mit Ethylacetat verdünnt.
Die Mischung wurde mit 5%igem Natriumbicarbonat und Salzlösung gewaschen, über Na2SO4 getrocknet und
konzentriert, um die Titelverbindung (124 g) zu ergeben, die direkt
zum nächsten
Schritt geführt
wurde.
-
Schritt 177c Verbindung
6C aus Schema 1c; R ist -CH2CH=CH2, Rp ist Acetyl,
Rd ist H
-
Die
Verbindung aus Schritt 177b (124 g) wurde in 9:1 Acetonitril/THF
(1100 ml) aufgelöst,
Ammoniumhydroxid (28%, 200ml) wurde hinzugefügt, und die Mischung wurde
bei Raumtemperatur unter Stickstoff 8 Tage lang gerührt. Das
Lösungsmittel
wurde entfernt, und der Rückstand
wurde in Ethylacetat aufgelöst.
Diese Lösung
wurde in 5%igem Natriumbicarbonat und Salzlösung gewaschen, über Na2SO4 getrocknet und
konzentriert, um die Titelverbindung zu ergeben. MS (FAB)+ m/e 882
(M+H)+.
-
Schritt 177d. Verbindung
6D aus Schema 1c: R ist -CH2CH=CH2, Rp ist Acetyl,
Rd ist H
-
Zu
einer Probe der Verbindung aus Schritt 177c (69,0 g, 78,2 mmol),
suspendiert in Ethanol (200 ml) und verdünnt mit Wasser (400 ml), wurde
tropfenweise über
einen Zeitraum von 20 Minuten HCl (0,972 N, 400 ml) gegeben. Die
Mischung wurde 4 Stunden lang gerührt, und zusätzliche
HCl wurde über
einen Zeitraum von 20 Minuten hinzugegeben (4 N, 100 ml). Die Mischung
wurde 18 Stunden lang gerührt,
auf 0°C
gekühlt,
dann wurde über
einen Zeitraum von 30 Minuten NaOH (4 N, 200 ml) bis ungefähr pH9 hinzugefügt. Die
Titelverbindung wurde durch Filtration isoliert (35,56 g).
-
Schritt 177e. Verbindung
6E aus Schema 1c: R ist -CH2CH=CH2, Rp ist Acetyl,
Rd ist H; (Verbindung mit der Formel (III):
Rc ist Acetyl, L ist CO, T ist NH, R ist -CH2CH=CH2)
-
Zu
einer -10°C-Lösung unter
Stickstoff von N-Chlorsuccinimid
(2,37 g, 17,8 mmol) in Dichlormethan (80 ml) wurde über einen
Zeitraum von 5 Minuten Dimethylsulfid (1,52 ml, 20,8 mmol) gegeben.
Die resultierende weiße
Aufschlämmung
wurde 10 Minuten lang bei -10°C
gerührt,
eine Lösung
der Verbindung aus Schritt 177d (8,10 g, 11,9 mmol) in Dichlormethan
(60 ml) wurde hinzugefügt,
und die Reaktionsmischung wurde 30 Minuten lang bei -10 bis -5°C gerührt. Triethylamin
(1,99 ml, 14,3 mmol) wurde tropfenweise über einen Zeitraum von 10 Minuten
hinzugefügt,
und die Reaktionsmischung wurde 1 Stunde lang bei 0°C gerührt. Die Reaktionsmischung
wurde mit Dichlormethan extrahiert. Die organische Phase wurde mit
wässerigem
5%igem Natriumbicarbonat und Salzlösung gewaschen, über Natriumsulfat
getrocknet und in vacuo konzentriert, um einen weißen Schaum
zu ergeben. Chromatographie auf Silikagel (unter Eluierung mit 50:50:0,5
Aceton/Hexane/Ammoniumhydroxid) ergab die Titelverbindung (8,27
g) als einen weißen
Schaum.
Anal. Calcd. for C35H56N,O11: C, 61.5:
H. 8.29; N. 4.11: Found: C. 62.35: H, 8.50: N. 4.28.
-
Beispiel 178
-
Alternative Herstellung
der Verbindung mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(3-Chinolyl)
-
Schritt 178a. (Verbindung
mit der Formel (III): Rc ist Acetyl, L ist CO, T ist NH, R ist -CH2CH=CH-(3-Chinolyl))
-
Eine
Mischung der Verbindung aus Beispiel 177 (46,36 g, 68,2 mmol), Palladium(II)acetat
(3,055 g, 13,6 mmol) und Tri-o-tolylphosphin
(8,268 g, 27,2 mmol) in Acetonitril (400 ml) wurde mit Stickstoff
gespült.
Zu dieser Lösung
wurden mit einer Spritze 3-Bromchinolin (18,45 ml, 136 mmol) und
Triethylamin (18, 92 ml, 13, 6 mmol) hinzugefügt. Die Reaktionsmischung wurde
1 Stunde lang bei 50°C
erhitzt und 4 Tage lang bei 90°C gerührt. Die
Reaktionsmischung wurde in Ethylacetat aufgenommen und mit wässerigem
5%igem Natriumbicarbonat und Salzlösung gewaschen, über Natriumsulfat
getrocknet, filtriert und in vacuo konzentriert. Chromatographie
auf Silikagel (unter Eluierung mit 50:50:0,5 Aceton/Hexane/Ammoniumhydroxid)
ergab die Titelverbindung (46,56 g) als einen weißen Schaum.
MS m/e 808 (M+H)+.
-
Schritt 178b: Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2CH=CH-(3-Chinolyl).
-
Das
Entschützen
einer Probe der in Schritt 178a hergestellten Verbindung (42,43
g) wurde erreicht durch Rühren über Nacht
in Methanol gemäß dem Verfahren
von Beispiel 1, Schritt g, um die Titelverbindung (32,95 g) zu ergeben.
MS m/e 766 (M+H)+.
-
Beispiel 179
-
Verbindung mit der Formel
(IX): L ist CO, T ist N(CH3), R ist -CH2CH=CH2
-
Schritt 179a: Verbindung
18 aus Schema 4; R* ist Methyl, R ist -CH2CH=CH2, Rp ist Benzoyl.
-
Eine
Probe der Verbindung aus Beispiel 102, Schritt 102b (Verbindung
(12) aus Schema 3a; R ist -CH2CH=CH2, Rp ist Benzoyl,
320 mg, 0,400 mmol) wurde in Acetonitril (10 ml) aufgelöst, und
die Lösung
wurde mit Stickstoff gespült.
Wässeriges
Methylamin (40%, 0,344 ml) wurde hinzugefügt, und die Reaktionsmischung
wurde unter Stickstoff 4 Tage lang gerührt. Die Reaktionsmischung
wurde mit Ethylacetat extrahiert, und die organische Phase wurde
mit wässerigem
5%igem Natriumbicarbonat und Salzlösung gewaschen, über Natriumsulfat
getrocknet und in vacuo konzentriert, um einen weißen Schaum
zu ergeben. Chromatographie auf Silikagel (30% Aceton-Hexane) ergab
die Titelverbindung (277 mg) als einen weißen Feststoff.
MS m/e
757 (M+H)+.
-
Schritt 179b Verbindung
mit der Formel (IX): L ist CO, T ist N (CH3),
R ist -CH2CH=CH2
-
Das
Entschützen
einer Probe der in Schritt 179a hergestellten Verbindung (110 mg)
wurde durchgeführt
durch Rühren über Nacht
in Methanol gemäß dem Verfahren
von Beispiel 1, Schritt g, um das Titelprodukt (48 mg) zu ergeben.
Anal.
Calcd. for C34H56N2O10: C, 62.56; H,
8.65; N, 4.29; Found: C, 62.23: N, 8.72: N. 4.13.
-
Beispiel 180
-
Verbindung mit der Formel
(IX): L ist CO, T ist N(CH3), R ist -CH2CH=CH-(3-Chinolyl)
-
Gemäß dem Verfahren
von Beispiel 178, außer
dass die Verbindung in Beispiel 179, Schritt a, die Ausgangsmaterial-Verbindung darin
(aus Beispiel 177) ersetzte, wurde die Titelverbindung hergestellt.
-
Beispiel 181
-
Verbindung mit der Formel
(IX): L ist CO, T ist N (CH2CH2N(CH3)2), R ist -CH2CH=CH2
-
Schritt 181a. Verbindung
18 aus Schema 4; R* ist 2-(Dimethylamino)ethyl,
R ist -CH2CH=CH2,
Rp ist Benzoyl.
-
Gemäß den Verfahren
von Beispiel 179, außer
dass N,N-Dimethylethylendiamin
das Methylamin davon ersetzte, wurde die Titelverbindung hergestellt
(285 mg). MS m/e 814 (M+H)+.
-
Schritt 181a. Verbindung
mit der Formel (IX): L ist CO, T ist N(CH2CH2N(CH3)2),
R ist -CH2CH=CH2
-
Das
Entschützen
einer Probe der in Schritt 181a hergestellten Verbindung (110 mg)
wurde durchgeführt
durch Erhitzen über
Nacht in Methanol gemäß dem Verfahren
von Beispiel 1, Schritt g, um das Titelprodukt (28 mg) zu ergeben.
-
Beispiel 182
-
Verbindung mit der Formel
(IX): L ist CO, T ist N (CH2CH2N(CH3)2), R ist -CH2CH=CH-(3-Chinolyl)
-
Gemäß den Verfahren
von Beispiel 178, außer
dass die Verbindung von Beispiel 181, Schritt a, (162 mg) die Ausgangsmaterial-Verbindung
darin (aus Beispiel 177) ersetzte, wurde die Titelverbindung hergestellt (33,4
mg).
-
Beispiel 183
-
Verbindung mit der Formel
(IX): L ist CO, T ist N(CH2CH=CH2), R ist -CH2CH=CH2
-
Schritt 183a. Verbindung
18 aus Schema 4; R* ist -CH2CH=CH2, R ist -CH2CH=CH2, Rp ist Benzoyl.
-
Gemäß den Verfahren
von Beispiel 179, außer
dass Allylamin das Methylamin davon ersetzte, wurde die Titelverbindung
hergestellt.
-
Schritt 183b. Verbindung
mit der Formel (IX): L ist CO, T ist N (CH2CH=CH2), R ist -CH2CH=CH2
-
Das
Entschützen
einer Probe der in Schritt 183a hergestellten Verbindung (78 mg)
wurde durchgeführt durch
Erhitzen über
Nacht in Methanol gemäß dem Verfahren
von Beispiel 1, Schritt g, um das Titelprodukt zu ergeben (33 mg).
-
Beispiel 184
-
Verbindung mit der Formel
(IX): L ist CO, T ist N(CH2CH=CH-(3-Chinolyl)), R ist
-CH2CH=CH-(3-Chinolyl)
-
Gemäß den Verfahren
von Beispiel 178, außer
dass die Verbindung in Beispiel 183, Schritt a, die Ausgangsmaterial-Verbindung darin
(aus Beispiel 177) ersetzte, wurde die Titelverbindung hergestellt.
H.
Res. M.S. Calcd. for C54H69N4O10: 933.5014; Found
933.5052.
-
Beispiele 185-219
-
Gemäß den Verfahren
von Beispiel 178, außer
dass das 3-Bromchinolin
von Beispiel 178 durch das unten stehende Reagens ersetzt wurde,
wurden die Verbindungen 185-219, die in der Tabelle unten aufgelistet sind,
hergestellt. Diese Verbindungen mit der Formel IX, worin L CO ist
und T O ist und bei denen der R-Substituent wie in der Tabelle unten
beschrieben ist, haben die Formel
Beispiele
185-219
-
Beispiel 220
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2C(O)H
-
Die
Verbindung aus Beispiel 102 (14,0 g) wurde in CH2Cl2 (200 ml) aufgelöst, und die Lösung wurde unter
einer Stickstoffatmosphäre
auf -78°C
gekühlt.
Ozon wurde dann durch die Lösung
hindurchsprudeln gelassen, bis eine blaue Farbe bestehen blieb.
Die Reaktion wurde dann mit N2 gespült, bis
sie farblos war, und Dimethylsulfid (14 ml) wurde hinzugefügt, und
die Reaktionsmischung wurde auf 0°C
erwärmt.
Nach 90-minütigem
Rühren
wurde die Reaktionsmischung unter reduziertem Druck konzentriert,
um einen hellgelben Schaum zu ergeben. Dieses Material wurde in
THF (300 ml) aufgelöst
und unter Rückfluss
6 Stunden lang mit Triphenylphosphin (8 g) behandelt, dann wurde
die Reaktionsmischung unter vermindertem Druck konzentriert. Chromatographie
(1:1 Aceton/Hexane bis 3:1 Aceton/Hexane mit 0,5% TEA) ergab das
Produkt (6,6 g) als einen gebrochen weißen Schaum. MS(CI) m/e 641
(M+H)+.
-
Beispiel 221
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH2NHCH2-Phenyl
-
Die
Verbindung aus Beispiel 220 (120 mg, 0,187 mmol) und Benzylamin
(40 μl,
0,366 mmol, 2 Äquiv.) wurden
in 3 ml trockenem Dichlormethan aufgelöst. Molekülsiebe (4Å) wurden hinzugefügt, und
die Reaktion wurde über
Nacht gerührt.
Die Reaktion wurde dann filtriert und unter vermindertem Druck konzentriert.
Das resultierende Imin wurde in MeOH (5 ml) aufgelöst, eine
katalytische Menge von 10%igem Pd auf Kohlenstoff wurde hinzugefügt, und
die Reaktion wurde unter 1 atm H2-Druck
20 Stunden lang schnell gerührt.
Die Mischung wurde dann durch ein Celitkissen filtriert und die
Lösung
unter vermindertem Druck konzentriert: Chromatographie (SiO2, 5% MeOH/Dichlormethan mit 0,2% NH4OH) ergab das gewünschte Material (84 mg) als einen
weißen
Feststoff.
13C NMR (CDCl3) δ 218.3, 205.6,
170.3, 157.9, 140.2, 128.2, 126.8, 102.4, 83.5, 78.2, 76.9, 75.1,
70.1, 69.5, 65.9, 62.0, 58.4, 53.8, 50.6, 48.2, 45.3, 44.8, 40.1,
39.0, 37.4, 28.2, 22.4, 21.2, 20.6, 18.3, 14.6, 13.6, 13.5, 12.7,
10.3. MS(CI) m/e 732 (M+H)+.
-
Beispiel 222
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH2NHCH2CH2-Phenyl
-
Die
Titelverbindung wurde hergestellt aus der Verbindung in Beispiel
220 (108 mg, 0,169 mmol) und Phenethylamin (42 μl, 0,334 mmol, 2 Äquiv.) unter
Anwendung des für
Beispiel 221 beschriebenen Verfahrens. Chromatographie (SiO2, 5% MeOH/Dichlormethan mit 0,5% NH4OH ergab das gewünschte Material (82 mg) als
einen weißen
Feststoff.
13C NMR (CDCl3) δ 218.1, 205.5,
170.3, 158.0, 140.2, 128.8, 128.2. 12.8, 102.4, 83.6, 78.3, 76.9,
75.1, 70.1, 64.5, 65.9, 61.9, 58.3, 51.5, 50.6, 48.8, 45.2, 44.4,
40.1, 38.9, 37.4, 36.5, 28.2, 22.4, 21.2, 20.6, 18.3, 14.6, 13.6,
13.4, 12.8, 10.3. MS(CI) m/e 746 (M+H)+.
Anal Calcd for C40H63N3O10. Found C 64.26,
H 8.47, N 5.43.
-
Beispiel 223
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH2NHCH2CH2CH2-Phenyl
-
Die
Titelverbindung wurde hergestellt aus der Verbindung in Beispiel
220 (100 mg, 0,156 mmol) und 3-Phenyl-1-propylamin (40 μl, 0,282
mmol, 1,8 Äquiv.)
unter Anwendung des für
Beispiel 221 beschriebenen Verfahrens. Chromatographie (SiO2, 5% MeOH/Dichlormethan mit 0,5% NH4OH) ergab das gewünschte Material (45 mg) als
einen weißen
Feststoff.
13C NMR (CDCl3) δ 218.6, 205.7,
170.4, 158.1, 142.3, 128.4, 128.2, 125.6, 102.4, 83.7, 78.3, 77.0,
75.2, 70.2, 69.5, 65.9, 62.0, 58.4, 50.6, 49.2, 49.0. 45.3, 44.9,
40.2, 39.0, 37.5, 33.7, 31.7, 28.2, 22.4, 21.2, 20.7, 18.3, 14.6,
13.6, 13.5, 12.8, 10.3. MS(CI) m/e 760 (M+H)+.
Anal Calcd for C41H65N3O10.
-
Beispiel 224
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH2NHCH2CH2CH2CH2-Phenyl
-
Die
Titelverbindung wurde hergestellt aus der Verbindung in Beispiel
220 (170 mg, 0,266 mmol) und 4-Phenyl-1-butylamin (68 μl, 0,431
mmol, 1,6 Äquiv.)
unter Anwendung des für
Beispiel 221 beschriebenen Verfahrens. Chromatographie (SiO2, 5% MeOH/Dichlormethan mit 0,2% NH4OH) ergab das gewünschte Material (87 mg) als
einen weißen
Feststoff.
13CNMR(CDCl3) δ 218.6, 205.6,
170.4, 158.1, 142.6, 128.4, 128.1, 125.5, 102.4, 83.7, 78.3, 77.0,
75.2, 70.2, 69.5, 65.9, 61.9, 58.4, 50.6, 50.0, 49.0, 45.3, 44.9,
40.2, 39.0, 37.5, 35.8, 29.7, 29.1, 28.2, 22.4, 21.2, 20.7, 18.3,
14.6, 13.6, 13.5, 12.7, 10.3. MS(CI) m/e 774 (M+H)+.
Anal Calcd for C42H67N3O10. Found C 64.80,
H 8.63, N 5.35.
-
Beispiel 225
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH2NHCH2CH2CH2-(3-Chinolyl)
-
Die
Verbindung aus Beispiel 220 (135 mg, 0,211 mmol) und 3-(3-Chinolyl)-1-propylamin
(70 mg, 0,376 mmol, 1,8 Äquiv.)
wurden in 4 ml trockenem Dichlormethan aufgelöst. Molekülsiebe (4Å) wurden hinzugefügt, und
die Reaktion wurde über
Nacht gerührt.
Die Reaktion wurde dann filtriert und unter vermindertem Druck konzentriert.
Das resultierende Imin wurde in MeOH (5 ml) aufgelöst und mit
NaCNBH3 (ungefähr 100 mg) und ausreichend
AcOH behandelt, um einen Bromcresolgrün-Indikator von blau in gelb
umzuwandeln. Nach 4-stündigem
Rühren
wurde die Reaktionsmischung in gesättigte NaHCO3-Lösung gegossen
und in Dichlormethan extrahiert. Der organische Anteil wurde mit
gesättigtem
NaHCO3, H2O und
Salzlösung
gewaschen, getrocknet (Na2SO4)
und unter vermindertem Druck konzentriert. Chromatographie (SiO2, 5% MeOH/Dichlormethan mit 0,5% NH4OH bis 10% MeOH/Dichlormethan mit 1% NH4OH) ergab das gewünschte Material (71 mg) als
einen weißen
Feststoff.
13C NMR (CDCl3) δ 218.8, 205.7,
170.5, 158.2. 152.2, 146.8, 135.0, 134.2, 129.1, 128.4, 128.2. 17.4,
126.4, 102.5, 83.8, 78.4, 77.2, 75.2, 70.2, 69.6, 65.9, 62.0. 58.4,
50.7, 49.5, 44.1, 45.4, 44.9, 40.2, 34.1, 37.6, 31.4, 30.9, 28.3.
22.6, 21.3, 20.7, 18.3, 14.7, 13.6, 13.5, 12.8, 10.3. MS(CI) m/e
811 (M+H)+. Anal Calcd for C44H66N4O10.
Found C 65.50, H 8.51, N 6.66.
-
Beispiel 226
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH2NHCH2 (3-Chinolyl)
-
Die
Titelverbindung wurde hergestellt aus der Verbindung in Beispiel
220 (150 mg, 0,234 mmol) und 3-(Aminomethyl)chinolin (100 mg, 0,633
mmol, 2,7 Äquiv.)
unter Anwendung des für
Beispiel 225 beschriebenen Verfahrens. Chromatographie (SiO2, 5% MeOH/Dichlormethan mit 0,5% NH4OH) ergab das gewünschte Material (82 mg) als
einen weißen
Feststoff.
13C NMR (CDCl3) δ 218.8, 205.5,
170.4, 158.1, 151.6, 147.3, 134.5, 133.0, 129.0, 128.7, 128.0, 127.6,
126.3, 102.4, 83.7, 78.3, 76.9, 75.1, 70.1, 69.4, 65.8, 61.8, 58.4,
51.3, 50.5, 48.5, 45.3, 44.8, 40.1, 39.0, 37.4, 28.2, 22.3, 21.2,
20.6, 18.2. 14.6, 13.6, 13.4, 12.7, 10.2. MS(CI) m/e 783 (M+H)+. Anal Calcd for C42H66N4O10.
Found C 64.32, H 8.01, N 7.11.
-
Das
3-(Aminomethyl)chinolin-Reagens wurde hergestellt wie folgt:
-
Schritt 226a. 3-(Hydroxymethyl)chinolin
-
Chinolin-3-carboxaldehyd
(1,0 g, 6,37 mmol) wurde in 20ml EtOH aufgelöst und mit NaBH4 (70
mg) behandelt. Nach einstündigem
Rühren
wurde die Lösung
mit 2 ml 1N HCl behandelt, und nach 10-minütigem Rühren wurde
die Reaktionsmischung mit ausreichend 1N NaOH behandelt, um die
Lösung
basisch zu machen. Die Reaktionsmischung wurde mit Et2O
extrahiert, und der organische Anteil wurde mit H2O
und Salzlösung
gewaschen. Der organische Anteil wurde über Na2SO4 getrocknet und unter vermindertem Druck
konzentriert, um die Titelverbindung zu ergeben. MS(CI) m/e 160
(M+H)+.
-
Schritt 226b. 3-(Azidomethyl)chinolin
-
3-(Hydroxymethyl)chinolin
(0,36 g, 2,26 mmol) und Triphenylphosphin (621 mg, 2,37 mmol, 1,05 Äquiv.) wurden
in 10ml trockenem THF aufgelöst,
gefolgt von Abkühlen
auf 0°C.
Die Reaktionsmischung wurde mit Diphenylphosphorylazid (570 μl, 2,63mmol,
1,16 Äquiv.)
behandelt, gefolgt vom tropfenweisen Hinzufügen von Diethylazodicarboxylat
(405 μl,
2,57 mmol, 1,14 Äquiv.).
Die Reaktionsmischung wurde über
Nacht auf Raumtemperatur erwärmen
gelassen. Sie wurde dann unter vermindertem Druck konzentriert.
Chromatographie (SiO2, 2:1 Hexane/EtOAc)
ergab das gewünschte
Material (350 mg) als ein farbloses Öl. MS(CI) m/e 185 (M+H)+.
-
Schritt 226c. 3-(Aminomethyl)chinolin
-
3-(Azidomethyl)chinolin
(250 mg, 1,36 mmol) und Triphenylphosphin (880 mg, 3,36 mmol, 2,5 Äquiv.) wurden
in 10ml THF aufgelöst.
Die Reaktionsmischung wurde mit 0,5 ml H2O
behandelt und unter Rückfluss 6
Stunden lang erhitzt. Die Reaktionsmischung wurde gekühlt und
zwischen Et2O und 1N HCl aufgeteilt. Der wässerige
Anteil wurde dann mit 1N NaOH behandelt, bis er basisch war, und
in EtOAc extrahiert. Der organische Anteil wurde über Na2SO4 getrocknet und
unter vermindertem Druck konzentriert, um die Titelverbindung (104
mg) als braunes Öl
zu ergeben. MS(CI) m/e 159 (M+H)+.
-
Beispiel 227
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH2NHCH2 (6-Chinolyl)
-
Die
Titelverbindung wurde hergestellt aus der Verbindung in Beispiel
220 (116 mg, 0,181 mmol) und 3-(Aminomethyl)chinolin (40 mg, 0,25
mmol, 1,4 Äquiv.)
unter Anwendung des Verfahrens, das für Beispiel 221 beschrieben
ist. Chromatographie (SiO2, 5% MeOH/Dichlormethan
mit 0,5% NH4OH) ergab das gewünschte Material
(62 mg) als einen weißen
Feststoff.
13C NMR (CDCl3) δ 218.7, 205.6,
170.4, 158.1, 149.8, 147.8, 138.9, 136.0, 130.3, 129.4, 128.3, 126.2,
121.0, 102.5, 83.7, 78.4, 77.0, 75.2, 70.2, 69.5, 65.9, 62.1, 58.5,
53.7, 50.6, 48.6, 45.4, 44.9, 40.2, 39.1, 37.5, 28.3, 22.4, 21.3,
20.7, 18.3, 14.7, 13.7, 13.5, 12.8, 10.3. MS(CI) m/e 783 (M+H)+. Anal Calcd for C42H62N4O10
-
Das
6-(Aminomethyl)chinolin-Reagens wurde hergestellt wie folgt:
-
Schritt 227a. 6-(Hydroxymethyl)chinolin
-
Chinolin-6-carbonsäure (1,73
g, 10,0 mmol) wurde in 40 ml THF unter N2 bei
0°C suspendiert
und mit N-Ethyl-Morpholin (1,3ml, 10,2 mmol, 1,02 Äquiv.) behandelt,
gefolgt vom tropfenweisen Hinzufügen
von Ethylchlorformiat (1,1 ml, 11,5mmol, 1,15 Äquiv.). Nach 15-minütigem Rühren wurde
die Lösung
filtriert, und die resultierenden Salze wurden mit zusätzlichem
THF gespült.
Das Filtrat wurde dann zu einer schnell gerührten Lösung aus NaBH4 (760
mg, 20 mmol) in H2O (50ml) gegeben. Nach
20-minütigem
Rühren
wurde die Reaktionsmischung mit gesättigter NH4Cl-Lösung gekühlt und
mit EtOAc (2 × 50
ml) extrahiert. Der organische Anteil wurde mit Salzlösung gewaschen, über Na2SO4 getrocknet und
unter vermindertem Druck konzentriert. Chromatographie (SiO2, 1:3 Hexane/EtOAc) ergab das gewünschte Material
(1,03 g) als farbloses Öl.
MS(CI) m/e 160 (M+H)+.
-
Schritt 227b. 6-(Azidomethyl)chinolin
-
6-(Hydroxymethyl)chinolin
(0,51 g, 3,21 mmol) und Triphenylphosphin (880 mg, 3,36 mmol, 1,05 Äquiv.) wurden
in 15ml trockenem THF aufgelöst,
gefolgt von Kühlen
auf 0°C.
Die Reaktionsmischung wurde mit Diphenylphosphorylazid (0,81 ml,
3,74 mmol, 1,16 Äquiv.)
behandelt, gefolgt vom tropfenweisen Hinzufügen von Diethylazodicarboxylat
(0,57 ml, 3,62 mmol, 1,13 Äquiv.).
Die Reaktionsmischung wurde über
Nacht auf Raumtemperatur erwärmen
gelassen und dann unter vermindertem Druck konzentriert. Chromatographie (SiO2, 30% EtOAc/Hexane) ergab das gewünschte Material
(320 mg) als ein farbloses Öl.
MS (CI) m/e 185 (M+H)+.
-
Schritt 227c. 6-(Aminomethyl)chinolin
-
6-(Azidomethyl)chinolin
(320 mg) und Triphenylphosphin (880 mg) wurden in 7 ml THF aufgelöst. Die Reaktionsmischung
wurde mit 0,5 ml H2O behandelt und 7 Stunden
lang unter Rückfluss
erhitzt. Die Reaktionsmischung wurde gekühlt und zwischen Et2O und 1N HCl aufgeteilt. Der wässerige
Anteil wurde dann mit 1N NaOH behandelt, bis er basisch war, und
in EtOAc extrahiert. Der organische Anteil wurde über Na2SO4 getrocknet und
unter vermindertem Druck konzentriert, um die Titelverbindung (70
mg) als ein braunes Öl
zu ergeben. MS(CI) m/e 159 (M+H)+.
-
Beispiel 228
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH=NO(Phenyl)
-
Die
Verbindung aus Beispiel 220 (200 mg, 0,313 mmol) und O-Phenylhydroxylamin-HCl
(138 mg, 0,948 mmol, 3,0 Äquiv.)
wurden in 4 ml MeOH aufgelöst.
Triethylamin (118 μl,
0,847 mmol, 2,7 Äquiv.)
wurde hinzugefügt,
und die Reaktion wurde unter Rückfluss
3 Stunden lang gerührt.
Die Reaktion wurde gekühlt
und mit gesättigter
NaHCO3-Lösung
gelöscht.
Die Reaktionsmischung wurde mit Dichlormethan (2 × 25 ml)
extrahiert, und die kombinierten organischen Anteile wurden mit
H2O und Salzlösung gewaschen. Der organische Anteil
wurde über
Na2SO4 getrocknet
und unter vermindertem Druck konzentriert. Chromatographie (SiO2, 5% MeOH/Dichlormethan mit 0,2% NH4OH) ergab das gewünschte Material (150 mg, 3:2
Mischung aus Oximisomeren) als einen violetten Feststoff.
13C NMR (CDCl3) δ 218.1, 217.4,
205.0, 169.9, 169.8, 159.1, 159.1, 157.9, 157.6, 152.9, 150.8, 129.1,
129.0, 122.2, 122.1, 114.8, 114.6, 103.2, 103.1, 83.5, 83.4, 79.8,
79.6, 77.1, 77.0, 76.9, 70.2, 69.6, 65.8, 60.3, 58.1, 58.0, 58.0,
50.9, 50.9, 46.6, 46.6, 44.8, 44.7, 40.1, 38.7, 38.5, 37.4, 37.4,
28.2, 22.2, 22.1. 21.1, 21.1, 20.5, 20.1, 18.0, 17.9, 14.6, 14.5,
14.5, 14.4, 13.5, 13.5, 10.4, 10.2. MS(CI) m/e 732 (M+H)+. Anal Calcd for C38H57N3O11.
Found C 62.30, H 7.76, N 5.74.
-
Beispiel 229
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH=NOCH2 (Phenyl)
-
Die
Titelverbindung wurde hergestellt aus der Verbindung in Beispiel
220 (201 mg, 0,314 mmol) und O-Benzylhydroxylamin·HCl (150
mg, 0,940 mmol, 3,0 Äquiv.)
unter Anwendung des für
Beispiel 228 beschriebenen Verfahrens. Chromatographie (SiO2, 5% MeOH/Dichlormethan mit 0,2% NH4OH) ergab das gewünschte Material (170 mg, 2:1
Mischung aus Oximisomeren) als einen weißen Feststoff.
13C NMR (CDCl3) δ 218.1, 217.2,
205.1, 170.0. 169.8, 158.0, 157.9, 150.5, 147.8, 138.1, 137.8, 128.4,
128.0, 127.8, 103.3, 103.3, 83.7, 83.7, 79.6, 79.5, 77.5, 77.3,
77.0, 76.9. 76.1, 76.0, 70.4, 69.7, 66.0, 60.5, 58.2, 58.1, 58.0.
51.0, 51.0, 46.8, 46.5, 45.0, 44.9, 40.3, 38.9, 38.7, 37.6. 28.4,
22.5, 22.4, 21.3, 20.6, 20.2, 18.2, 18.1. 14.8, 14.7, 14.6, 14.4,
13.7, 13.7, 10.6, 10.5. MS(CI) m/e 746 (M+H)+.
Anal Calcd for C39H59N3O11. Found C 62.89
H 8.04, N 5.42
-
Beispiel 230
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH=NOCH2 (4-NO2-Phenyl)
-
Die
Titelverbindung wurde hergestellt aus der Verbindung in Beispiel
220 (200 mg, 0,313 mmol) und O-(4-Nitrobenzyl) hydroxylamin-HCl·(192 mg,
0,938 mmol, 3,0 Äquiv.)
unter Anwendung des für
Beispiel 228 beschriebenen Verfahrens. Chromatographie (SiO2, 5% MeOH/Dichlormethan mit 0,2% NH4OH) ergab das gewünschte Material (184 mg, 2:1
Mischung aus Oximisomeren) als einen weißen Feststoff.
13C NMR (CDCl3) δ 218.2, 217.3,
205.0, 169.9, 169.7, 157.8, 151.2, 148.7, 147.4, 145.7, 145.5, 128.4,
128.1, 123.6, 123.5, 103.2, 83.6, 83.5, 79.6, 79.4, 77.1, 76.9,
76.8, 74.5, 74.3, 70.2, 69.6, 65.8, 60.2, 58.0, 57.9, 57.8, 51.0,
50.9, 46.8, 46.6, 44.9, 44.7, 40.2, 38.7, 38.5, 37.5, 37.4, 28.2,
22.4, 22.2, 21.2, 21.2, 20.5, 20.1, 18.1, 17.9, 14.8, 14.5, 14.4.
13.5 10.5, 10.3. MS(CI) m/e 791 (M+H)+.
-
Beispiel 231
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH=NOCH2(4-Chinolyl)
-
Die
Verbindung aus Beispiel 220 (200 mg, 0,313 mmol) und O-(4-Chinolyl)methylhydroxylamin
(200 mg, 0,86 mmol, 2,7 Äquiv.)
wurden in 4 ml MeOH aufgelöst.
Katalytisches pTSA-H2O wurde hinzugefügt, und die
Reaktion wurde unter Rückfluss
2 Stunden lang gerührt.
Die Reaktion wurde gekühlt
und mit gesättigter NaHCO3-Lösung
gelöscht.
Die Reaktionsmischung wurde mit Dichlormethan (2 × 25 ml)
extrahiert, und die kombinierten organischen Anteile wurden mit
H2O und Salzlösung gewaschen. Der organische
Anteil wurde über
Na2SO4 getrocknet
und unter vermindertem Druck konzentriert. Chromatographie (SiO2, 5% MeOH/Dichlormethan mit 0,2% NH4OH) ergab das gewünschte Material (226 mg, 2:1
Mischung aus Oximisomeren) als einen weißen Feststoff.
13C NMR (CDCl3) δ 218.1, 217.3.
205.0, 205.0, 170.0, 169.8, 158.0, 157.9, 151.3. 150.3, 148.7, 148.0,
143.2, 143.3. 130.1, 130.0, 129.1, 129.1, 126.7, 126.2, 126.2, 123.4,
123.3, 119.9, 119.6, 103.2. 83.7, 83.6, 79.7, 79.5, 77.4, 77.2,
77.1, 77.0, 76.9, 73.6, 72.3, 70.3, 69.6, 65.8, 60.3, 58.1, 58.0,
57.9, 51.0, 50.9, 46.8, 46.6, 44.9, 44.8. 40.2. 38.8, 38.5, 37.5,
37.5, 28.2, 22.4, 22.2, 21.3, 21.2, 20.5, 20.2, 18.1, 18.0, 14.9,
14.6, 14.5, 13.6, 13.6, 10.6, 10.3. MS(CI) m/e 797 (M+H)+. Anal Calcd for C42H60N4O11.
Found C 63.46, H 7.80. N 6.87.
-
Das
O-(4-Chinolyl)methylhydroxylamin-Reagens wurde hergestellt wie folgt:
-
Schritt 231a. N-(4-Chinolyl)methoxyphthalimid
-
4-(Hydroxymethyl)chinolin
(1,20 g, 7,55 mmol), Triphenylphosphin (2,27 g, 8,66 mmol, 1,15 Äquiv.) und
N-Hydroxyphthalimid
(1,42 g, 8,71 mmol, 1,15 Äquiv.)
wurden in 40ml trockenem THF aufgelöst. Diethylazodicarboxylat
(1,44 ml, 9,15 mmol, 1,21 Äquiv.)
wurde dann tropfenweise hinzugefügt,
und die Reaktion wurde über
Nacht gerührt.
Die Reaktionsmischung wurde dann mit 50 ml Et2O
verdünnt
und filtriert. Der resultierende Feststoff wurde in Dichlormethan
aufgelöst
und mit 1N NaOH, H2O und Salzlösung gewaschen.
Der organische Anteil wurde über
Na2SO4 getrocknet
und unter vermindertem Druck konzentriert, um die Titelverbindung
(2,03 g) als lockeren weißen
Feststoff zu ergeben. MS(CI) m/e 305 (M+H)+.
-
Schritt 231b. O-(4-Chinolyl)methylhydroxylamin
-
N-(4-Chinolyl)methoxyphthalimid
(2,00 g) wurde in 95% EtOH suspendiert, und Hydrazin (0,30 ml) wurde
hinzugefügt.
Die Reaktionsmischung wurde 3 Stunden lang gerührt und dann filtriert. Das
Filtrat wurde unter vermindertem Druck konzentriert und dann in
einer geringen Menge Dichlormethan aufgenommen. Die geringe Menge
an restlichem Phthalhydrazid wurde dann durch Filtration entfernt.
Das Filtrat wurde unter vermindertem Druck konzentriert, um die
Titelverbindung (1,44 g) als gelbes Öl zu ergeben. MS(CI) m/e 175 (M+H)+.
-
Beispiel 232
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH=NOCH2 (2-Chinolyl)
-
Die
Titelverbindung wurde hergestellt aus der Verbindung in Beispiel
220 (206 mg, 0,322 mmol) und O-(2-Chinolyl) methylhydroxylamin (120
mg, 0,681 mmol, 2,1 Äquiv.)
unter Anwendung des für
Beispiel 231 beschriebenen Verfahrens. Chromatographie (SiO2, 5% MeOH/Dichlormethan mit 0,2% NH4OH) ergab das gewünschte Material (185 mg, 3:1
Mischung aus Oximisomeren) als einen weißen Feststoff.
13C NMR (CDCl3) δ 217.9, 217.2,
204.9, 204.9, 169.9, 169.8, 159.0, 158.9, 157.8, 151.0, 148.7, 147.6,
136.5, 129.3, 129.2, 129.0, 127.5, 126.1, 126.0, 119.8, 119.6, 103.1,
83.5, 79.6, 79.4, 77.3, 77.0, 76.9, 76.9, 76.8, 76.7, 70.2, 69.5,
65.8, 60.4, 58.0, 58.0, 50.9, 46.5, 46.4, 44.8, 44.7, 40.1, 38.7,
38.5, 37.4, 37.4, 28.2, 22.3, 22.2, 21.2, 21.1, 20.5, 20.1, 18.1,
18.0, 14.5, 14.4, 14.3, 13.5, 10.4, 10.3. MS(CI) m/e 797 (M+H)+.
-
Das
O-(2-Chinolyl)methylhydroxylamin-Reagens wurde hergestellt wie folgt:
-
Schritt 232a. N-(2-Chinolyl)methoxyphthalimid
-
2-(Hydroxymethyl)chinolin
(1,20 g, 7,55 mmol), Triphenylphosphin (1,00 g, 6,29 mmol, 1,05 Äquiv.) und
N-Hydroxyphthalimid
(1,08 g, 6,63 mmol, 1,05 Äquiv.)
wurden in 25ml trockenem THF aufgelöst. Diethylazodicarboxylat
(1,09 ml, 6,93 mmol, 1,10 Äquiv.)
wurde dann tropfenweise hinzugefügt,
und die Reaktion wurde über
Nacht gerührt.
Die Reaktionsmischung wurde filtriert, um einen weißen Feststoff
zu ergeben. Das Filtrat wurde konzentriert, und eine zweite Ausbeute
an Material wurde gewonnen durch Verreiben mit Et2O.
Diese wurde mit dem ursprünglichen
Feststoff kombiniert, und Umkristallisieren aus EtOH ergab das gewünschte Produkt
(1,53 g) als lockeren weißen
Feststoff. MS(CI) m/e 305 (M+H)+.
-
Schritt 232b. O-(2-Chinolyl)methylhydroxylamin
-
N-(2-Chinolyl)methoxyphthalimid
(1,53 g) wurde in 95% EtOH suspendiert, und Hydrazin (0,30 ml) wurde
hinzugefügt.
Die Reaktionsmischung wurde 5 Stunden lang gerührt und dann filtriert. Das
Filtrat wurde unter vermindertem Druck konzentriert und dann in
einer geringen Menge an Dichlormethan aufgenommen. Die geringe Menge
an restlichem Phthalhydrazid wurde dann durch Filtration entfernt.
Das Filtrat wurde unter vermindertem Druck konzentriert, um die
Titelverbindung (0,91 g) als gelbes Öl zu ergeben. MS(CI) m/e 175 (M+H)+.
-
Beispiel 233
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH=NOCH2(3-Chinolyl)
-
Die
Titelverbindung wurde hergestellt aus der Verbindung in Beispiel
220 (250 mg, 0,391 mmol) und O-(3-Chinolyl) methylhydroxylamin (160
mg, 0,909 mmol, 2,3 Äquiv.)
unter Anwendung des für
Beispiel 231 beschriebenen Verfahrens. Chromatographie (SiO2, 5% MeOH/Dichlormethan mit 0,2% NH4OH) ergab das gewünschte Material (202 mg, 2:1
Mischung aus Oximisomeren) als einen weißen Feststoff.
13C NMR (CDCl3) δ 217.9, 217.1,
205.0, 169.9, 169.7, 157.9, 157.8, 151.0, 150.9, 150.8, 148.4, 147.8,
135.4, 135.2, 130.6, 130.5, 129.3, 129.2, 128.0, 127.9, 127.9, 126.6,
126.5, 103.2, 83.6, 83.5, 79.5, 79.4, 77.2, 76.9, 76.7, 73.7, 73.4,
70.3, 69.6. 65.9, 60.3, 58.1, 57.9, 51.0, 50.9, 46.7, 46.4, 44.9,
44.7, 40.2, 38.8, 38.6, 37.5, 28.2, 22.4, 22.2, 21.2, 20.4, 20.1,
18.1, 18.0, 14.7, 14.6, 14.4, 14.3, 13.6, 13.5, 10.5, 10.3. MS(CI)
m/e 797 (M+H)+: Anal Calcd for C42H60N4O11 Found C 63.00 H 7.56 N 6.79.
-
Das
O-(3-Chinolyl)methylhydroxylamin-Reagens wurde hergestellt wie folgt:
-
Schritt 233a. N-(3-Chinolyl)methoxyphthalimid
-
3-(Hydroxymethyl)chinolin
(400 mg, 2,52 mmol), Triphenylphosphin (692 mg, 2,64 mmol, 1,05 Äquiv.) und
N-Hydroxyphthalimid
(430 mg, 2,64 mmol, 1,05 Äquiv.)
wurden in 10ml trockenem THF aufgelöst. Diethylazodicarboxylat
(0,44 ml, 2,80 mmol, 1:11 Äquiv.)
wurde dann tropfenweise hinzugefügt,
und die Reaktion wurde über
Nacht gerührt.
Die Reaktionsmischung wurde für
2 Stunden in einen Gefrierapparat gestellt und dann filtriert, um
das gewünschte
Produkt (0,69 g) als lockeren weißen Feststoff zu ergeben. MS(CI)
m/e 305 (M+H)+.
-
Schritt 233b. O-(3-Chinolyl)methylhydroxylamin
-
N-(3-Chinolyl)methoxyphthalimid
(0,69 g) wurde in 95% EtOH suspendiert, und Hydrazin (0,10 ml) wurde
hinzugefügt.
Die Reaktionsmischung wurde über
Nacht gerührt
und dann filtriert. Das Filtrat wurde unter vermindertem Druck konzentriert
und dann in einer geringen Menge Dichlormethan aufgenommen. Die
geringe Menge an restlichem Phthalhydrazid wurde dann durch Filtration
entfernt. Das Filtrat wurde unter vermindertem Druck konzentriert,
um die Titelverbindung (0,42 g) als gelbes Öl zu ergeben. MS(CI) m/e 175
(M+H)+.
-
Beispiel 234
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH=NOCH2(6-Chinolyl)
-
Die
Titelverbindung wurde hergestellt aus der Verbindung in Beispiel
220 (120 mg, 0,186 mmol) und O-(6-Chinolyl) methylhydroxylamin (92
mg, 0,529 mmol, 2,8 Äquiv.)
unter Anwendung des für
Beispiel 231 beschriebenen Verfahrens. Chromatographie (SiO2, 5% MeOH/Dichlormethan mit 0,2% NH4OH) ergab das gewünschte Material (89 mg, 3:1
Mischung aus Oximisomeren) als einen weißen Feststoff.
13C NMR (CDCl3) δ 217.9, 217.1,
204.9. 169.8, 169.6, 157.8, 157.7, 150.6, 150.1, 148.0, 147.8, 136.1,
136.1, 129.6, 129.4, 129.3, 128.0, 126.6, 126.3, 121.0, 103.0, 83.5,
83.4, 79.4, 79.3, 77.4, 77.0, 76.8, 76.7, 76.6, 75.5, 75.3, 70.1,
69.5, 65.7, 60.2, 58.0, 57.9, 57.8, 50.8, 46.6, 46.3, 44.8, 44.6,
40.1, 38.6, 38.4, 37.3, 28.1, 22.3, 22.1, 22.1, 20.4, 20.0, 18.0,
17.8, 14.7, 14.5. 14.3, 13.4, 10.4, 10.2. MS(CI) m/e 797 (M+H)+. Anal Calcd for C42H60N4O11.
Found C 63.03 H 7.60 N 6.69.
-
Das
O-(6-Chinolyl)methylhydroxylamin-Reagens wurde hergestellt wie folgt:
-
Schritt 234a. N-(6-Chinolyl)methoxyphthalimid
-
6-(Hydroxymethyl)chinolin
(520 mg, 3,27 mmol), Triphenylphosphin (900 mg, 3,44 mmol, 1,05 Äquiv.) und
N-Hydroxyphthalimid
(560 mg, 3,43 mmol, 1,05 Äquiv.)
wurden in 25ml trockenem THF aufgelöst. Diethylazodicarboxylat
(574 μl,
3,63 mmol, 1,11 Äquiv.)
wurde dann tropfenweise hinzugefügt,
und die Reaktion wurde über
Nacht gerührt.
Die Reaktionsmischung wurde filtriert, um einen weißen Feststoff
zu ergeben. Das Filtrat wurde konzentriert, und eine zweite Ausbeute
an Material wurde durch Verreiben mit Et2O
gewonnen. Diese wurde mit dem ursprünglichen Feststoff kombiniert,
und Umkristallisieren aus EtOH ergab das gewünschte Produkt (782 mg) als
lockeren weißen
Feststoff. MS(CI) m/e 305 (M+H)+.
-
Schritt 234b. O-(2-Chinolyl)methylhydroxylamin
-
N-(2-Chinolyl)methoxyphthalimid
(782 mg) wurde in 95% EtOH suspendiert, und Hydrazin (0,15 ml) wurde
hinzugefügt.
Die Reaktionsmischung wurde über
Nacht gerührt
und dann filtriert. Das Filtrat wurde unter vermindertem Druck konzentriert
und dann in einer geringen Menge an Dichlormethan aufgenommen. Die
geringe Menge an restlichem Phthalhydrazid wurde dann durch Filtration
entfernt. Das Filtrat wurde unter vermindertem Druck konzentriert,
um die Titelverbindung (480 mg) als ein gelbes Öl zu ergeben. MS(CI) m/e 175 (M+H)+.
-
Beispiel 235
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH=NOCH2(1-Naphthyl)
-
Die
Titelverbindung wurde hergestellt aus der Verbindung in Beispiel
220 (117 mg, 0,183 mmol) und O-(1-Naphthyl) methylhydroxylamin (80
mg, 0,462 mmol, 2,5 Äquiv.)
unter Anwendung des für
Beispiel 231 beschriebenen Verfahrens. Chromatographie (SiO2, 5% MeOH/Dichlormethan mit 0,1% NH4OH) ergab das gewünschte Material (112 mg, 2:1
Mischung aus Oximisomeren) als einen weißen Feststoff.
13C NMR (CDCl3) δ 217.8, 217.0,
205.0, 169.9, 169.7, 157.9, 157.8, 150.3, 147.7, 133.7, 133.1, 131.8.
128.7, 128.6, 128.4, 127.1, 126.8, 126.2, 125.6, 125.3, 124.1, 103.1,
103.1, 83.6, 79.5, 79.3, 77.2. 17.0, 76.9, 74.7, 74.3, 70.3, 69.6,
65.9, 60.5, 58.1, 58.0, 51.0, 50.9, 46.6, 46.3, 44.9, 44.8, 40.2,
38.8, 38.6, 37.5, 28.3, 22.4, 22.3, 21.2, 20.5, 20.0, 14.6, 14.5,
14.1, 13.6, 10.5, 10.3, MS(CI) m/e 796 (M+H)+.
Anal Calcd for C43H61N3O11. Found C 64.91
H 7.80 N 5.06.
-
Das
O-(1-Naphthyl)methylhydroxylamin-Reagens wurde hergestellt wie folgt:
-
Schritt 235a. N-(1-Naphthyl)methoxyphthalimids
-
1-(Hydroxymethyl)naphthalen
(1,00 g, 6,33 mmol), Triphenylphosphin (1,73 g, 6,60 mmol, 1,04 Äquiv.) und
N-Hydroxyphthalimid
(1,08 g, 6,63 mmol, 1,05 Äquiv.)
wurden in 25ml trockenem THF aufgelöst. Diethylazodicarboxylat
(1,09 ml, 6,93 mmol, 1,09 Äquiv.)
wurde dann tropfenweise hinzugefügt,
und die Reaktion wurde über
Nacht gerührt.
Die Reaktionsmischung wurde mit 25 ml Et2O
verdünnt
und für
2 Stunden in einen Gefrierapparat gestellt. Die Reaktionsmischung
wurde dann filtriert, um einen weißen Feststoff zu ergeben. Umkristallisieren
aus EtOH ergab das gewünschte
Produkt (1,21 g) als einen weißen
Feststoff. MS(CI) m/e 321 (M+NH4)+.
-
Schritt 235b. O-(1-Naphthyl)methylhydroxylamin
-
N-(1-Naphthyl)methoxyphthalimid
(1,21 g) wurde in 95% EtOH suspendiert, und Hydrazin (0,20 ml) wurde
hinzugefügt.
Die Reaktionsmischung wurde über
Nacht gerührt
und dann filtriert. Das Filtrat wurde unter vermindertem Druck konzentriert
und dann in einer geringen Menge Dichlormethan aufgenommen. Die
geringe Menge an restlichem Phthalhydrazid wurde dann durch Filtration
entfernt. Das Filtrat wurde unter vermindertem Druck konzentriert,
um die Titelverbindung (480 mg) als farbloses Öl zu ergeben. MS(CI) m/e 174 (M+H)+.
-
Beispiel 236
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH=NOCH2(2-Naphthyl)
-
Die
Titelverbindung wurde hergestellt aus der Verbindung in Beispiel
220 (122 mg, 0,191 mmol) und O-(2-Naphthyl) methylhydroxylamin (62
mg, 0,358 mmol, 1,9 Äquiv.)
unter Anwendung des für
Beispiel 231 beschriebenen Verfahrens. Chromatographie (SiO2, 5% MeOH/Dichlormethan mit 0,1% NH4OH) ergab das gewünschte Material (100 mg, 3:1
Mischung von Oximisomeren) als einen weißen Feststoff.
13C NMR (CDCl3) δ 217.8, 217.0,
204.9, 169.8, 169.6, 157.8, 157.7, 150.3, 1 47.8, 1 35.4, 135.1,
133.2. 132.4. 128.0, 127.9. 127.9, 127.5, 127.0, 126.7, 126.1, 125.8,
125.7, 125.7, 125.6, 103.1, 83.5, 83.5, 79.4, 79.3, 77.1, 76.9,
76.8, 76.1, 75.9, 70.2, 69.5, 65.8, 60.3, 58.0, 57.9, 57.9, 50.9,
46.6, 46.3, 44.8. 44.7, 40.1, 38.7, 38.5, 37.4, 28.1, 23.3, 22.1,
21.1, 20.4, 20.0, 18.0, 17.9, 14.6, 14.5, 14.4, 14.2, 13.5, 10.4,
10.2. MS(CI) m/e 796 (M+H)+. Anal Calcd
for C43H61N3O11. Found C 64.59
H 7.72 N 5.14.
-
Das
O-(2-Naphthyl)methylhydroxylamin-Reagens wurde wie folgt hergestellt:
-
Schritt 236a. N-(2-Naphthyl)methoxyphthalimid
-
2-(Hydroxymethyl)naphthalen
(1,00 g, 6,33 mmol), Triphenylphosphin (1,73 g, 6,60 mmol, 1,04 Äquiv.) und
N-Hydroxyphthalimid
(1,08 g, 6,63 mmol, 1,05 Äquiv.)
wurden in 25ml trockenem THF aufgelöst. Diethylazodicarboxylat
(1,09 ml, 6,93 mmol, 1,09 Äquiv.)
wurde dann tropfenweise hinzugefügt,
und die Reaktion wurde über
Nacht gerührt.
Die Reaktionsmischung wurde für
2 Stunden in einen Gefrierapparat gestellt und dann filtriert, unter
Spülen
mit Et2O, um das Produkt (1,38 g) als einen
weißen
Feststoff zu ergeben. MS(CI) m/e 321 (M+NH4)+.
-
Schritt 236b. O-(2-Naphthyl)methylhydroxylamin
-
N-(2-Naphthyl)methoxyphthalimid
(1,38 g) wurde in 95% EtOH suspendiert, und Hydrazin (0,25 ml) wurde
hinzugefügt.
Die Reaktionsmischung wurde über
Nacht gerührt
und dann filtriert. Das Filtrat wurde unter vermindertem Druck konzentriert
und dann in einer geringen Menge Dichlormethan aufgenommen. Die
geringe Menge an restlichem Phthalhydrazid wurde dann durch Filtration
entfernt. Das Filtrat wurde unter vermindertem Druck konzentriert,
um die Titelverbindung (821 mg) als farbloses Öl zu ergeben. MS(CI) m/e 174 (M+H)+.
-
Beispiel 237
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH2NHOCH2 (Phenyl)
-
Die
Verbindung aus Beispiel 229 (120 mg, 0,161 mmol) wurde in MeOH (5
ml) aufgelöst
und mit NaCNBH3 (ungefähr 120 mg) und ausreichend
AcOH behandelt, um Bromcresolgrün-Indikator
von blau in gelb umzuwandeln. Nach 20-stündigem Rühren wurde die Reaktionsmischung
in gesättigte
NaHCO3-Lösung
gegossen und in Dichlormethan extrahiert. Der organische Anteil
wurde mit gesättigtem
NaHCO3, H2O und
Salzlösung
gewaschen, getrocknet (Na2SO4)
und unter vermindertem Druck konzentriert. Chromatographie (SiO2, 5% MeOH/Dichlormethan mit 0,2% NH4OH) ergab das gewünschte Material (51 mg) als
einen weißen Feststoff.
13C
NMR (CDCl3) δ 219.0, 205.7, 170.5, 157.8.
138.3, 128.1, 127.5, 102.5, 83.6, 76.6, 77.0, 75.6, 75.2, 70.2, 69.5,
66.0, 58.8, 58.3, 51.4, 50.7, 45.3, 45.0. 40.2, 34.1, 37.7, 28.3,
22.4, 21.3, 20.7, 18.2, 14.7, 13.7, 13.5. 12.8, 10.3. MS(CI) m/e
748 (M+H)+.
-
Beispiel 238
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH2NHOCH2 (4-NO2-Phenyl)
-
Die
Verbindung in Beispiel 230 (64 mg) wurde in MeOH (3ml) aufgelöst und mit
NaCNBH3 (ungefähr 100 mg) und ausreichend HCl
behandelt, um einen Methylorange-Indikator in Rot umzuwandeln. Nach 20-stündigem Rühren wurde
die Reaktionsmischung in gesättigte
NaHCO3-Lösung
gegossen und in Dichlormethan extrahiert. Der organische Anteil
wurde mit H2O und Salzlösung gewaschen, getrocknet
(Na2SO4) und unter
vermindertem Druck konzentriert. Chromatographie (SiO2,
5% MeOH/Dichlormethan mit 0,2% NH4OH) ergab
das gewünschte
Material (35 mg) als einen weißen
Feststoff.
13C NMR (CDCl3) δ 219.5, 205.5,
170.5, 157.8, 147.2, 146.8, 128.3, 123.4, 102.4, 83.6, 78.6, 76.8,
75.0, 74.3, 70.1, 69.5, 65.8, 58.4, 56.1, 51.3, 50.6, 45.3, 45.0,
40.1, 38.9, 37.7, 28.2, 22.2, 21.2, 20.7, 18.1, 14.6, 13.5. 13.3,
12.8, 10.2. MS(CI) m/e 793 (M+H)+.
-
Beispiel 239
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2C(O)-Phenyl
-
Schritt 239a. Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2C(OH)-Phenyl
-
Die
Verbindung aus Beispiel 220 (550 mg, 0,87 mmol) wurde in 16 ml trockenem
THF aufgelöst
und unter Stickstoff auf 0°C
gekühlt.
Phenylmagnesiumbromid (3,0 M Lösung
in Et2O, 3,0 ml, 6,0mmol, 6,9 Äquiv.) wurde
dann tropfenweise mit einer Spritze hinzugefügt. Die Reaktion wurde 50 min.
lang gerührt
und dann durch Hinzufügen
gesättigter
NH4Cl-Lösung
gekühlt.
Die Reaktionsmischung wurde mit EtOAc extrahiert, und der organische
Anteil wurde mit H2O und Salzlösung gewaschen,
getrocknet (Na2SO4)
und unter vermindertem Druck konzentriert. Chromatographie (SiO2, 5% MeOH/Dichlormethan mit 0,2% NH4OH) ergab das gewünschte Material (295 mg) als
einen weißen
Feststoff. MS(CI) m/e 719 (M+H)+.
-
Schritt 239b. Verbindung
mit der Formel (18, Schema 4): R* ist H, Rp ist
Ac, R ist -CH2C(OH)-Phenyl
-
Die
Verbindung aus dem vorhergehenden Schritt (180 mg, 0,250 mmol) wurde
in 5 ml trockenem Dichlormethan aufgelöst und mit Essigsäureanhydrid
(25 μl,
0,269 mmol, 1,08 Äquiv.) behandelt.
Nach Rühren über Nacht
wurde die Reaktion durch Hinzufügen
gesättigter
NaHCO3-Lösung
gekühlt.
Die Reaktionsmischung wurde mit Dichlormethan extrahiert, und der
organische Anteil wurde mit Salzlösung gewaschen, getrocknet
(Na2SO4) und unter
vermindertem Druck konzentriert, um das gewünschte Material (160 mg) als
einen weißen
Feststoff zu ergeben. MS(CI) m/e 761 (M+H)+.
-
Schritt 239c. Verbindung
mit der Formel (18, Schema 4): R* ist H, Rp ist
Ac, R ist -CH2C(O)-Phenyl
-
DMSO
(145 μl,
2,04 mmol, 14 Äquiv.)
wurde zu einer gekühlten
(-78°C)
Lösung
aus Oxalylchlorid (145 ml, 1,32 mmol, 9 Äquiv.) in 4 ml Dichlormethan
unter einer Stickstoffatmosphäre
gegeben. Die Verbindung aus dem vorhergehenden Schritt (113 mg,
0,149 mmol) wurde in 2 ml Dichlormethan aufgelöst und mit einer Kanüle über einen
Zeitraum von 15 min. zu der Reaktion gegeben. Nach 1-stündigem Rühren wurde
Et3N (0,37 ml, 2,65 mmol, 18 Äquiv.) zu
der Reaktionsmischung gegeben, und die Temperatur wurde langsam
auf -20°C erhöht. Die
Reaktion wurde durch Hinzufügen
von 5%iger KH2PO4-Lösung gekühlt und
mit Dichlormethan extrahiert. Der organische Anteil wurde mit 5%
KH2PO4, H2O und Salzlösung gewaschen, getrocknet
(Na2SO4) und unter
vermindertem Druck konzentriert. Chromatographie (SiO2,
1:1 Aceton/Hexane) ergab das gewünschte
Material (42 mg) als weißes
Pulver. MS(CI) m/e 759 (M+H)+.
-
Schritt 239d. Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2C(O)-Phenyl
-
Die
Verbindung aus dem vorhergehenden Schritt wurde in 5ml MeOH aufgelöst und über Nacht
rühren gelassen.
Die Reaktionsmischung wurde unter vermindertem Druck konzentriert,
um die Titelverbindung (38 mg) als einen weißen Feststoff zu ergeben.
13C NMR (DCl3) δ 215.4, 206.1,
194.4, 169.6, 157.7, 135.5, 133.0, 128.5, 127.6, 103.0, 83.8, 79.6,
77.1, 77.1, 70.2, 69.5, 65.9, 65.4, 57.6, 50.9, 46.0, 44.6, 40.2,
38.9, 37.9, 28.4, 22.4, 21.3, 20.2, 18.9, 14.9, 13.9, 13.7, 13.6,
10.5. MS(CI) m/e 717 (M+H)+.
-
Beispiel 240
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2C(O)-(4-F-Phenyl)
-
Die
Titelverbindung wurde hergestellt aus der Verbindung in Beispiel
220 und 4-Fluorphenylmagnesiumbromid unter Verwendung der Reaktionssequenz
in Beispiel 239.
13C NMR (CDCl3) δ 215.3,
206.0, 192.8, 169.6, 165.7, 157.7, 131.5, 130.2, 115.6, 103.1, 83.8,
79.7, 77.3, 76.8, 70.3, 69.6, 65.8, 65.1, 57.6, 50.9, 46.0, 44.6,
40.2, 38.8, 37.8, 28.3, 22.4, 21.3, 20.2, 18.8, 14.8, 13.9, 13.7, 13.5,
10.4. MS(CI) m/e 735 (M+H)+.
-
Beispiel 241
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH=NNHC(O)Phenyl
-
Die
Verbindung aus Beispiel 220 (100 mg, 0,156 mmol) und Benzoesäurehydrazid
(50 mg, 0,370 mmol, 2,4 Äquiv.)
wurden in 3ml trockenem Dichlormethan aufgelöst. Molekülsiebe (4 Å) wurden hinzugefügt, und
die Reaktion wurde über
Nacht gerührt.
Die Mischung wurde filtriert, und das Filtrat wurde unter vermindertem
Druck konzentriert. Chromatographie (SiO2,
5% MeOH/Dichlormethan mit 0,2% NH4OH) ergab
das gewünschte
Material (29 mg) als einen weißen
Feststoff.
13C NMR (CDCl3) δ 216.9, 204.2,
169.6, 164.3, 159.0, 148.6, 133.4, 131.2, 126.0, 127.7, 103.2, 83.9,
79.6, 77.6, 76.5, 70.1, 69.5, 65.7, 62.7, 57.8, 50.8. 46.9, 44.4,
40.0, 38.4. 37.3, 28.1, 21.9, 21.1, 20.7, 17.8, 15.0, 14.2, 13.3,
13.1, 10.0. MS(CI) m/e 759 (M+H)+.
-
Beispiel 242
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH2CH2(3-Chinolyl)
-
Eine
Mischung der Verbindung aus Beispiel 104 (230 mg) und 10%igem Pd/C
(50 mg) in 30 ml Methanol und 15 ml Ethylacetat wurde mit Stickstoff
gespült
und unter 1 atm Wasserstoff bei Raumtemperatur 22 Stunden lang gerührt. Die
Mischung wurde filtriert, und das Filtrat wurde unter vermindertem
Druck konzentriert. Chromatographie auf Silikagel (5% MeOH/Dichlormethan
mit 0,5% NH4OH) ergab das gewünschte Material (175
mg) als einen weißen
Feststoff.
Anal Calcd for C42H65N3O10:
C, 65.35; H, 8.49; N, 5.44. Found C, 65.73; H, 8.77; N, 5.17.
-
Beispiel 243
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2(2-(3-Chinolyl)cyclopropyl)
-
Zu
einer Lösung
von Diazomethan (0,64 M, 3,12 ml, 2,00mmol) in Ether wurde eine
Lösung
der Verbindung aus Beispiel 104 (153 mg, 0,200 mmol) in Dichlormethan
(5,0 ml) bei 0°C
unter Stickstoff gegeben. Eine geringe Menge (2 mg) Palladiumacetat
wurde hinzugefügt,
und die Mischung wurde 20 Minuten lang gerührt. Ein weiterer Anteil von
Diazomethan (3 ml) wurde hinzugefügt, und die Mischung wurde
eine weitere Stunde gerührt.
Die Lösungsmittel
wurden verdampft, und der Rückstand
wurde durch Chromatographie auf Silikagel (5% MeOH/Dichlormethan
mit 0,5% NH4OH) gereinigt, um die Titelverbindung
(100 mg) als einen weißen
Feststoff zu ergeben.
Anal Calcd for C43H61N3CO10:
C, 66.22; H, 7.88; N, 5.39. Found C, 66.05; H, 8.08; N, 5.02.
-
Beispiel 244
-
Verbindung mit der Formel
(III): Rc ist Propanoyl, L ist CO, T ist
NH, R ist -CH2CH=CH(3-Chinolyl)
-
Zu
einer Lösung
der Verbindung aus Beispiel 104 (152 mg) in Dichlormethan wurden
Propionanhydrid (52 μl)
und Triethylamin (56 μl)
gegeben, und die Mischung wurde 24 Stunden lang bei Raumtemperatur
gerührt.
Die Mischung wurde mit Ethylacetat verdünnt, und dies wurde mit 5%iger
NaHCO3-Lösung
und Salzlösung
gewaschen, getrocknet (Na2SO4)
und unter vermindertem Druck konzentriert. Der Rückstand wurde auf Silikagel
(1:1 Aceton/Hexane) chromatographiert, um die Titelverbindung (119mg)
als weißen
Schaum zu ergeben.
Anal Calcd for C4 5H63N3O11: C, 65.75; H. 7.73; N. 5.11. Found C.
65.67: H, 7.92; N, 4.77.
-
Beispiel 245
-
Verbindung mit der Formel
(III): Rc ist Ethylsuccinoyl, L ist CO,
T ist NH, R ist -CH2CH=CH(3-Chinolyl)
-
Zu
einer Lösung
der Verbindung aus Beispiel 104 (153 mg, 0,200 mmol) in Dichlormethan
(10 ml) bei 0°C
wurden Ethylsuccinylchlorid (29 μl)
und Triethylamin (56 μl)
gegeben, und die Mischung wurde 24 Stunden lang bei Raumtemperatur
gerührt.
Die Mischung wurde mit Ethylacetat verdünnt, und dies wurde mit 5%iger NaHCO3-Lösung
und Salzlösung
gewaschen, getrocknet (Na2SO4)
und unter vermindertem Druck konzentriert. Der Rückstand wurde auf Silikagel
(1:1 Aceton/Hexane) chromatographiert, um die Titelverbindung (110 mg)
als weißen
Schaum zu ergeben.
Anal Calcd for C48H67N3O13·H2O C, 63.21; H, 7.63; N, 4.61. Found C, 63.08;
H, 7.50; IV, 4.20.
-
Beispiel 246
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2-C≡C-H
-
Schritt 246a. Verbindung
4 aus Schema 1a; V ist N-O-(1-Isopropoxycyclohexyl),
R ist -CH2-C≡C-H, Rp ist
Trimethylsilyl
-
Zu
einer Lösung
unter Stickstoff von 2',4''-bis-O-Trimethylsilylerythromycin A 9-[O-(1-isopropoxycyclohexyl)oxim
(100 g, 96,9 mmol, hergestellt gemäß dem Verfahren von U.S.-Pat.
Nr. 4, 990, 602) in THF (200 ml) wurde wasserfreies DMSO (200 ml)
gegeben, und die Mischung wurde auf 0°C gekühlt. Zu dieser Lösung, gerührt unter
einer N2-Atmosphäre, wurde Propargylbromid (27
ml, 240 mmol, 80 Gewichtsprozent in Toluen) gegeben, gefolgt von
einer Lösung
aus trockenem KOH (13,6 g, 240 mmol) in wasserfreiem DMSO (300 ml), über einen
Zeitraum von 25 Minuten, und die Mischung wurde 1 Stunde lang bei
0°C kräftig gerührt. Zusätzliches
KOH (10,9 g, 190 mmol) und Propargylbromid (21 ml, 190 mmol) wurden
hinzugefügt,
und die Mischung wurde 1,5 Stunden lang bei 0°C unter N2 gerührt. Dieses
Hinzugeben von KOH und Propargylbromid wurde 3 weitere Male in Abständen von
1,5 Stunden wiederholt. Die Mischung wurde dann mit Ethylacetat extrahiert, und
die organischen Phasen wurden mit Wasser und Salzlösung gewaschen
und getrocknet (MgSO4)- Das Entfernen des
Lösungsmittels
unter Vakuum ergab das Rohprodukt (108 g), das direkt zum nächsten Schritt geführt wurde.
-
Schritt 246b: Verbindung
5 aus Schema 1a; R ist -CH2-C≡C-H
-
Zu
der Verbindung aus Schritt 246a (108 g) in CH3CN
(300ml) wurden Wasser (150 ml) und Essigsäure (kristallisiert, 200 ml)
gegeben, und die Mischung wurde bei Raumtemperatur ungefähr 20 Stunden
lang gerührt.
Das Lösungsmittel
wurde dann unter Vakuum bei 40°C
entfernt, und der Rückstand
wurde in EtOAc aufgenommen und nacheinander mit 5%igem Na2CO3 und Salzlösung gewaschen.
Die organische Phase wurde dann über
MgSO4 getrocknet, filtriert und konzentriert,
um die Titelverbindung (74 g) als braunen Schaum zu ergeben, der
direkt zum nächsten
Schritt geführt
wurde.
-
Schritt 246c: Verbindung
6 aus Schema 1a; R ist -CH2-C≡C-H
-
Die
Verbindung aus Schritt 246b (74 g) wurde in Ethanol (550 ml) aufgelöst und mit
Wasser (550 ml) verdünnt.
Zu dieser Lösung
wurde Natriumnitrit (33 g, 0,48 mol) gegeben, und die Reaktionsmischung
wurde bei Raumtemperatur 15 Minuten lang gerührt. Als Nächstes wurden 4M HCl (125 ml,
0,48 mol) über
einen Zeitraum von 15 Minuten bei Raumtemperatur hinzugefügt, die
Mischung wurde zwei Stunden lang auf 70°C erhitzt, dann auf Raumtemperatur
gekühlt.
Die Mischung wurde mit Ethylacetat extrahiert, und die organische Phase
wurde mit 5%igem Na2CO3 und
Salzlösung
gewaschen, dann über
MgSO4 getrocknet, filtriert und konzentriert.
Das Rohprodukt wurde durch Chromatographie auf Silikagel gereinigt,
unter Eluierung mit 1% Methanol/Dichlormethan, das 0,5% Ammoniumhydroxid
enthielt. Die Verbindung wurde aus Acetonitril kristallisiert, um
die Titelverbindung (27 g) zu ergeben.
-
Schritt 246d: Verbindung
6A aus Schema 1c; Rp ist Acetyl, R ist -CH2-C≡C-H
-
Zu
einer Lösung
aus 19 Gramm (246 mmol) der Verbindung aus Schritt 246c in wasserfreiem
Dichlormethan (100 ml) wurden 4-Dimethylaminopyridin (105 mg) und
Triethylamin (7,16 ml, 52mmol) gegeben. Die Mischung wurde in einem
Kaltwasserbad auf ungefähr
15°C gekühlt, und
Essigsäureanhydrid
(5,5 Milliliter, 59 mmol) wurde über
einen Zeitraum von 5 Minuten hinzugegeben. Nach 5-minütigem Rühren bei
15°C wurde das
Kaltwasserbad entfernt, und die Reaktion wurde bei Raumtemperatur
4 Stunden lang gerührt.
Die Mischung wurde mit Ethylacetat verdünnt und nacheinander mit 5%igem
wässerigem
Natriumcarbonat (zweimal), Wasser (zweimal) und Salzlösung gewaschen.
Die organischen Extrakte wurden über
Magnesiumsulfat getrocknet, filtriert und in vacuo konzentriert.
Trocknen auf konstantes Gewicht mit hohem Vakuum ergab die Titelverbindung
(21 g).
-
Schritt 246e: Verbindung
6B aus Schema 1c; Rp ist Acetyl, R ist -CH2-C≡C-H
-
Zu
einer 0°C-Lösung der
Verbindung aus Schritt 246d (21g, 24,5 mmol) in THF (128 ml) und
Dimethylsulfoxid (48 ml) wurde 1,1'-Carbonyldiimidazol (14,3 g, 88,3 mmol)
gegeben. Nach 5-minütigem Rühren wurde Natriumhydrid
(60% Dispersion in Mineralöl,
1,3 g, 32,5 mmol) portionsweise über
einen Zeitraum von 1 Stunde unter einer Stickstoffatmosphäre hinzugefügt. Nach
abgeschlossenem Hinzugeben wurde das Kühlbad entfernt, und die Mischung
wurde bei Raumtemperatur 3,5 Stunden lang gerührt. Die Reaktion wurde erneut
auf 0°C
gekühlt,
mit Ethylacetat (400 ml) verdünnt
und mit 5%igem wässerigem
Natriumbicarbonat (50 ml) gekühlt. Die
organischen Schichten wurden nacheinander mit Wasser und Salzlösung gewaschen,
dann über
Magnesiumsulfat getrocknet. Die Lösung wurde filtriert, und das
Filtrat wurde in vacuo konzentriert und auf konstantes Gewicht getrocknet,
um die Titelverbindung (23 g) zu liefern, die direkt zum nächsten Schritt
geführt
wurde.
-
Schritt 246f: Verbindung
6C aus Schema 1c; Rp ist Acetyl, R ist -CH2-C≡C-H
-
Ein
Druckgefäß, das die
Verbindung aus Schritt 246e (23g, 24 mmol) in Acetonitril (250 ml)
enthielt, wurde auf -78°C gekühlt. Ein
gleiches Volumen von flüssigem
Ammoniak (250 Milliliter) wurde in das Reaktionsgefäß kondensiert,
das dann versiegelt und unter Rühren
auf Raumtemperatur erwärmen
gelassen wurde. Nach 20 Stunden wurde die Reaktion erneut auf -78°C gekühlt, das
Druckgefäß wurde
geöffnet,
und die Reaktion wurde unter Rühren
auf Raumtemperatur erwärmen
gelassen. Als das gesamte flüssige
Ammoniak verdunstet war, wurde das Acetonitril in vacuo entfernt,
und der Rückstand
wurde auf konstantes Gewicht getrocknet, um die Titelverbindung
(21 g) zu ergeben.
-
Schritt 246g: Verbindung
6D aus Schema 1c; Rp ist Acetyl, R ist -CH2-C≡C-H
-
Zu
einer 0°C-Suspension
der Verbindung aus Schritt 246f (21 g) in 1:1 Ethanol/Wasser (200
ml) wurden über
einen Zeitraum von 10 Minuten 4 M Salzsäure (125 ml) gegeben. Nach
Entfernen des Kühlbads
wurde die Reaktionslösung
bei Raumtemperatur 26 Stunden lang gerührt. Die Mischung wurde mit
Wasser verdünnt,
auf 0°C
gekühlt
und mit 2N Natriumhydroxid auf pH 10 basisch gemacht. Die Mischung
wurde dann mit Ethylacetat (400 ml) extrahiert, und die organischen
Schichten wurden mit Salzlösung
gewaschen. Die organischen Extrakte wurden über Magnesiumsulfat getrocknet,
filtriert und in vacuo konzentriert. Trocknen auf konstantes Gewicht
lieferte 18 g des Rohprodukts, das aus Ethylacetat/Hexanen kristallisiert
wurde, um die reine Titelverbindung (8,5 g) zu ergeben.
-
Schritt 246h: Verbindung
6E aus Schema 1c; Rp ist Acetyl, R ist -CH2-C≡C-H
-
Zu
einer -10°C-Lösung aus
N-Chlorsuccinimid (2,3 g, 0,017 mol) in Dichlormethan (100 ml) wurde über einen
Zeitraum von 5 Minuten Methylsulfid (1,47 ml, 0,021 mol) gegeben.
Die Reaktion wurde bei -10°C
10 Minuten lang gerührt.
Eine Lösung
der Verbindung aus Schritt 246g (8,3 g, 0,012 m) in Dichlormethan
(100 ml) wurde dann über
einen Zeitraum von 30 Minuten hinzugefügt, und die Mischung wurde
25 Minuten lang bei -10°C
gerührt.
Triethylamin (1,6 ml, 0,021 mol) wurde über einen Zeitraum von 5 Minuten
hinzugegeben, und die Reaktion wurde bei -10°C 50 Minuten lang gerührt. Die
Reaktion wurde dann mit 5% wässerigem
Natriumbicarbonat (50 ml) gekühlt
und mit Dichlormethan (300 ml) extrahiert. Die organischen Schichten
wurden mit 5% wässerigem
Natriumbicarbonat, gefolgt von Salzlösung, gewaschen, über Magnesiumsulfat
getrocknet, filtriert und in vacuo konzentriert. Das Rohprodukt
wurde mit Säulenchromatographie
auf Silikagel gereinigt, unter sequentieller Eluierung mit 30% Aceton/Hexanen,
gefolgt von 50% Aceton/Hexanen, um die Titelverbindung (7,35 g)
zu ergeben.
-
Schritt 246: Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-H
-
Eine
Probe (72 mg) der Verbindung aus Schritt 246h wurde in Methanol
(8 ml) aufgelöst
und bei Raumtemperatur 18 Stunden lang gerührt. Nach Konzentration unter
Vakuum und Trocknen auf konstantes Gewicht unter Hochvakuum wurden
65 mg der reinen Titelverbindung gewonnen. Hochauflösungs-FAB-MS:
berechnet m/e für
(M+H)+: C33H53N2O10=637,
3700 Beobachtet m/e = 637, 3718.
-
Beispiel 247
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2-C≡C-(3-Chinolyl)
-
Schritt 247a. Verbindung
6E aus Schema 1c; R ist -CH2-C≡C-(3-Chinolyl)
-
Ein
mit einem Rührstab
ausgestattetes Druckrohr wurde mit Dichlorbis(triphenylphosphin)palladium(II) (6,2
mg), entgastem Triethylamin (2,5 ml), entgastem N,N-Dimethylformamid
(0,5ml), dann 3-Bromchinolin (93 μl)
und einer Probe der Verbindung aus Schritt 246h (300 mg) und zuletzt
Kupfer(II)-Iodid (0,84mg) geladen. Die Reaktion wurde unter einer
Stickstoffatmosphäre
versiegelt und 2 Stunden lang auf 60°C erhitzt. Nach Abkühlen auf
Raumtemperatur wurde die Reaktion mit 1:1 Ether/Ethylacetat verdünnt und
dreimal mit Wasser und Salzlösung
gewaschen. Die organischen Extrakte wurden über Magnesiumsulfat getrocknet,
filtriert und in vacuo konzentriert. Trocknen mit Hochvakuum ergab
374 Milligramm des Rohprodukts. Das Rohprodukt wurde mit Silikagelchromatographie
unter Verwendung von 30% Aceton/Hexanen gereinigt, um die Titelverbindung
(280 mg, 78%) zu ergeben. MS (APCI)+ m/e
806 (M+H)+.
-
Schritt 247b Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-(3-Chinolyl)
-
Die
Verbindung aus Schritt 247a (270 mg) wurde in Methanol aufgelöst und bei
Raumtemperatur 18 Stunden lang gerührt. Nach Konzentration in
vacuo und Trocknen auf konstantes Gewicht unter Hochvakuum wurden
260 mg des Rohprodukts gewonnen. Reinigung mit Silikagelchromatographie
unter Eluierung mit 98:1:1 Dichlormethan/Methanol/Ammoniumhydroxid
ergab 221 mg der Titelverbindung. Hochauflösungs-FAB-MS: berechnet m/e
für (M+H)+: C42H58N3O10=764,4122 beobachtet
m/e = 764,4121.
-
Beispiel 248
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2-C≡C-(6-Nitro-3-chinolyl)
-
Gemäß dem Verfahren
von Beispiel 247, außer
dass 3-Bromchinolin
durch 6-Nitro-3-bromchinolin ersetzt wurde, wurde die Titelverbindung
hergestellt. Hochauflösungs-FRB-MS:
berechnet m/e für
(M+H)+: C42H57N4O12=809,3973
beobachtet m/e=809,3966
-
Beispiel 249
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2-C=C-Phenol
-
Gemäß dem Verfahren
von Beispiel 247, außer
dass 3-Bromchinolin
durch Iodbenzen ersetzt wurde. Hochauflösungs-FAB-MS: berechnet m/e für (M+H)+:
C39H57N2O10=713,4013 beobachtet m/e=713,3998.
-
Beispiel 250
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2-C≡C-Naphthyl
-
Gemäß dem Verfahren
von Beispiel 247, außer
dass 3-Bromchinolin
durch 1-Iodnaphthalen ersetzt wurde.
-
Hochauflösungs-FAB-MS:
berechnet m/e für
(M+H)+: C43H59N2O10=763,4170
beobachtet m/e = 763,4161.
-
Beispiel 251
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2-C≡C-(2-Naphthyl)
-
Gemäß dem Verfahren
von Beispiel 247, außer
dass 3-Bromchinolin
durch 2-Bromnaphthalen ersetzt wurde. Hochauflösungs-FAB-MS: berechnet m/e
für (M+H)+: C43H59N2O10=763,4170 beobachtet
m/e = 763,4150.
-
Beispiel 252
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2-C≡C-(6-Methoxy-2-naphthyl)
-
Gemäß dem Verfahren
von Beispiel 247, außer
dass 3-Bromchinolin
durch 6-Methoxy-2-bromnaphthalen ersetzt wurde. Hochauflösungs-FAB-MS:
berechnet m/e für
(M+H)+: C94H61N2O11=793,4275
beobachtet m/e = 793,4256.
-
Beispiel 253
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2-C≡C-(6-Chlor-2-naphthyl)
-
Gemäß dem Verfahren
von Beispiel 247, außer
dass 3-Bromchinolin
durch 6-Chlor-3-bromchinolin ersetzt wurde. Hochauflösungs-FAB-MS:
berechnet m/e für
(M+H)+: C42H57N3O10Cl=798,3732
beobachtet m/e = 798,3743.
-
Beispiel 254
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2-C≡C-(6-Chinolyl)
-
Gemäß dem Verfahren
von Beispiel 247, außer
dass 3-Bromchinolin
durch 6-Bromchinolin ersetzt wurde. Hochauflösungs-FAB-MS: berechnet m/e für (M+H)+: C42H58N3O10=764,4122 beobachtet
m/e = 764,4116.
-
Beispiel 255
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2-C=C-(2-Methyl-6-chinolyl)
-
Gemäß dem Verfahren
von Beispiel 247, außer
dass 3-Bromchinolin
durch 6-Brom-2-methylchinolin ersetzt wurde. Hochauflösungs-FAB-MS:
berechnet m/e für
(M+H)+: C43H60N3O10=778,4279
beobachtet m/e = 778,4282.
-
Beispiel 256
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2-C≡C-(5-(N-(2-Pyridyl)amino)carbonyl)furanyl)
-
Gemäß dem Verfahren
von Beispiel 247, außer
dass 3-Bromchinolin
durch 5-Brom-furan-2-carbonsäure-pyridin-2-yl-amid
ersetzt wurde. MS (FAB+):(M+H)+ @ m/e 823.
-
Beispiel 257
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2-C≡C-(1-Phenylethenyl)
-
Gemäß dem Verfahren
von Beispiel 247, außer
dass 3-Bromchinolin
durch Alpha-Bromstyren ersetzt wurde. MS (ESI) m/e 739 (M+H)+.
-
Beispiel 258
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2-C≡C-Br
-
Schritt 258a. Verbindung
6E aus Schema 1c; R ist -CH2-C≡C-Br
-
Zu
einer Lösung
unter Stickstoff der Verbindung aus Beispiel 246, Schritt h (100
mg) in Aceton (1 ml) wurde bei Raumtemperatur Essigsäure (8,9
Mikroliter) gegeben. Eine zweite Lösung, die N-Bromsuccinimid (39
mg) und Silbernitrat (2,5 mg) in 1 ml Aceton enthielt, wurde hergestellt
und dann unter Stickstoff bei Raumtemperatur zehn Minuten lang gerührt und
auf 0°C
gekühlt.
Die erste Lösung
wurde dann in einer Portion zu der zweiten Lösung gegeben, das Kühlbad wurde
entfernt und die resultierende Reaktionsmischung bei Raumtemperatur
unter Stickstoff 2 Stunden lang gerührt. Die Reaktion wurde dann
mit Ethylacetat verdünnt, gesättigtes
wässeriges
Natriumbicarbonat wurde hinzugefügt,
und die Mischung wurde über
Nacht bei Raumtemperatur gerührt.
Die organische Phase wurde abgetrennt, mit Salzlösung gewaschen und getrocknet (MgSO4). Das Lösungsmittel
wurde entfernt, und der Rückstand
wurde durch Chromatographie auf Silikagel gereinigt, unter Eluierung
mit 40% Aceton/Hexanen, um die Titelverbindung (50 mg, 46%) zu ergeben.
-
Schritt 258b. Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-C≡C-Br
-
Eine
Probe (35 mg) der Verbindung aus Schritt 258a wurde in Methanol
(2 ml) aufgelöst
und bei Raumtemperatur 16 Stunden lang gerührt. Das Lösungsmittel wurde entfernt,
und der Rückstand
wurde durch Chromatographie auf Silikagel gereinigt, unter Eluierung
mit 5:94:1 Methanol/Dichlormethan/1% NH4OH,
um die Titelverbindung (32 mg, 26%) zu ergeben. MS (ESI) m/e 715
(M+H)+.
-
Beispiel 259
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2-(2,2-Dimethvl-1,3-dioxolan-4-yl)
-
Schritt 259a. Verbindung
6D aus Schema 1c; R ist -CH2CH(OH)CH2OH, Rp ist Acetyl
-
Zu
einer Probe der Verbindung aus Beispiel 176, Schritt d (5,0 g, 7,32
mmol, Verbindung 6D aus Schema 1c, R ist -CH2CH=CH2, Rp ist Acetyl)
und N-Methylmorpholin-N-oxid (1,7 g, 14,5 mmol) in THF (25 ml) bei Raumtemperatur
wurde OsO4 (4% in H2O,
0,090 ml, 0,0147 mmol) gegeben, und die Mischung wurde 24 Stunden
lang gerührt.
Die Reaktion wurde mit Natriumbisulfit (1,5 g) und Wasser (10 ml)
gekühlt,
und die Lösungsmittel
wurden unter Vakuum entfernt. Der Rückstand wurde in Ethylacetat
aufgelöst,
welches mit gesättigtem wässerigem
Natriumbicarbonat, Wasser und Salzlösung gewaschen und getrocknet
(Na2SO4) wurde.
Das Lösungsmittel
wurde entfernt, um die Titelverbindung (3,17 g) zu ergeben.
-
Schritt 259b. Verbindung
6D aus Schema 1c; R ist -CH2-(2,2-Dimethvl-1,3-dioxolan-4-yl),
Rp ist Acetyl, Rd ist
H
-
Zu
einer Probe der Verbindung aus Schritt 259a (500 mg, 0,70 mmol)
und 2,2-Dimethoxpropan (0,26 ml, 2,1 mmol) in Toluen (7 ml) wurde
p-Toluensulfonsäure
(160 mg, 0,84 mmol) gegeben, und die Mischung wurde 3 Tage lang
bei 55°C
gerührt.
Die Mischung wurde mit Ethylacetat verdünnt, und diese Lösung wurde mit
10% Natriumcarbonatlösung,
Wasser und Salzlösung
gewaschen. Die organische Phase wurde getrocknet (Na2SO4), und das Lösungsmittel wurde entfernt,
um das rohe Produkt zu ergeben, das durch Chromatographie auf Silikagel
gereinigt wurde, unter Eluierung mit 2:97:1 Methanol/Chloroform/Ammoniumhydroxid,
um die Titelverbindung (363 mg) zu ergeben.
-
Schritt
259c. Verbindung 6E aus Schema 1c; R ist -CH2-(2,2-Dimethyl-1,3-dioxolan-4-yl),
Rp ist Acetyl, Rd ist
H Eine Probe der Verbindung aus Schritt 259b (356 mg, 0,47mmol)
wurde mit N-Chlorsuccinimid und Dimethylsulfid gemäß dem Verfahren
von Beispiel 1, Schritt f, oxidiert, um die Titelverbindung (371
mg) zu ergeben.
-
Schritt 259d. Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-(2,2-Dimethyl-1,3-dioxolan-4-yl)
-
Eine
Probe der Verbindung aus Schritt 259c (100 mg, 0,13mmol) wurde über Nacht
bei Raumtemperatur in Methanol (4 ml) gerührt. Das Lösungsmittel wurde entfernt,
und der Rückstand
wurde durch Chromatographie auf Silikagel gereinigt, unter Eluierung
mit 0,9:98:1 Methanol/Chloroform/Ammoniumhydroxid, um die Titelverbindung
(87 mg) zu ergeben. MS m/e 713 (M+H)+.
-
Beispiel 260
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH (OH)CH2OH
-
Eine
Probe der Verbindung aus Beispiel 259 (100 mg, 0,13mmol) wurde unter
Rückfluss
mit p-Toluensulfonsäure
(35 mg, 0,18 mmol) in 4:1 THF/Wasser (2,5 ml) 3 Stunden lang gerührt. Die
Mischung wurde mit Ethylacetat verdünnt, und diese Lösung wurde
mit 10%iger Natriumcarbonatlösung,
Wasser und Salzlösung gewaschen.
Die organische Phase wurde getrocknet (Na2SO4), und das Lösungsmittel wurde entfernt,
um das rohe Produkt zu ergeben, das durch Chromatographie auf Silikagel
gereinigt wurde, unter Eluierung mit 2:97:1 Methanol/Chloroform/Ammoniumhydroxid,
um die Titelverbindung (61mg) zu ergeben. MS m/e 689 (M+H)+.
-
Beispiel 261
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2CH(OH)-Phenyl
-
Zu
einer Probe der Verbindung aus Beispiel 220 (550 mg, 0,87 mmol)
in trockenem THF (16 ml) bei 0°C
unter Stickstoff wurde tropfenweise eine Lösung aus Phenylmagnesiumbromid
(3,0 M, 2,0 ml, 6,0 mmol) in Ether gegeben. Die Mischung wurde ungefähr 1 Stunde
lang gerührt,
und die Reaktion wurde mit gesättigter Ammoniumchloridlösung gekühlt. Die
Mischung wurde mit Ethylacetat extrahiert, und diese Lösung wurde
mit Wasser und Salzlösung
gewaschen und getrocknet (Na2SO4).
Das Lösungsmittel
wurde entfernt, und der Rückstand
wurde durch Chromatographie auf Silikagel gereinigt, unter Eluierung
mit 10:90:0,5 Methanol/Dichlormethan/Ammoniumhydroxid, um die Titelverbindung
(235 mg) als zwei Isomere zu ergeben. Isomer A: MS m/e 719 (M+H) +. Isomer B: MS m/e 719 (M+H)+.
-
Beispiel 262
-
Verbindung mit der Formel
(IX): L ist CO, T ist N(NH2), R ist -CH2CH=CH2
-
Zu
einer Probe der Verbindung aus Beispiel 102, Schritt b (793 mg,
1,0 mmol) in 9:1 Acetonitril/Wasser (10 ml) wurde Hydrazin (85%
wässerige
Lösung,
0,50 ml, 10,0 mmol) gegeben, und die Mischung wurde bei Raumtemperatur
unter Stickstoff 4 Tage lang gerührt.
Die Mischung wurde mit Ethylacetat verdünnt, und die organische Phase
wurde mit Wasser und Salzlösung
gewaschen und getrocknet (Na2SO4).
Das Lösungsmittel wurde
entfernt, und der Rückstand
wurde durch Chromatographie auf Silikagel gereinigt, unter Eluierung
mit 5:95:0,5 Methanol/Dichlormethan/Ammoniumhydroxid, um die Titelverbindung
(91 mg) zu ergeben. MS m/e 654 (M+H)+.
-
Beispiel 263
-
Verbindung mit der Formel
(IX): L ist CO, T ist N(NH2), R ist -CH2CH=CH-(3-Chinolyl)
-
Gemäß den Verfahren
von Beispiel 178, außer
dass die Verbindung in Beispiel 177 durch die Verbindung in Beispiel
262 ersetzt wurde, wurde die Titelverbindung hergestellt. MS m/e
781 (M+H)+. Hochauflösungs-FAB-MS: berechnet m/e
für (M+H)+ von C42H59N3O10:
781,4176; gefunden: 781,4188.
-
Beispiel 264
-
Verbindung mit der Formel
(IX): L ist CO, T ist N(NH2), R ist -CH2CH2CH2-(3-Chinolyl)
-
Gemäß den Verfahren
von Beispiel 3, außer
dass die Verbindung in Beispiel 3 durch die Verbindung in Beispiel
262 ersetzt wurde, wurde die Titelverbindung hergestellt. MS m/e
768 (M+H)+. Hochauflösungs-FAB-MS: berechnet m/e
für (M+H)+ von C42H61N3O10:
768,4435; gefunden: 768,4437.
-
Beispiel 265
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-Naphthyl
-
Gemäß den Verfahren
von Beispiel 178, außer
dass das 3-Bromchinolin
von Beispiel 178 durch 1-Bromnaphthalen ersetzt wurde, wurde die
Titelverbindung hergestellt. MS m/e 764 (M+H)+.
-
Beispiel 266
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-(3-(2-Furanyl)-6-chinolyl)
-
Eine
Mischung einer Probe des 2'-acetylierten
Derivats der Verbindung aus Beispiel 219 (acetyliert durch das Verfahren
in Beispiel 177, Schritt a) (177 mg, 0,200 mmol), 2-(Tributylstannyl)furan
(78 μl,
0,200 mmol) und Pd (triphenylphosphin)4 (23
mg, 0,020 mmol) in trockenem Toluen wurde in einer versiegelten
Röhre bei
60°C bis
90°C 20
Stunden lang erhitzt. Die Mischung wurde dann mit Ethylacetat verdünnt, das
mit wässerigem
5%igem Natriumbicarbonat und Salzlösung gewaschen und getrocknet
(Na2SO4) wurde.
Das Lösungsmittel
wurde entfernt, und der Rückstand
wurde durch Chromatographie auf Silikagel gereinigt, unter Eluierung
mit 1:1 Aceton/Hexanen, um die acetylierte Titelverbindung zu ergeben.
Dieses Material wurde 48 Stunden lang mit Methanol gerührt, und
das Lösungsmittel
wurde entfernt. Der Rückstand
wurde durch Chromatographie auf Silikagel gereinigt, unter Eluierung
mit 95:5:0,5 Dichlormethan/Methanol/Dimethylamin, um die Titelverbindung
(102 mg) zu ergeben. MS m/e 832 (M+H)+.
Hochauflösungs-FAB-MS:
berechnet m/e für (M+H)+ von C46H61N3O11:
832,4384; gefunden: 832,4384.
-
Beispiel 267
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH,CH=CH-(8-Chlor-3-chinolyl)
-
Gemäß den Verfahren
von Beispiel 178, außer
dass das 3-Bromchinolin
von Beispiel 178 durch 8-Chlor-3-bromchinolin ersetzt wurde, wurde
die Titelverbindung hergestellt. MS m/e 800 (M+H)+.
Hochauflösungs-FAB-MS:
berechnet m/e für
(M+H)+ von C42H58CIN3O10:
800,3889; gefunden: 800,3890.
-
Beispiel 268
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-(4-Chlor-2-trifluormethyl-6-chinolyl)
-
Gemäß den Verfahren
von Beispiel 178, außer
dass das 3-Bromchinolin
von Beispiel 178 durch 6-Brom-4-chlor-2-trifluormethylchinolin ersetzt wurde,
wurde die Titelverbindung hergestellt. MS m/e 868 (M+H)+.
-
Beispiel 269
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2 R ist -CH2CH=CH-(2-Fluorenyl)
-
Gemäß den Verfahren
von Beispiel 178, außer
dass das 3-Bromchinolin
in Beispiel 178 durch 2-Bromfluoren ersetzt wurde, wurde die Titelverbindung
hergestellt. MS m/e 803 (M+H)+.
-
Beispiel 270
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-(9-Fluorenon-2-yl)
-
Gemäß den Verfahren
von Beispiel 178, außer
dass das 3-Bromchinolin
in Beispiel 178 durch 2-Jod-9-fluorenon ersetzt wurde, wurde die
Titelverbindung hergestellt.
MS m/e 817 (M+H)+.
Anal Calcd for C46H60N2O11 C.67.63; H,
7.40; N. 3.43. Found C, 68.11; H, 8.08; N, 3.21.
-
Beispiel 271
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-(6-Benzoyl-2-naphthyl)
-
Gemäß den Verfahren
von Beispiel 178, außer
dass das 3-Bromchinolin
in Beispiel 178 durch 6-Benzoyl-2-(trifluormethylsulfonyloxy)naphthalen
(hergestellt aus 6-Benzoyl-2-naphthol
durch Reaktion mit Trifluormethylsulfonanhydrid) ersetzt wurde,
wurde die Titelverbindung hergestellt. MS m/e 869 (M+H)+.
-
Beispiel 272
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2 R ist -CH2CH=CH-(7-Methoxy-2-naphthol)
-
Gemäß den Verfahren
von Beispiel 178, außer
dass das 3-Bromchinolin
in Beispiel 178 durch 7-Methoxy-2-(trifluormethylsulfonyloxy)naphthalen
(hergestellt aus 7-Methoxy-2-naphthol
durch Reaktion mit Trifluormethylsulfonanhydrid) ersetzt wurde,
wurde die Titelverbindung hergestellt.
MS m/e 795 (M+H)+. Anal Calcd for C44H62N2O11. ·0.5 H2O C, 65.73; H, 7.90; N, 3.48. Found C, 65.62;
H, 8.06; N, 3.49.
-
Beispiel 273
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-(3-Phenyl-6-chinolyl)
-
Eine
Mischung aus einer Probe des 2'-acetylierten
Derivats der Verbindung in Beispiel 219 (acetyliert durch das Verfahren
in Beispiel 177, Schritt a) (177 mg, 0,200 mmol), Pd (triphenylphosphin)4 (11,5 mg, 0,010 mmol), CuBr (1,43 mg) und
(Tributylstannyl)benzen (78,3 μl)
in Dioxan (2 ml) wurde in einer versiegelten Röhre 15 Stunden lang bei 100°C erhitzt.
Die Mischung wurde dann mit Ethylacetat verdünnt, das mit wässerigem 5%igem
Natriumcarbonat und Salzlösung
gewaschen und getrocknet (Na2SO4)
wurde. Das Lösungsmittel
wurde entfernt, und der Rückstand
wurde durch Chromatographie auf Silikagel gereinigt, um die acetylierte
Titelverbindung (77 mg) zu ergeben. Dieses Material wurde 48 Stunden
lang mit Methanol gerührt,
und das Lösungsmittel
wurde entfernt. Der Rückstand
wurde durch Chromatographie auf Silikagel gereinigt, um die Titelverbindung
(54,2 mg) zu ergeben. MS m/e 842 (M+H)+.
-
Beispiel 274
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-(3-(2-Pyridyl)-6-chinolyl)
-
Gemäß den Verfahren
von Beispiel 273, außer
dass das 2-(Tributylstannyl)furan
in Beispiel 273 durch 2-(Tributylstannyl) pyridin ersetzt wurde,
wurde die Titelverbindung hergestellt. MS m/e 841 (M+H)+.
-
Beispiel 275
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-(3-(2-Thiophenyl)-6-chinolyl
-
Gemäß den Verfahren
von Beispiel 273, außer
dass das 2-(Tributylstannyl)furan
in Beispiel 273 durch 2-(Tributylstannyl) thiophen ersetzt wurde,
wurde die Titelverbindung hergestellt. MS m/e 848 (M+H)+.
-
Beispiel 276
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-(4-Methylnaphthyl)
-
Gemäß den Verfahren
von Beispiel 178, außer
dass die 2'-acetylierte
Verbindung in Beispiel 177 durch die 2'-benzoylierte Verbindung in Beispiel
102, Schritt c, ersetzt wurde und das 3-Bromchinolin in Beispiel
178 durch 1-Brom-4- methylnaphthalen
ersetzt wurde, wurde die Titelverbindung hergestellt. MS m/e 779
(M+H)+. Hochauflösungs-FAB-MS: berechnet m/e
für (M+H)+ von C44H62N2O10:
779, 4483; gefunden: 779,4495.
-
Beispiel 277
-
sVerbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-(6-β-D-Galactopyranosyl-2-naphthyl)
-
Gemäß den Verfahren
von Beispiel 178, außer
dass die 2'-acetylierte
Verbindung in Beispiel 177 durch die 2'-benzoylierte Verbindung in Beispiel
102, Schritt c, ersetzt wurde, und dass das 3-Bromchinolin in Beispiel 178
durch 6-Brom-2-naphthyl-β-D-galactopyranosid
(bezogen von Sigma Aldrich) ersetzt wurde, wurde die Titelverbindung
hergestellt. MS m/e 943 (M+H)+.
-
Beispiel 278
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH- (7-Chinolyl)
-
Gemäß den Verfahren
von Beispiel 178, außer
dass die 2'-acetylierte
Verbindung in Beispiel 177 durch die 2'-benzoylierte Verbindung in Beispiel
102, Schritt c, ersetzt wurde und dass das 3-Bromchinolin in Beispiel 178
durch 7-(Trifluormethylsulfonyl)chinolin
ersetzt wurde, wurde die Titelverbindung hergestellt. MS m/e 766 (M+H)+.
-
Beispiel 279
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-(4-Fluornaphthyl)
-
Gemäß den Verfahren
von Beispiel 178, außer
dass die 2'-acetylierte
Verbindung in Beispiel 177 durch die 2'-benzoylierte Verbindung in Beispiel
102, Schritt c, ersetzt wurde und dass das 3-Bromchinolin in Beispiel 178
durch 1-Brom-4-fluornaphthalen
ersetzt wurde, wurde die Titelverbindung hergestellt. MS m/e 783
(M+H)+. Hochauflösungs-FAB-MS: berechnet m/e
für (M+H)
+ von C43H59FN2O10: 783, 4227;
gefunden: 783, 4223.
-
Beispiel 280
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-(3-Biphenyl)
-
Gemäß den Verfahren
in Beispiel 178, außer
dass die 2'-acetylierte
Verbindung in Beispiel 177 durch die 2'-benzoylierte Verbindung in Beispiel
102, Schritt c, ersetzt wurde und dass das 3-Bromchinolin in Beispiel 178
durch 3-Brombiphenyl
ersetzt wurde, wurde die Titelverbindung hergestellt. MS m/e 791
(M+H)+. Hochauflösungs-FAB-MS: berechnet m/e
für (M+H)+ von C45H63N2O10:
791, 4483; gefunden: 791,4492.
-
Beispiel 281
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-(5-Nitronaphthyl)
-
Gemäß den Verfahren
von Beispiel 178, außer
dass die 2'-acetylierte
Verbindung in Beispiel 177 durch die 2'-benzoylierte Verbindung in Beispiel
102, Schritt c, ersetzt wurde und dass das 3-Bromchinolin in Beispiel 178
durch 1-Brom-5-nitronaphthalen
ersetzt wurde, wurde die Titelverbindung hergestellt.
-
Beispiel 282
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-(4-Pyrrolylphenyl)
-
Gemäß den Verfahren
in Beispiel 178, außer
dass die 2'-acetylierte
Verbindung in Beispiel 177 durch die 2'-benzoylierte Verbindung in Beispiel
102, Schritt c, ersetzt wurde und dass das 3-Bromchinolin in Beispiel 178
durch 1-(4-Iodphenyl)pyrrol
ersetzt wurde, wurde die Titelverbindung hergestellt. MS m/e 780
(M+H)+. Hochauflösungs-FAB-MS: berechnet m/e
für (M+H)+ von C43H61N3O10:
780,4430; gefunden: 780,4424.
-
Beispiel 283
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-(6-Methoxy-2-naphthyl)
-
Gemäß den Verfahren
von Beispiel 178, außer
dass die 2'-acetylierte
Verbindung in Beispiel 177 durch die 2'-benzoylierte Verbindung in Beispiel
102, Schritt c, ersetzt wurde und dass das 3-Bromchinolin in Beispiel 178
durch 2-Brom-6-methoxynaphthalen
ersetzt wurde, wurde die Titelverbindung hergestellt. MS m/e 795 (M+H)+. Hochauflösungs-FAB-MS: berechnet m/e
für (M+H)+ von C44H62N2O11:
795,4426; gefunden: 795,4426.
-
Beispiel 284
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-(3,5-Dichlorphenyl)
-
Gemäß den Verfahren
von Beispiel 178, außer
dass die 2'-acetylierte
Verbindung in Beispiel 177 durch die 2'-benzoylierte Verbindung in Beispiel
102, Schritt c, ersetzt wurde und das 3-Bromchinolin in Beispiel
178 durch 1,3-Dichlor-5-iodbenzen
ersetzt wurde, wurde die Titelverbindung hergestellt. MS m/e 783
(M+H)+. Hochauflösungs-FAB-MS: berechnet m/e
für (M+H)+ von C39H57Cl2N2O10: 783,3390; gefunden: 783,3392.
-
Beispiel 285
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2-(3-Iodphenyl)
-
Gemäß den Verfahren
von Beispiel 1, Schritte a-f, außer dass das Allylbromid in
Beispiel 1, Schritt a, durch das 3-Iodbenzylbromid ersetzt wurde, um die
Verbindung 9 aus Schema 1b herzustellen, worin R 3-Iodphenylmethyl
ist und Rp Benzoyl ist, und durch anschließende Behandlung
der Verbindung gemäß den Verfahren
in Beispiel 102 wurde die Titelverbindung hergestellt. MS m/e 815
(M+H)+.
-
Beispiel 286
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2-(3-(2-Furanyl)phenyl)
-
Gemäß den Verfahren
von Beispiel 266, außer
dass die Verbindung in Beispiel 265 durch die Verbindung in Beispiel
285 ersetzt wurde, wurde die Titelverbindung hergestellt. MS m/e
689 (M+H)+.
-
Beispiel 287
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-(6-Hydroxy-2-naphthyl)
-
Gemäß den Verfahren
von Beispiel 178, außer
dass die 2'-acetylierte
Verbindung in Beispiel 177 durch die 2'-benzoylierte Verbindung in Beispiel
102, Schritt c, ersetzt wird und das 3-Bromchinolin in Beispiel
178 durch 6-Brom-2-naphthol
ersetzt wurde, wurde die Titelverbindung hergestellt. MS m/e 781
(M+H)+.
-
Beispiel 288
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-(6-(2-Bromethoxy)-2-naphthyl)
-
Gemäß den Verfahren
von Beispiel 178, außer
dass das 3-Bromchinolin
in Beispiel 178 durch 6-Brom-2-(2-bromethoxy) naphthalen ersetzt
wurde, wurde die Titelverbindung hergestellt. MS m/e 887 (M+H)+.
-
Beispiel 289
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-(6-(2-Tetrazolyl)ethoxy-2-naphthyl)
-
Zu
einer Probe der Verbindung aus Beispiel 288 (371 mg, 0, 4 mmol)
in Acetonitril (4 ml) wurden Tetrazol (138 mg, 2 mmol) und Triethylamin
(0,556 ml, 4 mmol) gegeben, und die Mischung wurde über Nacht bei
60°C unter
Stickstoff erhitzt. Die flüchtigen
Bestandteile wurden unter Vakuum entfernt, und der Rückstand wurde
in Ethylacetat aufgelöst.
Diese Lösung
wurde mit 5% wässerigem
Natriumbicarbonat und Salzlösung gewaschen,
getrocknet (Na2SO4)
und konzentriert. Der Rückstand
wurde durch Chromatographie auf Silikagel gereinigt, unter Eluierung
mit 97:3:0,5 Dichlormethan/Methanol/Ammoniumhydroxid. Dieses Produkt
wurde bei Raumtemperatur 2 Tage lang in Methanol gerührt, dann
wurde das Produkt durch Chromatographie auf Silikagel gereinigt,
unter Eluierung mit 99:1:0,5 Dichlormethan/Methanol/Ammoniumhydroxid.
MS m/e 877 (M+H)+.
-
Beispiel 290
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH2, R ist -CH2CH=CH-Naphthyl
-
Gemäß den Verfahren
von Beispiel 178, außer
dass das 3-Bromchinolin
in Beispiel 178 durch 1-Bromnaphthalen ersetzt wurde, wurde die
Titelverbindung hergestellt. MS m/e xxx (M+H)+.
-
Beispiel 291
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2-C=C-(2-Phenylethenyl)
-
Gemäß dem Verfahren
von Beispiel 247, außer
dass 3-Bromchinolin
durch Beta-Bromstyren ersetzt wurde. MS (ESI) m/e 739 (M+H)+.
-
Beispiel 292
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2-CH=CH-(5-(3-Isoxazolyl)-2-thiophenyl
-
Schritt 292a. Verbindung
37 aus Schema 7, worin RBB OH ist
-
Zu
11,8 ml (11,8 mmol) Boran-THF-Komplex (1 molare Lösung in
Tetrahydrofuran) bei -10°C
wurde 2-Methyl-2-buten (2,7 ml, 24mmol) gegeben. Die Reaktion wurde
2 Stunden lang bei 0°C
gerührt,
und eine separat hergestellte Lösung,
welche die Verbindung aus Beispiel 246, Schritt h (Verbindung 6E
aus Schema 1c; Rp ist Acetyl, R ist -CH2-C≡C-H, 2
g, 2,95 mmol) in 10 ml Tetrahydrofuran enthielt, wurde dann in einer Portion
hinzugefügt.
Die Reaktion wurde bei 0°C
1 Stunde lang gerührt
und auf Raumtemperatur erwärmt. Nach
3 Stunden wurde die Reaktion erneut auf 0°C gekühlt, und 5% wässeriges
Natriumcarbonat wurde hinzugegeben. Die Mischung wurde mit Ethylacetat
extrahiert, und die organischen Schichten wurden mit Salzlösung gewaschen
und über
Magnesiumsulfat getrocknet. Konzentration und Trocknen in vacuo
ergab 3,6 Gramm Rohprodukt, das mit Silikagelchromatographie unter
Eluierung mit Aceton/Hexanen (1:1) gereinigt wurde, um die Titelverbindung
(0,85 g, 40%) zu ergeben.
-
Schritt 292b. Verbindung
mit der Formel (IX): L ist CO, T ist NH, Rc ist Acetyl, R ist -CH2-CH=CH-(5-(3-Isoxazolyl)-2-thiophenyl)
-
Ein
mit einem Rührstab
ausgestattetes Druckrohr wurde mit 100 mg (0,138 mmol) der aus Schritt
292a resultierenden Verbindung, Kaliumcarbonat (42 mg, 0,3 mmol),
2-Brom-5-(isoxazol-3-yl)thiophen
(48 mg, 0,21 mmol), Palladium(II)acetat (0,15 mg, 0,7 mmol), 0,75
ml Aceton und 0,75 ml Wasser geladen. Zwei Gefrier-Pump-Tau-Zyklen
wurden durchgeführt,
um die Reaktion zu entgasen. Das Reaktionsrohr wurde dann unter Stickstoff
versiegelt und bei 65°C
2 Stunden lang erhitzt. Die Mischung wurde mit Ethylacetat verdünnt und nacheinander
mit Wasser und danach Salzlösung
gewaschen. Organische Extrakte wurden über Magnesiumsulfat getrocknet,
in vacuo konzentriert und mit Hochvakuum auf konstantes Gewicht
getrocknet, um 140 mg des Rohprodukts zu ergeben.
-
Schritt 292c. Verbindung
mit der Formel (IX): L ist CO, T ist NH, R ist -CH2-CH=CH-(5-(3-Isoxazolvl)-2-thiophenyl)
-
Die
aus Schritt 292b resultierende Verbindung (140 mg) wurde in 5 ml
Methanol aufgelöst,
und die Lösung
wurde bei Raumtemperatur 20 Stunden lang gerührt. Die Lösung wurde in vacuo konzentriert
und auf konstantes Gewicht getrocknet. Das Rohprodukt wurde mit
Silikagelchromatographie unter Eluierung mit 98:1:1 Dichlormethan/Methanol/Ammoniumhydroxid
gereinigt, um 34 mg der Titelverbindung zu ergeben. Hochauflösungs-FAB-MS:
berechnet m/e für
(M+H)+: C40H58N3O11S:
788,3792 Beobachtet: 788,3809.
-
Beispiel 293
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2-CH=CH-(1,3-Dimethyl-2,4-dioxo-5-pyrimidinyl)
-
Gemäß den Verfahren
von Beispiel 292, außer
dass 2-Brom-5-(isoxazol-3-yl)thiophen
durch 5-Brom-1,3-dimethyluracil ersetzt wurde, wurde die Titelverbindung
hergestellt. Hochauflösungs-FAB-MS:
berechnet m/e für
(M+H)+: C39H61N4O12:
777,4286. Beobachtet m/e: 777,4291
-
Beispiel 294
-
Verbindung mit der Formel
(IX): L ist CO, T ist NH, R ist -CH2-CH=CH-(5-(2-Pyridyl)aminocarbonyl-2-furanyl)
-
Gemäß den Verfahren
von Beispiel 292, außer
dass 2-Brom-5-(isoxazol-3-yl)thiophen
durch 5-Brom-furan-2-carbonsäurepyridin-2-yl-amid
ersetzt wurde, wurde die Titelverbindung hergestellt. MS (ESI)+:(M+H)+ @ m/e 825.