詳細な説明
本明細書では、少なくとも1つの標的リガンドコグネイト結合パートナー(カウンター構造体リガンドタンパク質とも呼ばれる)に対する変化した結合活性または親和性を示すCD80及びその特異的結合断片のバリアントまたは変異体であるか、それらを含有する免疫調節タンパク質が提供される。いくつかの実施形態では、バリアントCD80ポリペプチドは、非改変または野生型CD80ポリペプチドと比較して1つまたは複数のアミノ酸改変(例えば、アミノ酸置換、欠失、または付加)を含有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、非改変または野生型CD80ポリペプチドと比較して1つまたは複数のアミノ酸改変(例えば、置換)を含有する。いくつかの実施形態では、1つまたは複数のアミノ酸改変は、非改変または野生型CD80ポリペプチドのIgSFドメイン(例えば、IgV)においてである。
いくつかの実施形態では、結合親和性及び/または結合選択性などの結合活性の変化、例えば、結合親和性または選択性の増加または減少は、少なくとも1つの結合パートナータンパク質CD28、PD−L1、またはCTLA−4に対する。いくつかの実施形態では、バリアントCD80ポリペプチドは、1つまたは複数の改変を含まない、非改変または野生型CD80と比較して、CD28、PD−L1、またはCTLA−4のうちの1つまたは複数に対する結合活性または親和性の増加または減少などの変化を示す。
いくつかの実施形態では、バリアントCD80ポリペプチドは、1つまたは複数の改変を含まない、非改変または野生型CD80と比較して、CTLA−4及び/またはPD−L1に対して増加した結合親和性を示す。いくつかの実施形態では、バリアントCD80ポリペプチドは、1つまたは複数の改変を含まない、非改変または野生型CD80と比較して、CD28に対して減少した結合親和性を示す。いくつかの実施形態では、バリアントCD80ポリペプチドは、1つまたは複数の改変を含まない、非改変または野生型CD80と比較して、CTLA−4及びPD−L1の一方または両方に対する結合親和性の増加、ならびにCD28に対する結合親和性の減少を示す。
いくつかの実施形態では、本明細書で提供されるバリアントCD80ポリペプチドは、1つまたは複数の改変を含まない、非改変または野生型CD80の、CD28と比べたCTLA−4への結合の選択性と比較して、CD28と比べたCTLA−4への結合の選択性の増加を示す。選択性の増加は、非改変または野生型CD80の、CTLA−4への結合の、CD28への結合に対する比率、例えば結合親和性の比率と比較した、バリアントCD80ポリペプチドの、CTLA−4への結合の、CD28への結合に対するより大きな比率、例えば結合親和性のより大きな比率として特徴付けることができる。いくつかの実施形態では、比率は、1.2倍、1.5倍、2.0倍、3.0倍、4.0倍、5.0倍、6.0倍、7.0倍、8.0倍、9.0倍、10.0倍、15.0倍、20倍、30倍、40倍、50倍、100倍もしくはそれ以上大きく、または約1.2倍、約1.5倍、約2.0倍、約3.0倍、約4.0倍、約5.0倍、約6.0倍、約7.0倍、約8.0倍、約9.0倍、約10.0倍、約15.0倍、約20倍、約30倍、約40倍、約50倍、約100倍もしくはそれ以上大きく増加する。
いくつかの実施形態では、本明細書で提供されるバリアントCD80ポリペプチドは、1つまたは複数の改変を含まない、非改変または野生型CD80の、CD28と比べたPD−L1への結合の選択性と比較して、CD28と比べたPD−L1への結合の選択性の増加を示す。選択性の増加は、非改変または野生型CD80の、PD−L1への結合の、CD28への結合に対する比率、例えば結合親和性の比率と比較した、バリアントCD80ポリペプチドの、PD−L1への結合の、CD28への結合に対するより大きな比率、例えば結合親和性のより大きな比率として特徴付けることができる。いくつかの実施形態では、比率は、1.2倍、1.5倍、2.0倍、3.0倍、4.0倍、5.0倍、6.0倍、7.0倍、8.0倍、9.0倍、10.0倍、15.0倍、20倍、30倍、40倍、50倍、100倍もしくはそれ以上大きく、または約1.2倍、約1.5倍、約2.0倍、約3.0倍、約4.0倍、約5.0倍、約6.0倍、約7.0倍、約8.0倍、約9.0倍、約10.0倍、約15.0倍、約20倍、約30倍、約40倍、約50倍、約100倍もしくはそれ以上大きく増加する。
いくつかの実施形態では、免疫調節タンパク質は、可溶性である。いくつかの実施形態では、免疫調節タンパク質は、細胞の表面に発現できる膜貫通型免疫調節タンパク質である。いくつかの実施形態では、免疫調節タンパク質は、それが発現される細胞から分泌されることができる分泌可能な免疫調節タンパク質である。いくつかの実施形態では、本明細書で提供されるバリアントCD80ポリペプチド及び1つまたは複数の他の部分またはポリペプチドを含有するコンジュゲートまたは融合体である1つまたは複数の他の免疫調節タンパク質も本明細書において提供される。いくつかの態様では、膜貫通型免疫調節タンパク質または分泌可能な免疫調節タンパク質を含有する操作された細胞が提供される。いくつかの態様では、感染性物質であって、発現のために膜貫通型免疫調節タンパク質または分泌可能な免疫調節タンパク質を感染性物質が感染する細胞に送達できる感染性物質が提供される。いくつかの実施形態では、本明細書で提供されるバリアントCD80ポリペプチド及び1つまたは複数の他の部分またはポリペプチドを含有するコンジュゲートまたは融合体である1つまたは複数の他の免疫調節タンパク質も本明細書において提供される。
いくつかの実施形態では、バリアントCD80ポリペプチド及び免疫調節タンパク質は、免疫応答の増加または減少などの免疫学的免疫応答を調節する。いくつかの実施形態では、本明細書で提供されるバリアントCD80ポリペプチド及び免疫調節タンパク質は、免疫応答の調節不全に関連する疾患または状態の治療に使用することができる。
いくつかの実施形態では、提供されるバリアントCD80ポリペプチドは、共刺激シグナル伝達分子との相互作用を介してT細胞の活性化、拡大、分化、及び生存を調節する。概して、抗原特異的T細胞の活性化には、一般的に2つの異なるシグナルが必要である。第1のシグナルは、抗原提示細胞(APC)上に存在する主要組織適合複合体(MHC)関連抗原とT細胞受容体(TCR)の相互作用によって提供される。第2のシグナルは、TCR関与に対する共刺激、例えばCD28共刺激シグナルであり、T細胞のアポトーシスまたはアネルギーを避けるために必要である。
いくつかの実施形態では、通常の生理的条件下では、T細胞媒介性免疫応答は、T細胞受容体(TCR)による抗原認識によって開始され、共刺激シグナル及び阻害性シグナルのバランスによって調節される(例えば、免疫チェックポイントタンパク質)。免疫システムは、免疫チェックポイントに依存して自己免疫(すなわち、自己寛容)を防ぎ、免疫応答時、例えば病原性感染に対する攻撃時に過度の損傷から組織を保護する。しかしながら、場合によっては、これらの免疫調節タンパク質は、免疫系を回避するためのメカニズムとして、腫瘍を含む疾患及び状態で調節不全になり得る。
いくつかの実施形態では、既知のT細胞共刺激受容体の中にはCD28があり、これは、APCに両方とも存在するリガンドB7−1(CD80)及びB7−2(CD86)のT細胞共刺激受容体である。これらの同じリガンドは、CD28よりも高い親和性で阻害性T細胞受容体CTLA4(細胞傷害性Tリンパ球関連タンパク質4)にも結合できる;CTLA4への結合は、免疫応答を下方調節するように作用する。
いくつかの実施形態では、CD80は、プログラム死リガンド1(PD−L1)に結合することができる。CD80は、CD28に関してPD−L1と同様の親和性を有する。PD−L1は、阻害性免疫受容体、プログラム死1(PD−1)の2つのリガンドの1つである。PD−L1とPD−1の相互作用は、T細胞の不活性化を促進し、T細胞の活性を下方調節することにより、免疫活性を負に調節する。T細胞のPD−1発現は、T細胞の過剰活性を防ぐ戦略として、T細胞が活性化された後に誘導され得る。多くの腫瘍細胞は表面にPD−L1を発現し、潜在的にPD−1/PD−L1相互作用、及び腫瘍に対するT細胞応答の阻害をもたらす。CD80のPD−L1への結合は、PD−L1とPD−1の間の相互作用を遮断でき、これにより、例えば腫瘍部位でのT細胞応答の阻害を防ぎ、免疫応答を効果的に増強または高める。しかしながら、同時に、CD80はまた、CD28またはCTLA4受容体に結合し、T細胞応答の誘導または阻害に関与する可能性もあり得る。したがって、場合によっては、CD80と、PD−L1、CD28、及びCTLA−4との相互作用により、重複した補完的な効果を得ることができる。いくつかの実施形態では、CD28及びPD−L1は、免疫応答のモデリングにおいて補完的な役割を果たす可能性がある。
いくつかの実施形態では、提供されるバリアントCD80ポリペプチドまたは免疫調節タンパク質は、阻害性受容体CTLA−4、PD−L1/PD−1負の調節複合体及び/または共刺激受容体CD28によって誘導またはこれらと関連する免疫学的活性を調節する(例えば、増加または減少させる)。例えば、いくつかの実施形態では、提供されるCD80ポリペプチド、例えば、本明細書で提供されるバリアントCD80ポリペプチドの可溶性形態は、CTLA−4阻害性受容体と結合し、APC上で発現されるCD80とのその相互作用を遮断し、これにより、図2に示すように、CD80が結合したCTLA−4受容体の負の調節シグナル伝達を防ぐ。いくつかの実施形態では、提供されるCD80ポリペプチド、例えば、本明細書で提供されるバリアントCD80ポリペプチドの可溶性形態は、腫瘍細胞またはAPC上のPD−L1と結合することができ、これにより、PD−L1とPD−1阻害性受容体の相互作用を遮断し、これにより、さもなければPD−L1/PD−1相互作用から得られたであろう負の調節シグナル伝達を防ぐ。いくつかの実施形態では、提供されるCD80ポリペプチド、例えば、本明細書で提供されるバリアントCD80ポリペプチドの可溶性形態は、PD−L1/PD−1相互作用を遮断しながら、局在化したT細胞上のCD28受容体と結合及びそれを共刺激し、これにより、免疫応答を促進する(図3A)。いくつかの実施形態では、提供されるCD80ポリペプチド、例えば、本明細書で提供されるバリアントCD80ポリペプチドの可溶性形態は、B7/CTLA−4結合に拮抗することができ、CTLA−4阻害性シグナル伝達を防止し、TCRシグナル伝達閾値を低下させ、これにより、T細胞活性化及び免疫応答を促進する(図3B)。いくつかの実施形態では、提供されるCD80バリアントポリペプチドは、免疫活性をさらに調節するために他の免疫調節ポリペプチドとスタックもしくは結合することができる(図4)、または免疫活性を局在化するために標的分子と束ねるもしくはコンジュゲートとすることができる(図5及び図7)。したがって、いくつかの実施形態では、提供されるポリペプチドは、CTLA−4及び/またはPD−L1の両方、場合によっては、CD28に独立した結合親和性を持つバリアントCD80を提供することにより、これらの制約を克服し、これにより、受容体による共刺激の補完的効果を作動させるか、または拮抗させる。これらのバリアントCD80の作製及び使用方法も提供される。
また、提供されるバリアントポリペプチドの様々なフォーマットも提供される。本明細書に示されるように、別のフォーマットは、免疫応答の操作を促すことができ、したがって治療的に応用される。状況に応じてバリアントポリペプチドを様々な構成のフォーマットとし、免疫応答に拮抗またはこれを作動させる能力は、結合パートナーに対するバリアントCD80の同じ増加した結合及び活性に基づいて治療用途に柔軟性をもたらす。一例として、バリアントCD80タンパク質を表面につなぐと、局所化された共刺激シグナルを伝達できるが、他の場合、非局在化可溶性形態でCD80を提示すると、拮抗的活性が付与される。例えば、CTLA−4及び/またはPD−L1への親和性が増加した可溶性フォーマットでの増強したCD80タンパク質の送達は、活性化刺激、例えば、CD3及び/またはCD28共刺激シグナルまたは分裂促進シグナルに対する応答を減少させるために起こり得る細胞内の阻害性シグナルを遮断するなど、阻害性受容体のシグナル伝達に拮抗することができる。場合によっては、この結果、免疫応答が増加する可能性がある。
加えて、ある種のフォーマットは、場合によっては、CD28作動作用を媒介することもできる。場合によっては、CD28作動作用は、PD−L1への結合の増加を示すある特定のバリアントCD80ポリペプチドによって媒介され、これによりCD28との相互作用のための免疫シナプス表面へのバリアントCD80分子のつなぎまたは架橋を促し、これにより共刺激シグナルをもたらすことにより、T細胞の活性化を促進する。PD−L1依存性CD28共刺激と本明細書で呼ばれるこの活性は、いくつかの態様では、バリアントCD80ポリペプチドが非競合的様式で及び/またはバリアントCD80ポリペプチドの二量体フォーマットを提供することによって(例えば図3を参照)PD−L1及びCD80の両方と結合する能力による。場合によっては、このようなPD−L1依存性共刺激は、エフェクター機能を備えたFcを必要とせず、エフェクターなし、または不活性なFc分子を含有するFc融合タンパク質によって媒介され得る。いくつかの態様では、これに加えてまたはこれに代えて、つなぎまたは架橋も、バリアントCD80ポリペプチドがエフェクター機能を保持または示す免疫グロブリンの野生型Fc領域との融合タンパク質として提供される場合、Fc受容体を介して達成することができ、本明細書ではFc受容体依存性CD28共刺激と呼ばれる。いくつかの態様では、Fc受容体の架橋により抗体依存性細胞傷害(ADCC)媒介性エフェクター機能が開始され得、これにより、CTLA−4発現細胞(例えばCTLA−4発現T制御性細胞)またはPD−L1発現細胞(例えばPD−L1hi腫瘍)などのコグネイト結合パートナーを発現する標的細胞の枯渇をもたらす。
これらの受容体の活性の増強または抑制は、炎症性及び自己免疫性障害、がん、及びウイルス感染の処置に臨床的意義を有する。しかしながら、場合によっては、両方の受容体の共刺激効果に介入してそれを変化させる治療法は、免疫学的シナプスの範囲によって課される空間配向要件に加えてサイズ制限によって制約される。いくつかの態様では、抗体薬を含む既存の治療薬は、これらの相互作用の調節に関与する複数の標的タンパク質と同時に相互作用できない場合がある。加えて、場合によっては、既存の治療薬は、免疫応答に拮抗するだけで、作動させる能力を持たない場合がある。加えて、これら2つの受容体の一方または他方を独立して標的とする薬物間の薬物動態の違いは、治療の過程を通してそのような薬物の組み合わせの所望の血中濃度を適切に維持するのに困難をもたらし得る。提供されるバリアントCD80ポリペプチド及び免疫調節タンパク質、及び記載される他のフォーマットは、そのような問題に対処する。
本明細書で言及される特許、特許出願科学論文及びデータベースを含む全ての出版物は、特許、特許出願、科学論文またはデータベースを含む個々の出版物が参照によって組み込まれると具体的にかつ個別に示されるのと同程度に、あらゆる目的のためにそれら全体が参照によって本明細書に組み込まれる。本明細書に記載の定義が、参照により本明細書に組み込まれる特許、出願、公開出願、及び他の出版物に記載の定義に反する、または矛盾する場合、本明細書に記載の定義は、参照により本明細書に組み込まれる定義に優先する。
本明細書において使用されるセクションの見出しは、単に構成を目的としたものであって、記載される主題を限定するものと解釈されるべきではない。
I.定義
別段の定義のない限り、本明細書において使用される全ての専門用語、表記、ならびに他の技術及び科学用語または術語は、請求される主題が属する技術分野の当業者によって通常理解されているものと同じ意味を有することを意図する。場合によっては、通常理解されている意味を有する用語は、明確化のため及び/またはすぐに参照できるように本明細書において定義され、そして本明細書におけるこのような定義の包含は、必ずしも一般的に当技術分野において理解されているものと大きな差異をなすと解釈されるべきではない。
本明細書を通して使用される用語は、特定の事例において別段限定されない限り、以下のとおり定義される。本明細書及び添付の特許請求の範囲において使用される場合、単数形の「1つの(a)」、「1つの(an)」、及び「その(the)」は、文脈上、別段の明確な指示がない限り、複数形の指示対象を含む。別段の定義のない限り、本明細書において使用される全ての技術及び科学用語、頭字語、ならびに略語は、本発明が属する技術分野の当業者によって通常理解されているものと同じ意味を有する。別段の指示のない限り、化学名及び生化学名の略称及び記号は、IUPAC−IUB命名法による。別段の指示のない限り、全ての数値範囲は、その範囲を規定する値だけでなくその間の全ての整数値も含む。
「親和性が改変された(親和性改変)」という用語は、免疫グロブリンスーパーファミリードメインの文脈において使用される場合、親の野生型または非改変の(すなわち、非親和性改変)IgSF対照ドメインと比較してそのコグネイト結合パートナー(あるいは「カウンター構造体」)のうちの少なくとも1つに対する結合親和性または結合活性が増加または減少するように変化したアミノ酸配列(対応する野生型の親または非改変IgSFドメインと比べて)を有する哺乳動物免疫グロブリンスーパーファミリー(IgSF)ドメインを意味する。この文脈では、親和性改変CD80 IgSFドメインが含まれる。いくつかの実施形態では、親和性改変IgSFドメインは、野生型または非改変IgSFドメイン中に1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、または以上のアミノ酸差異、例えばアミノ酸置換を含有することができる。結合親和性または結合活性の増加または減少は、フローサイトメトリーなどの周知の結合アッセイを使用して決定することができる。Larsen et al.,American Journal of Transplantation,Vol 5:443−453(2005)。Linsley et al.,Immunity,Vol 1(9:793−801(1994)も参照のこと。タンパク質のそのコグネイト結合パートナー(複数可)に対する結合親和性または結合活性の増加は、野生型IgSFドメイン対照よりも少なくとも10%大きい値となり、いくつかの実施形態では、野生型IgSFドメイン対照値よりも少なくとも20%、30%、40%、50%、100%、200%、300%、500%、1000%、5000%、または10000%大きい値となる。タンパク質のそのコグネイト結合パートナーのうちの少なくとも1つに対する結合親和性または結合活性の減少は、対照の90%以下であるが野生型IgSFドメイン対照値の10%以上の値となり、いくつかの実施形態では、野生型IgSFドメイン対照値の80%、70%、60%、50%、40%、30%、または20%以下であるが10%以上の値となる。親和性改変タンパク質は、アミノ酸残基の置換、付加、または欠失によって一次アミノ酸配列が変化している。「親和性改変IgSFドメイン」という用語は、親和性改変IgSFドメインが作製される、いかなる特定の出発組成物または方法のいかなる条件も課すものと解釈されるべきではない。したがって、本発明の親和性改変IgSFドメインは、任意の特定の親和性改変プロセスによって親和性改変IgSFドメインへと変換された野生型IgSFドメインに限定されない。親和性改変IgSFドメインポリペプチドは、例えば、野生型哺乳動物IgSFドメイン配列情報から開始して生成され、次いで、そのコグネイト結合パートナーに対する結合性についてin silicoでモデル化され、そして最後に組換えまたは化学合成されて、主題の親和性改変IgSFドメイン組成物を得ることができる。しかし別の一例では、親和性改変IgSFドメインは、野生型IgSFドメインの部位特異的変異誘発によって作製することができる。したがって、親和性改変IgSFドメインは、産物を意味するが、必ずしもいずれかの所与のプロセスによって産生される産物を意味するわけではない。組換え法、化学合成、またはその組み合わせを含む多種多様な技術を用いてもよい。
「同種(の)」という用語は、本明細書において使用される場合、ある生物から取り出され、次いで同じ種の遺伝的に異なる生物に注入または養子移入される、細胞または組織を意味する。本発明のいくつかの実施形態では、種は、ネズミまたはヒトである。
「自家(の)」という用語は、本明細書において使用される場合、同じ生物から取り出され、後に該生物に注入または養子移入される、細胞または組織を意味する。自家の細胞または組織を、例えば、組換えDNA法によって、生物から取り出される天然の細胞または天然の組織とはもはや遺伝的に同一ではないように変化させることができる。例えば、天然の自家T細胞を、膜貫通型免疫調節タンパク質及び/またはキメラ抗原受容体(CAR)を発現する自家の操作された細胞となるように組換えDNA技術によって遺伝子操作することができ、これは、場合によっては、T細胞またはTIL(腫瘍浸潤リンパ球)を操作することを伴う。次いで、操作された細胞を、天然のT細胞が単離された患者へ注入する。いくつかの実施形態では、生物は、ヒトまたはネズミである。
「結合親和性」及び「結合活性」という用語は、本明細書において使用される場合、それぞれ、特異的結合条件下での、あるタンパク質のそのカウンター構造体に対する、特異的結合親和性及び特異的結合活性を意味する。生化学動態では、結合活性は、CD80とそのカウンター構造体PD−L1、CD28、及び/またはCTLA−4との間のような、個々の非共有結合相互作用の複数の親和性の累積強度を指す。そのため、結合活性は、単一の相互作用の強度を表す親和性とは異なる。親和性が改変されたCD80 IgSFドメインを含有するバリアントCD80のそのカウンター構造体に対する結合親和性の増加または減弱化は、非改変CD80(例えば、天然または野生型IgSFドメイン(例えばIgVドメイン)を含有する非改変CD80)の結合親和性と比較して決定される。結合親和性または結合活性を決定するための方法は、当技術分野において公知である。例えば、Larsen et al.,American Journal of Transplantation,Vol 5:443−453(2005)を参照のこと。いくつかの実施形態では、バリアントCD80(例えば、親和性改変IgSFドメインを含有する)は、フローサイトメトリーによって測定され、実施例6に記載される結合アッセイにおいて非改変CD80対照よりも少なくとも10%、20%、30%、40%、50%、60%、70%、80%、90%、または100%より大きい平均蛍光強度(MFI)値をもたらす結合親和性でCD28、PD−L1、及び/またはCTLA−4に特異的に結合する。
「生物学的半減期」という用語は、ある物質(例えば、本発明のバリアントCD80ポリペプチドを含有する免疫調節ポリペプチド)が、その薬理学的もしくは生理学的活性または濃度の半分を喪失するのに要する時間を指す。生物学的半減期は、物質の排除、排出、分解(例えば、酵素的)、または体の特定の臓器もしくは組織における吸収及び濃縮によって影響を受け得る。いくつかの実施形態では、生物学的半減期は、物質の血漿中濃度がその定常状態レベルの半分に達するのに要する時間(「血漿半減期」)を決定することによって評価することができる。本発明のポリペプチドを誘導体化してその生物学的半減期を延長するために使用することができるコンジュゲートは、当技術分野において公知であり、限定されないが、ポリエチレングリコール(PEG)、ヒドロキシエチルデンプン(HES)、XTEN(伸長組換えペプチド;WO2013130683を参照のこと)、ヒト血清アルブミン(HSA)、ウシ血清アルブミン(BSA)、脂質(アシル化)、及びポリ−Pro−Ala−Ser(PAS)、ポリグルタミン酸(グルタミル化)を含む。
「キメラ抗原受容体」または「CAR」という用語は、本明細書において使用される場合、少なくともエクトドメイン、膜貫通、及びエンドドメインを含む、哺乳動物細胞上に発現する人工の(すなわち、人造の)膜貫通型タンパク質を指す。任意で、CARタンパク質は、エクトドメインを膜貫通ドメインに共有結合的に連結する「スペーサー」を含む。スペーサーは、多くの場合、ペプチド結合を介してエクトドメインを膜貫通ドメインに連結するポリペプチドである。CARは、典型的には、哺乳動物リンパ球上に発現する。いくつかの実施形態では、CARは、T細胞または腫瘍浸潤リンパ球(TIL)などの哺乳動物細胞上に発現する。T細胞上に発現するCARは、本明細書において「CAR T細胞」または「CAR−T」と称される。いくつかの実施形態では、CAR−Tは、ヘルパーT細胞、細胞傷害性T細胞、ナチュラルキラーT細胞、メモリーT細胞、制御性T細胞、またはγδT細胞である。例えば養子細胞移入において臨床的に使用される場合、患者の腫瘍に対する抗原結合特異性を有するCAR−Tは、典型的には、患者から得られる天然T細胞上に発現するように操作されている。CARを発現する操作されたT細胞は、次いで注入により患者に戻される。したがって、CAR−Tは、多くの場合、自家CAR−Tではあるが、同種CAR−Tも本発明の範囲内に含まれる。CARのエクトドメインは、生理的条件下で標的抗原(例えば、腫瘍特異的抗原)と特異的に結合する抗原結合領域(例えば、抗体またはその抗原結合断片(例えば、scFv))を含有する。特異的に結合すると、一連の生化学的事象(すなわち、シグナルトランスダクション)は、CAR−Tの免疫活性の調節をもたらす。したがって、例えば、CAR−Tの抗原結合領域によるその標的抗原への特異的結合によって、細胞傷害性、増殖、またはサイトカイン産生の変化によって反映されるように、T細胞活性の免疫活性の変化を導くことができる。いくつかの実施形態では、CAR−T活性化によるシグナルトランスダクションは、天然の哺乳動物T細胞におけるシグナルトランスダクションに関与するCD3ζ鎖(「CD3−z」)によって達成される。CAR−Tは、T細胞の免疫調節応答をさらに調節する複数のシグナル伝達ドメイン(例えば、CD28、41BB、またはOX40)をさらに含有することができる。CD3−zは、T細胞受容体シグナルトランスダクションに関与する免疫受容体チロシン活性化モチーフ(ITAM)として知られている保存されたモチーフを含有する。
「総合して」または「総合的」という用語は、in vitroアッセイにおいて2つ以上のバリアントCD80ポリペプチドの存在によって誘導されるサイトカイン産生に関して使用される場合、個々のバリアントCD80ポリペプチドによって誘導されるサイトカイン産生に関係なく、サイトカイン発現レベル全体を意味する。いくつかの実施形態では、アッセイされるサイトカインは、例えば実施例7に記載されるin vitro初代T細胞アッセイにおけるIFN−γである。
「コグネイト結合パートナー」という用語(「カウンター構造体」と互換的に使用される)は、ポリペプチド(例えば、バリアントCD80のIgSFドメイン)に関して、言及されているポリペプチドが特異的結合条件下で特異的に結合する少なくとも1つの分子(典型的には、天然の哺乳動物タンパク質)を指す。いくつかの態様では、親和性改変IgSFドメインを含有するバリアントCD80は、対応する天然または野生型CD80のカウンター構造体に特異的に結合するが、増加または減弱化した親和性で結合する。特異的結合条件下で認識されてそのコグネイト受容体に特異的に結合するリガンドの一種は、その受容体のカウンター構造体またはコグネイト結合パートナーの一例である。「細胞表面コグネイト結合パートナー」は、哺乳動物細胞表面上に発現するコグネイト結合パートナーである。「細胞表面分子種」は、免疫学的シナプス(IS)を形成する細胞(例えば、哺乳動物細胞)上に発現する及び該細胞によって発現する、免疫学的シナプスのリガンドのコグネイト結合パートナーである。
本明細書において使用される場合、「コンジュゲート」、「コンジュゲーション」またはそれらの文法上の変形は、当技術分野において公知の任意の接続または連結法によって、2つ以上の化合物を一緒に接続または連結して、別の化合物の形成をもたらすことを指す。それはまた、2つ以上の化合物を一緒に接続または連結することによって生成される化合物を指すこともできる。例えば、1つまたは複数の化学部分またはポリペプチドに直接的または間接的に連結されたバリアントCD80ポリペプチドが例示的なコンジュゲートである。そのようなコンジュゲートは、融合タンパク質、化学的コンジュゲートによって産生されるもの、及び任意の他の方法によって産生されるものを含む。
「競合的結合」という用語は、本明細書において使用される場合、あるタンパク質が、少なくとも2種のコグネイト結合パートナーに特異的に結合することができるが、1つのコグネイト結合パートナーの特異的結合が第2のコグネイト結合パートナーの同時結合を阻害する(例えば、防止するまたは妨げる)ことを意味する。したがって、場合によっては、あるタンパク質は、2つのコグネイト結合パートナーに同時に結合することはできない。一般的に、競合結合物は、特異的結合のための同じまたは重複した結合部位を含有するが、これは必須要件ではない。いくつかの実施形態では、競合的結合は、第2のコグネイト結合パートナーの特異的結合に起因して、そのコグネイト結合パートナーの1つへのタンパク質の特異的結合の測定可能な(部分的または完全な)阻害を引き起こす。ELISA(酵素結合免疫吸着アッセイ)アッセイなどの競合的結合を定量する多種多様な方法が公知である。
「保存的アミノ酸置換」という用語は、本明細書において使用される場合、あるアミノ酸残基が類似の化学特性(例えば、電荷または疎水性)を備える側鎖R基を有する別のアミノ酸残基によって置換されている、アミノ酸置換を意味する。類似の化学特性を備える側鎖を有するアミノ酸の群の例としては、1)脂肪族側鎖:グリシン、アラニン、バリン、ロイシン、及びイソロイシン、2)脂肪族−ヒドロキシル側鎖:セリン及びスレオニン、3)アミド含有側鎖:アスパラギン及びグルタミン、4)芳香族側鎖:フェニルアラニン、チロシン、及びトリプトファン、5)塩基性側鎖:リジン、アルギニン、及びヒスチジン、6)酸性側鎖:アスパラギン酸及びグルタミン酸、ならびに、7)硫黄含有側鎖:システイン及びメチオニンが挙げられる。保存的アミノ酸置換の群は、バリン−ロイシン−イソロイシン、フェニルアラニン−チロシン、リジン−アルギニン、アラニン−バリン、グルタミン酸−アスパラギン酸、及びアスパラギン−グルタミンである。
タンパク質の位置に関して「対応する」という用語、例えば、ヌクレオチドまたはアミノ酸の位置が、例えば配列表に記載の開示された配列中のヌクレオチドまたはアミノ酸の位置に「対応する」という記述は、構造配列アラインメントに基づいてまたは標準的なアラインメントアルゴリズム(例えば、GAPアルゴリズム)を使用して、開示された配列とのアラインメントによって特定される、ヌクレオチドまたはアミノ酸の位置を指す。例えば、本明細書に記載される構造アラインメント法による、SEQ ID NO:2(ECDドメイン)に記載された、またはSEQ ID NO:76、3030または3031(IgVドメイン)に記載の野生型CD80の配列を有する参照配列のアライメントによって、対応する残基を決定することができる。配列をアライメントすることによって、当業者は、例えば保存されているアミノ酸残基及び同一のアミノ酸残基を、基準として使用して、対応する残基を特定することができる。
「低下(減少)させる」または「減弱(化)する」または「抑制する」という用語は、本明細書において使用される場合、統計的に有意な量の低下(減少)を意味する。低下(減少)は、少なくとも10%、20%、30%、40%、50%、60%、70%、80%、90%、または100%であることができる。
「誘導体」または「誘導体化されている」という用語は、その治療効果を保持または増強させながら、生物学的半減期、バイオアベイラビリティ、免疫 原性、溶解性、毒性、効力、または有効性などの特性を変化させるために、タンパク質を直接または間接的に組成物に共有結合的に連結させることによる、タンパク質の改変を指す。本発明の免疫調節ポリペプチドの誘導体は、本発明の範囲内であり、例えば、グリコシル化、PEG化、脂質化、またはFc融合によって作製することができる。
本明細書において使用される場合、検出は、タンパク質の可視化(目または機器による)を可能にする方法が含まれる。タンパク質は、そのタンパク質に特異的な抗体を使用して可視化できる。タンパク質の検出はまた、検出可能な標識を含むタグとタンパク質の融合によって、または検出可能な標識を含む二次抗体などのタンパク質に特異的な第2の試薬との接触によっても促され得る。
本明細書において使用される場合、ドメイン(典型的には、3以上、一般的に5または7以上のアミノ酸、例えば10〜200のアミノ酸残基の配列)は、分子の他の部分と構造的及び/または機能的に異なりかつ特定可能な分子(例えば、タンパク質またはコーディング核酸)の一部分を指す。例えば、ドメインは、1つまたは複数の構造モチーフで構成されているタンパク質内で独立してフォールド構造を形成することができ、及び/または結合活性などの機能活性によって認識される、ポリペプチド鎖の部分を含む。タンパク質は、1つ、または2つ以上の別個のドメインを有することができる。例えば、ドメインは、関連ファミリーメンバーに対する一次配列または構造の相同性、例えばモチーフに対する相同性によって、特定、定義、または識別することができる。別の例では、ドメインは、その機能(例えば、コグネイト結合パートナーなどの生体分子と相互作用する能力)によって識別することができる。ドメインが独立してまたは別の分子に融合して活動する(例えば、結合)ことができるように、ドメインは、独立して生物学的機能または活性を示すことができる。ドメインは、線状アミノ酸配列または非線状アミノ酸配列であることができる。多くのポリペプチドは、複数のドメインを含有する。このようなドメインは、公知であり、かつ、当業者によって特定することができる。本明細書における例示のため、定義が提供されるが、名称によって特定のドメインを認識することは十分に当技術分野の技能の範囲内であると理解される。必要であれば、ドメインを特定するために適切なソフトウェアを用いることができる。
「エクトドメイン」という用語は、本明細書において使用される場合、膜タンパク質(例えば、膜貫通型タンパク質)の、小胞膜の外側にある領域を指す。エクトドメインは、多くの場合、リガンドまたは細胞表面受容体に、例えば当該リガンドまたは当該細胞表面受容体に特異的に結合する結合ドメインを介して特異的に結合する結合ドメインを含む。細胞の膜貫通型タンパク質のエクトドメインは、代替的に細胞外ドメインと称される。
「有効量」または「治療的有効量」という用語は、単独(すなわち、単剤療法として)または追加の治療用物質との組み合わせのいずれかでex vivo(患者由来の細胞との接触による)またはin vivo(患者への投与による)で投与された場合、例えば疾患の症状及び/または病因を改善または排除することによって疾患進行の統計的に有意な減少をもたらす、本発明の治療用組成物(タンパク質組成物または細胞組成物を含む)の量及び/または濃度を指す。有効量は、疾患または障害と関連する少なくとも1つの症状または生物学的応答もしくは影響を緩和する、低下させる、または軽減する、疾患もしくは障害の進行を防止する、または患者の身体機能を改善する量であり得る。細胞療法の場合、有効量は、養子細胞療法により患者に投与される細胞の有効用量または有効数である。いくつかの実施形態では、患者は、哺乳動物、例えば非ヒト霊長類またはヒト患者である。
「エンドドメイン」という用語は、本明細書において使用される場合、いくつかの膜タンパク質(例えば、膜貫通型タンパク質)において見いだされる、細胞表面膜によって画定される内部空間内に延びる領域を指す。哺乳動物細胞では、エンドドメインは、膜タンパク質の細胞質領域である。細胞では、エンドドメインは、細胞内構成成分と相互作用し、かつシグナルトランスダクションにおいて役割を果たすことができ、したがって、場合によっては、細胞内シグナル伝達ドメインであることができる。細胞の膜貫通型タンパク質のエンドドメインは、代替的に細胞質ドメインと称され、これは、場合によっては、細胞質シグナル伝達ドメインであることができる。
「増強された」または「増加(向上)した」という用語は、本明細書において哺乳動物リンパ球の免疫活性の増加の文脈で使用される場合、リンパ球の1つまたは複数の活性の増加を意味する。活性の増加は、例えば統計的に有意な量などでの、細胞生存、細胞増殖、サイトカイン産生、またはT細胞の細胞傷害性のうちの1つまたは複数の増加であり得る。いくつかの実施形態では、増加した免疫活性への言及は、インターフェロンγ(IFNγ)産生を、例えば統計的に有意な量、増加させることを意味する。いくつかの実施形態では、免疫活性を、混合リンパ球反応(MLR)アッセイにおいて評価することができる。MLRアッセイを実行する方法は、当技術分野において公知である。Wang et al.,Cancer Immunol Res.2014 Sep:2(9):846−56。リンパ球の活性を評価する他の方法は、本明細書に記載される任意のアッセイを含め、当技術分野において公知である。いくつかの実施形態では、増強は、非ゼロ対照値よりも少なくとも10%、20%、30%、40%、50%、75%、100%、200%、300%、400%、または500%大きい増加であることができる。
「操作された細胞」という用語は、本明細書において使用される場合、ヒトによる介入(例えば、組換えDNA法またはウイルス形質導入法)によって遺伝子操作された哺乳動物細胞を指す。いくつかの実施形態では、細胞は、免疫細胞、例えばリンパ球(例えば、T細胞、B細胞、NK細胞)または抗原提示細胞(例えば、樹状細胞)である。細胞は、患者由来の初代細胞であってもよいし、細胞株であってもよい。いくつかの実施形態では、本発明の操作された細胞は、バリアントCD80ポリペプチドが特異的に結合するCD28、PD−L1、及び/またはCTLA−4を発現するT細胞、またはPD−L1を発現するAPCの免疫活性を調節するように操作された本発明のバリアントCD80を含有する。いくつかの実施形態では、バリアントCD80は、膜貫通ドメイン(例えば、CD80膜貫通ドメイン)に連結されたIgVドメインを含有する細胞外ドメインまたはその一部分を含有し、任意で細胞内シグナル伝達ドメインを含有する、膜貫通型免疫調節タンパク質(以下「TIP」と称される)である。場合によっては、TIPは、異種の細胞質シグナル伝達ドメインまたはエンドドメインを含有するキメラ受容体としてフォーマットされる。いくつかの実施形態では、操作された細胞は、本明細書に記載される免疫調節タンパク質を発現及び分泌することができる。提供される操作された細胞の中には、操作されたT細胞受容体(TCR)またはキメラ抗原受容体(CAR)をさらに含有する細胞もある。
「操作されたT細胞」という用語は、本明細書において使用される場合、ヒトによる介入(例えば、組換えDNA法またはウイルス形質導入法)によって遺伝子操作されたT細胞(例えば、ヘルパーT細胞、細胞傷害性T細胞(あるいは、細胞傷害性Tリンパ球またはCTL)、ナチュラルキラーT細胞、制御性T細胞、メモリーT細胞、またはγδT細胞)を指す。操作されたT細胞は、本発明のバリアントCD80膜貫通型免疫調節タンパク質(TIP)または分泌型免疫調節タンパク質(SIP)を含有し、本発明のバリアントCD80膜貫通型免疫調節タンパク質(TIP)または分泌型免疫調節タンパク質(SIP)は、該T細胞上に発現し、操作されたT細胞自体の免疫活性を調節するか、または該T細胞上に発現するバリアントCD80が特異的に結合する哺乳動物細胞の免疫活性を調節するように操作される。
「操作されたT細胞受容体」または「操作されたTCR」という用語は、選択され、クローニングされ、及び/またはその後T細胞の集団に導入される(多くの場合、養子免疫療法に使用される)、主要組織適合複合体(MHC)/ペプチド標的抗原に対して所望の親和性で特異的に結合するように操作されたT細胞受容体(TCR)を指す。操作されたTCRとは対照的に、CARは、MHC依存的に標的抗原と結合するように操作される。
「〜上に発現する」という用語は、本明細書において使用される場合、細胞(例えば哺乳動物細胞)の表面に発現するタンパク質に関して使用される。したがって、当該タンパク質は膜タンパク質として発現する。いくつかの実施形態では、発現する当該タンパク質は、膜貫通型タンパク質である。いくつかの実施形態では、当該タンパク質は、小分子部分(例えば、薬物または検出可能標識)にコンジュゲートされる。細胞の表面に発現するタンパク質は、哺乳動物細胞上に発現する細胞表面タンパク質(例えば細胞表面受容体)を含むことができる。
「半減期延長部分」という用語は、ポリペプチド融合体または化学的コンジュゲートの一部分であって、そのように該部分にコンジュゲートされていないタンパク質の半減期と比較して、哺乳動物血清中に循環するタンパク質の半減期を延長する部分を指す。いくつかの実施形態では、半減期は、1.2倍、1.5倍、2.0倍、3.0倍、4.0倍、5.0倍、もしくは6.0倍より長く、または約1.2倍、約1.5倍、約2.0倍、約3.0倍、約4.0倍、約5.0倍、もしくは約6.0倍より長く延長される。いくつかの実施形態では、半減期は、半減期延長部分を有さないタンパク質と比較して、in vivo投与後、6時間超、12時間超、24時間超、48時間超、72時間超、96時間超、または1週間超延長される。半減期は、タンパク質がその濃度、量、または活性の半分を喪失するのに要する時間を指す。半減期は、例えば、ELISAアッセイまたは活性アッセイを使用することによって決定することができる。例示的な半減期延長部分には、Fcドメイン、多量体化ドメイン、ポリエチレングリコール(PEG)、ヒドロキシエチルデンプン(HES)、XTEN(伸長組換えペプチド;WO2013130683を参照のこと)、ヒト血清アルブミン(HSA)、ウシ血清アルブミン(BSA)、脂質(アシル化)、及びポリ−Pro−Ala−Ser(PAS)、及びポリグルタミン酸(グルタミル化)が含まれる。
「免疫学的シナプス」または「免疫シナプス」という用語は、本明細書において使用される場合、MHC I(主要組織適合複合体)またはMHC IIを発現する哺乳動物細胞(例えば、抗原提示細胞または腫瘍細胞)と、哺乳動物リンパ球(例えば、エフェクターT細胞またはナチュラルキラー(NK)細胞)との間の界面を意味する。
免疫グロブリン分子のFc(結晶性断片)領域またはドメイン(Fcポリペプチドとも呼ばれる)は、主に免疫グロブリン重鎖の定常領域に相当し、抗体のエフェクター機能(複数可)を含む様々な機能に関与している。Fcドメインは、免疫グロブリン分子のヒンジドメインの一部分または全てとCH2ドメイン及びCH3ドメインとを含有する。Fcドメインは、1つまたは複数のジスルフィド結合によって接続された2つのポリペプチド鎖の二量体を形成することができる。例示的な二量体化ポリペプチドを図6A及び6Bに示す。いくつかの実施形態では、Fcは、エフェクター機能を促す活性が低減された(例えば、30%超、40%超、50%超、60%超、70%超、80%超、90%超、またはそれ以上低減された)バリアントFcである。いくつかの実施形態では、Fc領域中のアミノ酸置換への参照は、特定のSEQ ID NO:に基づいて記載されない限りは、EU番号付けシステムによる。EU番号付けは公知であり、最近更新されたIMGT Scientific Chart(IMGT(登録商標)、すなわちinternational ImMunoGeneTics information system(登録商標)、http://www.imgt.org/IMGTScientificChart/Numbering/Hu_IGHGnber.html(作成日:2001年5月17日、最終更新日:2013年1月10日)及びKabat,E.A.et al.Sequences of Proteins of Immunological interest.5th ed.USDepartment of Health and Human Services,NIH publication No.91−3242(1991)に報告されているEUインデックスに従う。
免疫グロブリンFc融合体(「Fc融合体」)、例えば免疫調節Fc融合タンパク質は、免疫グロブリンのFc領域に作動可能に連結された1つまたは複数のポリペプチド(または1つまたは複数の小分子)を含む分子である。Fc融合体は、例えば抗体のFc領域(薬物動態を促す)及びバリアントCD80ポリペプチドを含み得る。免疫グロブリンFc領域は、1つまたは複数のバリアントCD80ポリペプチドまたは小分子(融合パートナー)に間接的または直接的に連結され得る。様々なリンカーが当技術分野において公知であり、任意でこれを使用して、Fcを融合パートナーに連結させてFc融合体を生成することができる。同一種のFc融合体を、二量体化してFc融合ホモ二量体を形成することも、非同一種を使用してFc融合ヘテロ二量体を形成することもできる。いくつかの実施形態では、Fcは、哺乳動物Fc、例えばネズミ、ウサギまたはヒトFcである。
「宿主細胞」という用語は、組換え発現ベクターによってコードされているタンパク質を発現させるために使用することができる細胞を指す。宿主細胞は、原核生物、例えば大腸菌(E.Coli)であってよく、または真核生物、例えば単細胞真核生物(例えば酵母または他の真菌類)、植物細胞(例えば、タバコまたはトマト植物細胞)、動物細胞(例えばヒト細胞、サル細胞、ハムスター細胞、ラット細胞、マウス細胞、または昆虫細胞)、またはハイブリドーマであってよい。宿主細胞の例には、チャイニーズハムスター卵巣(CHO)細胞またはそれらの誘導体、例えば無血清培地で成長するVeggie CHO、DG44、Expi CHO、もしくはCHOZN及び関連細胞株またはDHFR欠損したCHO系統DX−B11が挙げられる。いくつかの実施形態では、宿主細胞は、哺乳動物細胞(例えば、ヒト細胞、サル細胞、ハムスター細胞、ラット細胞、マウス細胞、または昆虫細胞)であってよい。
「免疫グロブリン」という用語(「Ig」と略記される)は、本明細書において使用される場合、5種のヒトクラスの抗体、すなわちIgA(サブクラスIgA1及びIgA2を含む)、IgD、IgE、IgG(サブクラスIgG1、IgG2、IgG3、及びIgG4を含む)、及びIgMのいずれかを含む哺乳動物免疫グロブリンタンパク質を指す。該用語はまた、完全または部分的合成(例えば、組換えまたは化学合成)であろうと天然に産生されようと完全長未満である免疫グロブリン、例えば抗原結合断片(Fab)、VH及びVLを含有する可変断片(Fv)、1つの鎖中で一緒に連結されたVH及びVLを含有する単鎖可変断片(scFv)、ならびに他の抗体V領域断片、例えば、Fab′、F(ab)2、F(ab′)2、dsFvダイアボディ、Fc、及びFdポリペプチド断片を含む。ホモ二重特異性及びヘテロ二重特異性の二重特異性抗体は、該用語の意味の範囲内に含まれる。
「免疫グロブリンスーパーファミリー」または「IgSF」という用語は、本明細書において使用される場合、細胞の、認識、結合、または接着プロセスに関与する、細胞表面及び可溶性タンパク質の群を意味する。分子は、免疫グロブリン(すなわち、抗体)と共通の構造的特徴に基づいて、このスーパーファミリーのメンバーとして類別され、これらは全て、免疫グロブリンドメインまたはフォールドとして公知のドメインを保有する。IgSFのメンバーは、免疫系の、細胞表面抗原受容体、共受容体及び共刺激分子、リンパ球への抗原提示に関与する分子、細胞接着分子、ある種のサイトカイン受容体ならびに細胞内筋タンパク質を含む。これらは、通常、免疫系における役割と関連する。免疫学的シナプス中のタンパク質は、IgSFのメンバーであることが多い。IgSFはまた、機能のような共通の特性に基づいて「サブファミリー」に分類することができる。このようなサブファミリーは、典型的には、4〜30のIgSFメンバーからなる。
「IgSFドメイン」または「免疫グロブリンドメイン」または「Igドメイン」という用語は、本明細書において使用される場合、IgSFタンパク質の構造ドメインを指す。Igドメインは、免疫グロブリン分子に因んで命名されている。これらは、約70〜110アミノ酸を含有し、それらのサイズ及び機能に従って類別される。Igドメインは、逆平行β鎖の2つのシートによって形成されるサンドイッチ様構造を有する特徴的なIgフォールドを保有する。サンドイッチの内側の疎水性アミノ酸間の相互作用ならびにB及びF鎖中のシステイン残基間で形成される高度に保存されているジスルフィド結合が、Igフォールドを安定化させる。Igドメインの一端は、抗体のそれらのリガンドに対する特異性にとって重要な相補性決定領域と呼ばれる部分を有する。Ig様ドメインは、IgV、IgC1、IgC2、またはIgIとして(クラスに)分類することができる。ほとんどのIgドメインは、可変(IgV)ドメインまたは定常(IgC)ドメインのいずれかである。9つのβ鎖を有するIgVドメインは、一般的に7つのβ鎖を有するIgCドメインより長い。IgSFのいくつかのメンバーのIgドメインは、アミノ酸配列中のIgVドメインと似ているが、IgCドメインとサイズが類似している。これらは、IgC2ドメインと呼ばれ、一方で、標準的なIgCドメインは、IgC1ドメインと呼ばれる。T細胞受容体(TCR)鎖は、細胞外部分における2つのIgドメイン(1つはN末端におけるIgVドメイン及び1つは細胞膜に隣接するIgC1ドメイン)を含有する。CD80は、2つのIgドメイン、すなわちIgV及びIgCを含有する。
「IgSF種」という用語は、本明細書において使用される場合、同一のまたは実質的に同一の一次アミノ酸配列を有するIgSFメンバータンパク質の集団を意味する。各哺乳動物免疫グロブリンスーパーファミリー(IgSF)メンバーは、そのIgSFメンバーに属する全てのIgSF種に固有の識別を規定する。したがって、各IgSFファミリーメンバーは、他のIgSFファミリーメンバーと比べて固有であり、したがって、特定のIgSFファミリーメンバーの各種は、別のIgSFファミリーメンバー種と比べて固有である。それにもかかわらず、同じIgSF種の分子間の相違が、グリコシル化、リン酸化、ユビキチン化、ニトロシル化、メチル化、アセチル化、及び脂質化などの翻訳後修飾の差異が原因で生じ得る。加えて、遺伝子多型が原因の単一のIgSF種内の小さな配列差異は、例えばタンパク質分解的切断が原因のIgSF種の野生型短縮形態と同様、単一のIgSF種内の別の形態の相違を成す。「細胞表面IgSF種」は、細胞(一般的に哺乳動物細胞)の表面に発現するIgSF種である。
「免疫活性」という用語は、本明細書においてT細胞のような哺乳動物リンパ球の文脈で使用される場合、1つまたは複数の細胞生存、細胞増殖、サイトカイン産生(例えば、インターフェロン−γ)、またはT細胞傷害性活性を指す。場合によっては、免疫活性は、ケモカインまたはインターロイキンのようなサイトカインのそれらの発現を意味することができる。免疫活性の増強または抑制を決定するためのアッセイは、培養上清中のインターフェロン−γサイトカインレベルを測定するMLR(混合リンパ球反応)アッセイ(Wang et al.,Cancer Immunol Res.2014 Sep:2(9):846−56)、SEB(ブドウ球菌エンテロトキシンB(staphylococcal enterotoxin B))T細胞刺激アッセイ(Wang et al.,Cancer Immunol Res.2014 Sep:2(9):846−56)、及び抗CD3 T細胞刺激アッセイ(Li and Kurlander,J Transl Med.2010:8:104)を含む。T細胞活性化は、IFN−γサイトカインの分泌と関連するため、これらのin vitroヒトT細胞アッセイからの培養上清中のIFN−γレベルの検出は、市販のELISAキットを使用してアッセイすることができる(Wu et al,Immunol Lett 2008 Apr 15;117(1):57−62)。免疫応答の誘導は、静止リンパ球と比べて免疫活性の増加をもたらす。本明細書において提供されるとおりの免疫調節タンパク質(例えば、親和性改変IgSFドメインを含有するバリアントCD80ポリペプチド)は、初代T細胞アッセイにおいて、野生型IgSFメンバーまたはIgSFドメイン対照と比べてIFN−γ(インターフェロン−γ)発現を、いくつかの実施形態において増加させることができ、または、その他の実施形態において減少させることができる。当業者は、IFN−γ発現の増加を決定するために使用される初代T細胞アッセイのフォーマットが、IFN−γ発現の減少についてアッセイするために用いられるフォーマットと異なることを理解するだろう。初代T細胞アッセイにおいてIFN−γ発現を減少させる本発明の免疫調節タンパク質または親和性改変IgSFドメインの能力についてアッセイする際に、混合リンパ球反応(MLR)アッセイを実施例6に記載されるように使用することができる。好都合なことに、本発明の可溶性形態の親和性改変IgSFドメインを用いて、同じく実施例6に記載されるとおり、IFN−γ発現に拮抗することによりその発現を減少させるその能力をMLRにおいて決定することができる。あるいは、初代T細胞アッセイにおいてIFN−γ発現を増加させる本発明の免疫調節タンパク質または親和性改変IgSFドメインの能力についてアッセイする際に、共固定アッセイを使用することができる。共固定アッセイでは、T細胞受容体シグナル(いくつかの実施形態において、抗CD3抗体によって提供される)を共固定された親和性改変IgSFドメイン、例えばバリアントCD80と併用して、野生型IgSFドメイン対照と比べてIFN−γ発現を増加させる能力を決定する。バリアントCD80膜貫通型免疫調節タンパク質の活性を評価することを含む、操作された細胞の免疫活性をアッセイする方法は、当技術分野において公知であり、限定されないが、抗原刺激後にT細胞を増殖させる能力、再刺激の非存在下でT細胞の増殖を持続する能力、及び適切な動物モデルにおける抗がん活性を含む。アッセイはまた、標準的な51Cr放出アッセイ(例えば、Milone et al.,(2009)Molecular Therapy 17;1453−1464を参照のこと)もしくはフローベース細胞傷害性アッセイ、またはインピーダンスベース細胞傷害性アッセイ(Peper et al.(2014)Journal of Immunological Methods,405:192−198)を含む、細胞傷害性を評価するアッセイを含む。
「免疫調節ポリペプチド」または「免疫調節タンパク質」は、免疫活性を調節するポリペプチドまたはタンパク質分子である。免疫応答の「調節」または「調節すること」とは、免疫活性の増加または低減のいずれかを意味する。免疫調節タンパク質は、単一のポリペプチド鎖であるか、または(例えば、鎖間ジスルフィド結合によって)互いに共有結合された少なくとも2つのポリペプチド鎖の多量体(二量体またはより高次の多量体)であることができる。したがって、単量体、二量体、及びより高次の多量体ポリペプチドは、その定義された用語の範囲内である。多量体ポリペプチドは、(同一ポリペプチド鎖の)ホモ多量体または(非同一ポリペプチド鎖の)ヘテロ多量体であることができる。本発明の免疫調節タンパク質は、バリアントCD80ポリペプチドを含むことができる。
「増加(向上)させる」という用語は、本明細書において使用される場合、統計的に有意な量増加(向上)させることを意味する。増加(向上)は、非ゼロ対照値よりも少なくとも5%、10%、20%、30%、40%、50%、75%、100%、またはより大きい増加(向上)であることができる。
CD80の「アイソフォーム」は、アミノ酸配列が異なる、複数の天然に存在するCD80ポリペプチドのうちの1つである。アイソフォームは、単一の遺伝子によって発現されるRNA転写物のスプライスバリアントの産物であることも、遺伝子重複から生じ得るような機能的に類似のタンパク質を生成する高度に類似するが異なる遺伝子の発現産物であることもできる。本明細書において使用される場合、CD80の「アイソフォーム」と言う用語は、CD80遺伝子の異なるアレルの産物も指す。
「標識」という用語は、検出可能シグナルを提供するために直接もしくは間接的に結合もしくは連結できる、または検出可能シグナルを改変するために第2の標識と相互作用できる化合物もしくは組成物を指す。標識は、標識されたポリペプチドを生成するために、ポリペプチドに直接または間接的にコンジュゲートされ得る。標識は、それ自体で検出可能(例えば、放射性同位体標識または蛍光標識)であり得るか、酵素標識の場合は、検出可能な基質化合物組成の化学変化を触媒することができる。標識の非限定的な例としては、蛍光発生部分、緑色蛍光タンパク質、またはルシフェラーゼが挙げられる。
「リンパ球」という用語は、本明細書において使用される場合、哺乳動物免疫系における白血球の3つのサブタイプのいずれかを意味する。これらは、ナチュラルキラー細胞(NK細胞)(細胞媒介性の細胞傷害性自然免疫において機能する)、T細胞(細胞媒介性の細胞傷害性獲得免疫に関する)、及びB細胞(体液性の抗体による適応免疫に関する)を含む。T細胞は、ヘルパーT細胞、細胞傷害性T細胞、ナチュラルキラーT細胞、メモリーT細胞、制御性T細胞、またはγδT細胞を含む。また、自然リンパ球(ILC)もリンパ球の定義の範囲内に含まれる。
「哺乳動物」または「患者」という用語は、具体的に、ヒト、チンパンジー、アカゲザル、カニクイザル、イヌ、ネコ、マウス、またはラットのうちの少なくとも1つへの言及を含む。
「膜タンパク質」という用語は、本明細書において使用される場合、生理的条件下で脂質二重層に直接または間接的に結合するタンパク質を意味する。膜を形成する脂質二重層は、生体膜、例えば真核生物(例えば、哺乳動物)の細胞膜または人工の(すなわち、人造の)膜、例えばリポソーム上に見いだされる膜であることができる。脂質二重層への膜タンパク質の結合は、共有結合によるか、または非共有結合的相互作用(例えば、疎水性相互作用もしくは静電相互作用)によるものであることができる。膜タンパク質は、内在性膜タンパク質または表在性膜タンパク質であることができる。表在性膜タンパク質である膜タンパク質は、脂質二重層に非共有結合するか、または内在性膜タンパク質に非共有結合する。表在性膜タンパク質は、哺乳動物において生理的な範囲の条件下で表在性膜タンパク質が脂質二重層と会合する及び/または脂質二重層から解離することができるように、脂質二重層への一時的な結合を形成する。表在性膜タンパク質とは対照的に、内在性膜タンパク質は、哺乳動物において生理的な範囲の条件下で内在性膜タンパク質が脂質二重層への結合から解離しないように、膜の脂質二重層への事実上恒久的な結合を形成する。膜タンパク質は、脂質二重層の一層によって膜への結合を形成することができる(モノトピック型)か、または膜の両方の層によって結合することができる(ポリトピック型)。1つの脂質二重層とだけ相互作用する内在性膜タンパク質は、「内在性モノトピック型タンパク質」である。脂質二重層の両方と相互作用する内在性膜タンパク質は、「内在性ポリトピック型タンパク質」であり、あるいは、本明細書において「膜貫通型タンパク質」と称される。
「調節すること」または「調節する」という用語は、本明細書において免疫応答(例えば哺乳動物の免疫応答)の文脈で使用される場合、本発明のバリアントCD80を含む免疫調節ポリペプチドの投与の結果としてまたは本発明の免疫調節タンパク質(例えば、バリアントCD80膜貫通型免疫調節タンパク質)を発現する操作された細胞の投与の結果として起こる、既存のまたは潜在的な免疫応答の任意の変化(例えば、増加または減少)を指す。したがって、調節は、バリアントCD80を含む免疫調節タンパク質の投与の非存在下で起こるまたは存在する免疫応答と比較した、免疫応答の変化(例えば、増加または減少)を指す。そのような調節は、免疫細胞の免疫活性の度合いもしくは程度の任意の誘導、活性化、抑制、または変化を含む。免疫細胞は、B細胞、T細胞、NK(ナチュラルキラー)細胞、NK T細胞、プロフェッショナル抗原提示細胞(APC)、及び非プロフェッショナル抗原提示細胞、ならびに炎症細胞(好中球、マクロファージ、単球、好酸球、及び好塩基球)を含む。調節は、既存の免疫応答、発生段階にある免疫応答、潜在的な免疫応答に、または免疫応答を誘導する、調節する、それに影響を及ぼす、もしくは応答する能力に付与される任意の変化を含む。調節は、免疫応答の一部としての、免疫細胞における遺伝子、タンパク質及び/または他の分子の発現及び/または機能の任意の変化を含む。免疫応答の調節または免疫活性の調節は、例えば、以下を含む:免疫細胞の排除、欠失、または隔離;自己反応性リンパ球、抗原提示細胞、または炎症細胞のような他の細胞の機能的能力を調節することができる免疫細胞の誘導または生成;免疫細胞における不応答状態(すなわち、アネルギー)の誘導;免疫細胞の活性または機能を増強または抑制すること(これらの細胞によって発現されるタンパク質のパターンを変化させることを非限定的に含む)。例としては、サイトカイン、ケモカイン、成長因子、転写因子、キナーゼ、共刺激分子、もしくは他の細胞表面受容体などの特定の分子クラスの産生及び/または分泌の変化、またはこれらの調節事象の任意の組み合わせが挙げられる。調節は、例えば、初代T細胞アッセイにおける野生型または非改変CD80対照と比べたIFN−γ(インターフェロンγ)発現の変化によって評価することができる(Zhao and Ji,Exp Cell Res.2016 Jan1;340(1):132−138を参照のこと)。調節は、例えば、野生型CD80膜貫通型タンパク質によって操作された細胞と比べた、操作された細胞の免疫活性の変化、例えば操作された細胞の細胞傷害性活性の変化または操作された細胞のサイトカイン分泌の変化によって、評価することができる。
「多量体化ドメイン」という用語は、それぞれが同じまたは異なる多量体化ドメインであることができる相補的多量体化ドメイン(例えば、第1の多量体化ドメイン及び第2の多量体化ドメイン)を含有する、ポリペプチド分子と1つまたは複数の追加のポリペプチド分子との安定した相互作用を促進するアミノ酸配列を指す。相補的多量体化ドメイン間の相互作用、例えば、第1の多量体化ドメインと第2の多量体化ドメイン間の相互作用は、安定なタンパク質−タンパク質相互作用を形成して、ポリペプチド分子と追加のポリペプチド分子の多量体を産生する。場合によっては、多量体化ドメインは同じであり、それ自体と相互作用して2つのポリペプチド鎖間に安定したタンパク質−タンパク質相互作用を形成する。一般的に、ポリペプチドは、多量体化ドメインに直接的または間接的に接続される。例示的な多量体化ドメインは、免疫グロブリン配列またはその部分、ロイシンジッパー、疎水性領域、親水性領域、及び適合性のあるタンパク質−タンパク質相互作用ドメインを含む。多量体化ドメインは、例えば、免疫グロブリン定常領域またはドメイン、例えば、IgG(IgG1、IgG2、IgG3またはIgG4サブタイプを含む)、IgA、IgE、IgD及びIgMならびにそれらの改変形態由来の、Fcドメインまたはその部分であることができる。
「核酸」及び「ポリヌクレオチド」という用語は、互換的に使用され、一本鎖または二本鎖のいずれかの形態の核酸残基(例えば、デオキシリボヌクレオチドまたはリボヌクレオチド)のポリマーを指す。特に限定されない限り、該用語は、公知の天然ヌクレオチドの類似体を含有する核酸、及びそれと類似の結合特性を有し、天然に存在するヌクレオチドと同様な様式で代謝される核酸を包含する。別段の指示のない限り、特定の核酸配列はまた、明示的に示されている配列(「参照配列」)だけでなく、保存的に改変されたそれらのバリアント(例えば、縮重コドン置換)及び相補的ヌクレオチド配列も暗に包含する。具体的には、縮重コドン置換は、1つまたは複数の選択された(または全ての)コドンの第3の位置が混合塩基及び/またはデオキシイノシン残基で置換されている配列を生成することによって達成してもよい。核酸またはポリヌクレオチドという用語は、遺伝子によってコードされているcDNAまたはmRNAを包含する。
「分子種」という用語は、本明細書において使用される場合、同一のまたは実質的に同一の一次アミノ酸配列を備えたタンパク質の集団を意味する。各哺乳動物免疫グロブリンスーパーファミリー(IgSF)メンバーは、同一のまたは実質的に同一の分子種の集合体を規定する。したがって、例えば、ヒトCD80はIgSFメンバーであり、各ヒトCD80分子はCD80の一分子種である。同じ分子種の分子間の相違が、グリコシル化、リン酸化、ユビキチン化、ニトロシル化、メチル化、アセチル化、及び脂質化などの翻訳後修飾の差異が原因で起こり得る。加えて、遺伝子多型が原因の単一の分子種内の小さな配列差異は、単一の分子種内の別の形態の相違を成し、例えばタンパク質分解的切断が原因の単一の分子種の野生型短縮形態も同様である。「細胞表面分子種」は、哺乳動物細胞の表面に発現する分子種である。各々がISを形成する2つの哺乳動物細胞のうちの一方のみ、またはもう一方のみに存在する(しかし両方ではない)、2つ以上の異なるタンパク質種は、互いに「シス」または「シス配置」にあると言われる。第1のものがISを形成する2つの哺乳動物細胞のうちの第1の細胞のみに存在し、第2のものがISを形成する2つの哺乳動物細胞のうちの第2の細胞のみに存在する、2つの異なるタンパク質種は、「トランス」または「トランス配置」にあると言われる。各々がISを形成する2つの哺乳動物細胞の両方に存在する、2つの異なるタンパク質種は、これらの細胞上でシス及びトランスの両配置にある。
「非競合的結合」という用語は、本明細書において使用される場合、少なくとも2つのコグネイト結合パートナーに同時に特異的に結合するタンパク質の能力を意味する。したがって、タンパク質は、少なくとも2つの異なるコグネイト結合パートナーに同時に結合することができるが、結合相互作用は、同じ期間である必要はないため、場合によっては、タンパク質は、コグネイト結合パートナーの1つにのみ特異的に結合される。いくつかの実施形態では、結合は、特定の結合条件下で起こる。いくつかの実施形態では、同時結合は、1つのコグネイト結合パートナーの結合が第2のコグネイト結合パートナーへの同時結合を実質的に阻害しないようなものである。いくつかの実施形態では、非競合的結合は、タンパク質上のその結合部位への第2のコグネイト結合パートナーの結合が、タンパク質上のその結合部位への第1のコグネイト結合パートナーの結合に置き換わらないことを意味する。非競合的結合を評価する方法は、Perez de La Lastra et al.,Immunology,1999 Apr:96(4):663−670に記載されている方法など、当技術分野において周知である。場合によっては、非競合的相互作用において、第1のコグネイト結合パートナーは、第2のコグネイト結合パートナーの相互作用部位と重複しない相互作用部位で、第2のコグネイト結合パートナーの結合が第1のコグネイト結合パートナーの結合と直接干渉しないように、特異的に結合する。したがって、第2のコグネイト結合パートナーの結合によるコグネイト結合パートナーの結合へのいかなる影響も、第1のコグネイト結合パートナーの結合との直接的な干渉以外の機序を介するものである。例えば、酵素−基質相互作用においては、非競合的阻害剤は、酵素の活性部位以外の部位に結合する。非競合的結合は、第2のコグネイト結合パートナーが、第1のコグネイト結合パートナーの結合と重複しない相互作用部位で特異的に結合するが、第1の相互作用部位が第1のコグネイト結合パートナーに占有されているときだけ第2の相互作用部位に結合する、非競合的な結合相互作用を包含する。
「薬学的組成物」という用語は、哺乳動物対象、多くの場合ヒトにおける、薬学的用途に好適な組成物を指す。薬学的組成物は、典型的には、有効量の活性剤(例えば、バリアントCD80を含む免疫調節ポリペプチドまたはバリアントCD80膜貫通型免疫調節タンパク質を発現する操作された細胞)、及び担体、賦形剤、または希釈剤を含む。担体、賦形剤、または希釈剤は、それぞれ、典型的には、薬学的に許容し得る担体、賦形剤または希釈剤である。
「ポリペプチド」及び「タンパク質」という用語は、本明細書において互換的に使用され、かつ、ペプチド結合を介して連結されている2つ以上のアミノ酸の分子鎖を指す。該用語は、その産物の特定の長さを指すわけではない。したがって、「ペプチド」及び「オリゴペプチド」は、ポリペプチドの定義内に含まれる。該用語は、ポリペプチドの翻訳後修飾、例えば、グリコシル化、アセチル化、リン酸化などを含む。該用語はまた、合成することができるか、または公知のタンパク質操作技術を使用して組換え発現することができる、1つまたは複数のアミノ酸類似体または非標準アミノ酸または非天然アミノ酸の分子も含む。加えて、タンパク質は誘導体化されていてもよい。
「初代T細胞アッセイ」という用語は、本明細書において使用される場合、インターフェロン−γ(「IFN−γ」)発現を測定するためのin vitroアッセイを指す。実施例6に記載されるアッセイのような多種多様なこのような初代T細胞アッセイが当技術分野において公知である。好ましい実施形態では、使用されるアッセイは、抗CD3共固定アッセイである。このアッセイでは、初代T細胞が、追加の組換えタンパク質と共にまたはそれなしで固定された抗CD3によって刺激される。ある時点(通常24〜72時間)で培養上清を採取する。別の実施形態では、使用されるアッセイは混合リンパ球反応(MLR)である。このアッセイでは、初代T細胞が、同種他家APCで刺激される。ある時点(通常24〜72時間)で培養上清を採取する。標準的なELISA技術によって培養上清中のヒトIFN−γレベルを測定する。市販のキットが供給業者から入手可能であり、製造業者の推奨に従ってアッセイを実施する。
「精製された」という用語は、核酸(例えば、本発明の免疫調節タンパク質をコードする)に適用される場合、一般的に、当技術分野において周知の分析技術によって決定した他の成分を実質的に含まない核酸またはポリペプチドを意味する(例えば、精製されたポリペプチドまたはポリヌクレオチドは、電気泳動ゲル、クロマトグラフ溶出液、及び/または密度勾配遠心分離に供した媒体中で、別個のバンドを形成する)。例えば、電気泳動ゲル中で基本的に1つのバンドを生じる核酸またはポリペプチドは、「精製されている」。精製された本発明の核酸またはタンパク質は、少なくとも約50%純粋、通常、少なくとも約75%、約80%、約85%、約90%、約95%、約96%、約99%以上純粋(例えば、重量パーセントまたはモルベース)である。
「組換え」という用語は、物質(例えば、核酸またはポリペプチド)がヒトの介入によって人工的に(すなわち、非天然に)変えられていることを示す。該変化は、その天然の環境もしくは状態内のまたはそこから取り出された物質に対して実施することができる。例えば、「組換え核酸」は、例えば、クローニング、親和性改変、DNAシャッフリングまたは他の周知の分子生物学的手順の間に、核酸を組換えることによって作製されるものである。「組換えDNA分子」は、このような分子生物学的技術によって一緒に接続されたDNAの断片から構成される。「組換えタンパク質」または「組換えポリペプチド」という用語は、本明細書において使用される場合、組換えDNA分子を使用して発現されるタンパク質分子を指す。「組換え宿主細胞」は、組換え核酸を含有する及び/または発現する細胞であるか、または別様に遺伝子操作(例えば、組換えタンパク質(例えば、本明細書において提供される膜貫通型免疫調節タンパク質)をコードする核酸分子を細胞に導入することによって)により変化された細胞である。真核生物における転写制御シグナルは、「プロモーター」及び「エンハンサー」エレメントを含む。プロモーター及びエンハンサーは、転写に関与する細胞タンパク質と特異的に相互作用する短いDNA配列アレイからなる。プロモーター及びエンハンサーエレメントは、酵母、昆虫及び哺乳動物細胞ならびにウイルス中の遺伝子を含む多種多様な真核生物源から単離されている(類似した制御エレメント、すなわちプロモーターはまた原核生物中にも見いだされる)。特定のプロモーター及びエンハンサーの選択は、関心対象のタンパク質を発現させるためにどんな細胞タイプが使用されるかによる。「作動可能な組み合わせにある」、「作動可能な順序にある」及び「作動可能に連結されている」という用語は、本明細書において使用される場合、所与の遺伝子の転写及び/または所望のタンパク質分子の合成を指令することが可能な核酸分子が産生される様式または配向での核酸配列の連結を指す。
「組換え発現ベクター」という用語は、本明細書において使用される場合、所望のコード配列とその作動可能に連結されているコード配列の特定の宿主細胞における発現に必要な適切な核酸配列とを含有するDNA分子を指す。原核生物において発現に必要な核酸配列は、プロモーター、任意でオペレーター配列、リボソーム結合部位、及び場合によっては他の配列を含む。真核細胞は、プロモーター、エンハンサー、ならびに終止シグナル及びポリアデニル化シグナルを利用することが知られている。所望により、細胞からの融合タンパク質のより簡易な単離のため、発現された融合タンパク質が組換え宿主細胞によって分泌されることができるように、分泌シグナルペプチド配列がまた、任意で、組換えタンパク質(例えば、組換え融合タンパク質)のコード配列に作動可能に連結されている組換え発現ベクターによってコードされることができる。この用語は、自己複製する核酸構造としてのベクター、及びそれが導入された宿主細胞のゲノムに組み込まれたベクターを含む。ベクターの中には、ウイルスベクター、例えばレンチウイルスベクターがある。
「選択性」という用語は、コグネイト結合パートナーなどのある基質の特異的結合に関して、対象タンパク質またはポリペプチドの、当該対象タンパク質の異なるコグネイト結合パートナーなどの別の基質に対する特異的結合と比較した、優先度を指す。選択性は、対象タンパク質と第1の基質(例えば第1のコグネイト結合パートナー)との結合活性(例えば、結合親和性)(例えば、Kd1)と、同じ対象タンパク質と第2のコグネイト結合パートナーとの結合活性(例えば、結合親和性)(例えば、Kd2)との比率として反映することができる。
「配列同一性」という用語は、本明細書において使用される場合、遺伝子またはタンパク質間の、それぞれヌクレオチドまたはアミノ酸レベルでの配列同一性を指す。「配列同一性」は、アミノ酸レベルでのタンパク質間の同一性の尺度及びヌクレオチドレベルでの核酸間の同一性の尺度である。タンパク質の配列同一性は、配列を整列したときの各配列中の所与の位置におけるアミノ酸配列を比較することによって決定され得る。同様に、核酸の配列同一性は、配列を整列したときの各配列中の所与の位置におけるヌクレオチド配列を比較することによって決定され得る。比較のための配列のアラインメントのための方法は、当技術分野において周知であり、そのような方法には、GAP、BESTFIT、BLAST、FASTA、及びTFASTAが挙げられる。BLASTアルゴリズムは、配列同一性パーセントを計算し、2つの配列間の類似性の統計解析を実施する。BLAST解析を実施するためのソフトウェアは、国立生物工学情報センター(NCBI)のウェブサイトを通じて公的に利用可能である。
「可溶性」という用語は、タンパク質に関して本明細書において使用される場合、タンパク質が膜タンパク質ではないことを意味する。概して、可溶性タンパク質は、IgSFドメイン(複数可)またはその特異的結合断片を含有するIgSFファミリーメンバー受容体の細胞外ドメインまたはその一部分のみを含有するが、膜貫通ドメインを含有しない。場合によっては、Fcドメインへ直接またはリンカーを介して間接的に連結または結合させることによってタンパク質の溶解性を改善することができ、これは、場合によっては、タンパク質の安定性及び/または半減期も改善することができる。いくつかの態様では、可溶性タンパク質は、Fc融合タンパク質である。
「種」という用語は、ポリペプチドまたは核酸に関して本明細書において使用される場合、同一のまたは実質的に同一の配列を有する分子の集団を意味する。同じ種のポリペプチド間の相違が、グリコシル化、リン酸化、ユビキチン化、ニトロシル化、メチル化、アセチル化、及び脂質化などの翻訳後修飾の差異が原因で起こり得る。アミノ末端またはカルボキシ末端において完全長種とわずか1、2、または3アミノ酸残基以下異なる(または差異をコードする)わずかに短縮されたポリペプチド配列は、単一種の配列であるとみなされる。そのような微小不均一性は、製造されたタンパク質の共通の特徴である。
「特異的結合断片」という用語は、本明細書において完全長野生型哺乳動物CD80ポリペプチドまたはそのIgVもしくはIgCドメインに関して使用される場合、IgV及び/またはIgCドメインの部分配列を有し、in vitro及び/またはin vivoで哺乳動物CD28、哺乳動物PD−L1及び/または哺乳動物CTLA−4(例えば、ヒトまたはネズミCD28、PD−L1及び/またはCTLA−4)に特異的に結合する、ポリペプチドを意味する。いくつかの実施形態では、CD80 IgVまたはCD80 IgCの特異的結合断片は、完全長野生型配列の配列長の少なくとも60%、70%、75%、80%、85%、90%、95%、96%、97%、98%、または99%である。バリアントCD80を形成するために、特異的結合断片の配列を変化させることができる。
「特異的に結合する」という用語は、本明細書において使用される場合、その親和性または結合活性が、十分な統計的サイズのランダムペプチドまたはポリペプチドの集合体に対する同じタンパク質の平均親和性または結合活性の少なくとも5倍大きく、しかし任意で少なくとも10、20、30、40、50、100、250または500倍大きく、またはさらに少なくとも1000倍大きくなるように、特異的結合条件下で、標的タンパク質に結合するタンパク質の能力を意味する。特異的に結合するタンパク質は、単一の標的分子のみに結合する必要はなく、標的と非標的(例えば、パラログまたはオーソログ)との間の構造形態の類似性に起因して非標的分子に特異的に結合し得る。当業者は、異なる動物種において同じ機能を有する分子(すなわち、オーソログ)への特異的結合または標的分子と実質的に類似のエピトープを有する非標的分子(例えば、パラログ)への特異的結合が可能であり、かつ、固有の非標的(例えば、ランダムポリペプチド)の統計的に有効な集合体に対して決定される結合の特異性を損なわないことを認識するだろう。したがって、本発明のポリペプチドは、交差反応性に起因して、2つ以上の別個の標的分子種に特異的に結合し得る。固相ELISAイムノアッセイまたは表面プラズモン共鳴(例えば、Biacore)測定を使用して、2つのタンパク質間の特異的結合を決定することができる。一般的に、2つの結合タンパク質間の相互作用は、1×10−5M未満、多くの場合1×10−12Mの低さの解離定数(Kd)を有する。本開示のある種の実施形態では、2つの結合タンパク質間の相互作用は、1×10−6M、1×10−7M、1×10−8M、1×10−9M、1×10−10Mまたは1×10−11Mの解離定数を有する。
ポリペプチドを発現する哺乳動物細胞に関して、「表面発現する」または「表面発現」という用語は、当該ポリペプチドが膜タンパク質として発現することを意味する。いくつかの実施形態では、膜タンパク質は、膜貫通型タンパク質である。
本明細書において使用される場合、「合成の」は、例えば、合成核酸分子または合成遺伝子または合成ペプチドに関して、組換え法及び/または化学合成法によって産生される核酸分子またはポリペプチド分子を指す。
「ターゲティング部分」という用語は、本明細書において使用される場合、バリアントCD80を含むポリペプチドに共有結合もしくは非共有結合されるか、またはそれを物理的にカプセル化する組成物を指す。ターゲティング部分は、細胞表面受容体(例えば、B7ファミリーメンバーPD−L1)、または腫瘍抗原(例えば、腫瘍特異的抗原(TSA)もしくは腫瘍関連抗原(TAA)、例えばB7−H6)のような所望のカウンター構造体に対して特異的結合親和性を有する。典型的には、所望のカウンター構造体は、特定の組織または細胞タイプ上に局在化される。ターゲティング部分は、抗体、抗原結合断片(Fab)、VH及びVLを含有する可変断片(Fv)、1つの鎖中で一緒に連結されたVH及びVLを含有する単鎖可変断片(scFv)、ならびに他の抗体V領域断片、例えばFab′、F(ab)2、F(ab′)2、dsFvダイアボディ、ナノボディ、可溶性受容体、受容体リガンド、親和性成熟された受容体もしくはリガンド、ならびに小分子(500ダルトン未満)組成物(例えば、特異的結合受容体組成物)を含む。ターゲティング部分はまた、本発明のポリペプチドをカプセル化するリポソームの脂質膜に共有結合または非共有結合させることもできる。
「膜貫通型タンパク質」という用語は、本明細書において使用される場合、脂質二重層を実質的にまたは完全に貫通する膜タンパク質を意味し、脂質二重層は、例えば、哺乳動物細胞などの生体膜中に、またはリポソームなどの人工構築物中に見いだされる。膜貫通型タンパク質は、脂質二重層に統合され、その統合が生理的条件下で熱力学的に安定である、膜貫通ドメイン(「膜貫通ドメイン」)を含む。膜貫通ドメインは、一般的に、水性環境(例えば、サイトゾル、細胞外液)と相互作用するタンパク質の領域と比較してその疎水性が高いことに基づいて、任意の数の市販のバイオインフォマティクスソフトウェアアプリケーションを介して膜貫通ドメインのアミノ酸配列から予測可能である。膜貫通ドメインは多くの場合、膜を貫通する疎水性αヘリックスである。膜貫通型タンパク質は、脂質二重層の両方の層を1回または複数回貫通することができる。本明細書に記載の提供される膜貫通型免疫調節タンパク質は、膜貫通型タンパク質に含まれる。膜貫通ドメインに加えて、本発明の膜貫通型免疫調節タンパク質は、エクトドメインをさらに含み、いくつかの実施形態ではエンドドメインをさらに含む。
疾患または障害の「治療すること」、「治療」または「治療法」という用語は、本明細書において使用される場合、本発明の治療用組成物(例えば、免疫調節タンパク質または操作された細胞を含有する)を、単独、または本明細書に記載される別の化合物との組み合わせのいずれかで投与することによる臨床または診断症状のいずれかの低減、停止、または排除によって証明される、疾患または障害の進行を遅延、中断、または回復させることを意味する。「治療すること」、「治療」または「治療法」はまた、急性もしくは慢性疾患もしくは障害における症状の重症度の低下、または再発率の低下(例えば、自己免疫疾患経過を再発するまたは寛解する場合において)、または自己免疫疾患の炎症態様の場合における炎症の低減も意味する。がんの文脈において本明細書で使用される場合、がんの「治療」、がんを「阻害する」、がんを「阻害すること」またはがんの「阻害」という用語は、限定されないがResponse Evaluation Criteria for Solid Tumors(RECIST)のような標準的な基準によって測定した場合の、腫瘍成長率の統計的に有意な低下、腫瘍成長の停止、または腫瘍のサイズ、質量、代謝活性もしくは体積の低下、または無増悪生存期間(PFS)もしくは全生存期間(OS)の統計的に有意な向上のうちの少なくとも1つを指す。疾患もしくは障害を「予防する」、疾患もしくは障害の「予防(prophylaxis)」または疾患もしくは障害の「予防(prevention)」は、本発明の文脈において使用される場合、疾患もしくは障害の出現もしくは発症または疾患もしくは障害の症状の一部もしくは全てを予防するか、または疾患もしくは障害の発症の可能性を低下させるための、本発明の免疫調節ポリペプチドまたは操作された細胞を単独または別の化合物との組み合わせのいずれかで投与することを指す。
「腫瘍特異的抗原」または「TSA」という用語は、本明細書において使用される場合、哺乳動物対象の腫瘍細胞上に主に存在するが一般的に哺乳動物対象の正常細胞上には見いだされないカウンター構造体を指す。腫瘍特異的抗原は腫瘍細胞のみに存在する必要はないが、腫瘍特異的抗原を有する特定の哺乳動物の細胞の割合が十分に高いか、または腫瘍の表面の腫瘍特異的抗原のレベルが十分に高いため、それにより抗腫瘍治療薬(例えば、本発明の免疫調節ポリペプチド)でターゲティングでき、そして腫瘍の影響から哺乳動物を予防または治療することを提供する。いくつかの実施形態では、腫瘍を有する哺乳動物由来の細胞のランダム統計試料では、TSAを提示する細胞の少なくとも50%ががん性である。他の実施形態では、TSAを提示する細胞の少なくとも60%、70%、80%、85%、90%、95%、または99%ががん性である。
「バリアント」(また「改変された」または「変異体」)という用語は、バリアントCD80に関して使用される場合、ヒト介入によって作製されたCD80、例えば哺乳動物(例えば、ヒトまたはネズミ)CD80を意味する。バリアントCD80は、非改変または野生型CD80と比べて、変化したアミノ酸配列を有するポリペプチドである。バリアントCD80は、野生型CD80アイソフォーム配列と1つまたは複数のアミノ酸置換、欠失、付加、またはそれらの組み合わせが異なるポリペプチドである。本明細書における目的のために、バリアントCD80は少なくとも1つの親和性改変ドメインを含有し、それにより1つまたは複数のアミノ酸差異がIgSFドメイン(例えば、IgVドメイン)に生じる。バリアントCD80は、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、またはそれ以上のアミノ酸差異、例えばアミノ酸置換を含有することができる。バリアントCD80ポリペプチドは、一般的に、対応する野生型または非改変CD80、例えばSEQ ID NO:1の配列、その成熟配列またはその細胞外ドメインもしくはIgSFドメインを含有するそれらの部分に対して少なくとも50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%以上の配列同一性を示す。いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:2、SEQ ID NO:76、またはSEQ ID NO:150、SEQ ID NO:3030、またはSEQ ID NO:3031に記載の配列を含む、対応する野生型または非改変CD80に対して少なくとも50%、60%、70%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%以上の配列同一性を示す。
天然には存在しないアミノ酸及び天然に存在するアミノ酸が、許容される置換または付加の範囲内に含まれる。バリアントCD80は、任意の特定の作製方法に限定されることはなく、例えばデノボ化学合成、デノボ組換えDNA技術、またはそれらの組み合わせを含む。本発明のバリアントCD80は、哺乳動物種のCD28、PD−L1及び/またはCTLA−4のうちの少なくとも1つまたは複数に特異的に結合する。いくつかの実施形態では、変化したアミノ酸配列は、非改変または野生型CD80タンパク質と比較して、CD28、PD−L1及び/またはCTLA−4に対する結合親和性または結合活性の変化(すなわち、増加または減少)をもたらす。結合親和性または結合活性の増加または減少は、フローサイトメトリーなどの周知の結合アッセイを使用して決定することができる。Larsen et al.,American Journal of Transplantation,Vol 5:443−453(2005)。また、Linsley et al.,Immunity,Vol 1(9):793−801(1994)も参照のこと。CD28、PD−L1及び/またはCTLA−4へのバリアントCD80の結合親和性または結合活性の増加は、非改変または野生型CD80の値よりも少なくとも5%大きい値であることができ、いくつかの実施形態では、非改変または野生型CD80対照値の値よりも少なくとも10%、15%、20%、30%、40%、50%、100%大きい値であることができる。CD28、PD−L1及び/またはCTLA−4に対するCD80の結合親和性または結合活性の減少は、非改変または野生型CD80対照値の95%以下の値までであり、いくつかの実施形態では、非改変または野生型CD80対照値の結合親和性または結合活性の80%、70%、60%、50%、40%、30%、20%、10%、5%以下または、検出不可能の値までである。バリアントCD80ポリペプチドは、アミノ酸残基の置換、付加、または欠失によって一次アミノ酸配列が変化している。バリアントCD80ポリペプチドの文脈における「バリアント」という用語は、バリアントCD80が作製される任意の特定の出発組成物または方法のいかなる条件も強要するものと解釈されるべきではない。バリアントCD80は、例えば、野生型哺乳動物CD80配列情報から開始して生成され、次いでCD28、PD−L1及び/またはCTLA−4への結合についてin silicoでモデル化され、そして最後に組換えまたは化学合成されて、バリアントCD80を得ることができる。しかし別の一例では、バリアントCD80は、非改変または野生型CD80の部位特異的変異誘発によって作製することができる。したがって、バリアントCD80は、組成物を意味するが、必ずしも任意の所与のプロセスによって産生される産物である必要はない。組換え法、化学合成、またはその組み合わせを含む多種多様な技術を用いてもよい。
「野生型」または「自然」または「天然」という用語は、本明細書において使用される場合、核酸分子、タンパク質(例えば、CD80)、IgSFメンバー、宿主細胞などの生体物質に関して用いられ、天然に見いだされかつヒトの介入によって改変されていないものを指す。
II.バリアントCD80ポリペプチド
1つまたは複数のCD80結合パートナーに対して変化した(増加または減少した)結合活性または親和性を示すバリアントCD80ポリペプチドが本明細書において提供される。いくつかの実施形態では、CD80結合パートナーは、CD28、PD−L1、またはCTLA−4である。いくつかの実施形態では、バリアントCD80ポリペプチドは、免疫グロブリンスーパーファミリー(IgSF)ドメイン(IgD)において、野生型もしくは非改変CD80ポリペプチド、またはIgDを含有する野生型もしくは非改変CD80の一部分、またはそれらの特異的結合断片と比べて、1つまたは複数のアミノ酸改変、例えば1つまたは複数の置換(あるいは、「変異」または「交換」)、欠失、または付加を含有する。したがって、提供されるバリアントCD80ポリペプチドは、1つまたは複数のアミノ酸改変(例えば、置換)がIgDにある、バリアントIgD(以下「vIgD」と呼ばれる)であるか、またはそれを含む。
いくつかの実施形態では、IgDは、IgVドメインもしくはIgC(例えば、IgC2)ドメイン、またはIgVドメインもしくはIgC(例えば、IgC2)ドメインの特異的結合断片、またはそれらの組み合わせを含む。いくつかの実施形態では、IgDは、IgVのみ、細胞外ドメイン(ECD)全体を含むIgVとIgCの組み合わせ、またはCD80のIgドメインの任意の組み合わせであり得る。表2は、CD80のIgVまたはIgC領域に対応する例示的な残基を提供する。いくつかの実施形態では、バリアントCD80ポリペプチドは、少なくとも1つのアミノ酸改変(例えば、置換)がIgVドメインまたはIgCドメインまたはそれらの特異的結合断片にある、IgVドメインまたはIgCドメインまたはそれらの特異的結合断片を含有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、少なくとも1つのアミノ酸改変(例えば、置換)がIgVドメインまたはその特異的結合断片にある、IgVドメインまたはその特異的結合断片を含有する。いくつかの実施形態では、変化した結合活性または親和性によって、変化したIgVドメインまたはIgCドメインは、親和性改変IgSFドメインである。
いくつかの実施形態では、バリアントは、非改変CD80配列の配列と比べて、もう1つのIgSFドメインが改変されている。いくつかの実施形態では、非改変CD80配列は、野生型CD80である。いくつかの実施形態では、非改変または野生型CD80は、天然CD80またはそのオーソログの配列を有する。いくつかの実施形態では、非改変CD80は、1つまたは複数のIgSFドメイン(表2を参照のこと)を含有するCD80の細胞外ドメイン(ECD)またはその一部分であるか、またはそれを含む。例えば、非改変CD80ポリペプチドは、SEQ ID NO:1のアミノ酸35〜135、SEQ ID NO:1のアミノ酸35〜138(SEQ ID NO:3030を参照)、またはSEQ ID NO:1のアミノ酸35〜141として記載されるIgVドメインであるか、またはそれを含む。場合によっては、非改変CD80ポリペプチドは、SEQ ID NO:1のアミノ酸145〜230またはSEQ ID NO:1のアミノ酸142〜232として記載されるIgCドメインであるか、またはそれを含む。いくつかの実施形態では、非改変または野生型CD80ポリペプチドの細胞外ドメインは、IgVドメイン及びIgCドメイン(複数可)を含む。しかしながら、バリアントCD80ポリペプチドは、IgVドメイン及びIgCドメイン(複数可)の両方を含む必要はない。いくつかの実施形態では、バリアントCD80ポリペプチドは、IgVドメインまたはその特異的結合断片を含むかまたは本質的にそれからなる。いくつかの実施形態では、バリアントCD80ポリペプチドは、IgCドメインまたはその特異的結合断片を含むかまたは本質的にそれからなる。いくつかの実施形態では、バリアントCD80は、可溶性であり、かつ膜貫通ドメインを欠く。いくつかの実施形態では、バリアントCD80はさらに、膜貫通ドメインを含み、場合によっては細胞質ドメインも含む。
いくつかの実施形態では、野生型または非改変CD80ポリペプチドは、哺乳動物CD80ポリペプチド、例えば、限定されないがヒト、マウス、カニクイザル、またはラットCD80ポリペプチドである。いくつかの実施形態では、野生型または非改変CD80配列は、ヒトである。
いくつかの実施形態では、野生型または非改変CD80ポリペプチドは、(i)SEQ ID NO:1に記載のアミノ酸配列もしくはシグナル配列を欠くその成熟形態を有するか、(ii)SEQ ID NO:1に対して少なくとも約85%、約86%、約87%、約88%、約89%、約90%、約91%、約92%、約93%、約94%、約95%、約96%、約97%、約98%、約99%の配列同一性を示すアミノ酸配列もしくはその成熟形態を有するか、または(iii)IgVドメインもしくはIgCドメインもしくはその特異的結合断片を含有する(i)または(ii)の一部分である。
いくつかの実施形態では、野生型または非改変CD80ポリペプチドは、CD80の細胞外ドメインまたはその一部分であるか、またはそれを含む。例えば、いくつかの実施形態では、非改変または野生型CD80ポリペプチドは、SEQ ID NO:2に記載のアミノ酸配列、またはそのオーソログを含む。例えば、非改変または野生型CD80ポリペプチドは、(i)SEQ ID NO:2に記載のアミノ酸の配列を含むことができるか、(ii)SEQ ID NO:2に対して少なくとも約85%、約86%、約87%、約88%、約89%、約90%、約91%、約92%、約93%、約94%、約95%、約96%、約97%、約98%、約99%の配列同一性を有するアミノ酸配列を含むことができるか、または(iii)IgVドメインもしくはIgCドメインを含む(i)もしくは(ii)の特異的結合断片である。いくつかの実施形態では、野生型または非改変CD80の細胞外ドメインは、1つまたは複数のCTLA−4、PD−L1またはCD28などの1つまたは複数のCD80結合タンパク質に結合することができる。
いくつかの実施形態では、野生型または非改変CD80ポリペプチドは、IgVドメインまたはIgCドメインまたはその特異的結合断片を含有する。いくつかの実施形態では、野生型または非改変CD80ポリペプチドのIgVドメインは、SEQ ID NO:76、150、3030もしくは3031に記載のアミノ酸配列またはそのオーソログを含む。例えば、非改変または野生型CD80ポリペプチドのIgVドメインは、(i)SEQ ID NO:76、150、3030もしくは3031に記載のアミノ酸配列を含有することができる、または(ii)SEQ ID NO:76、150、3030もしくは3031に対して少なくとも約85%、約86%、約87%、約88%、約89%、約90%、約91%、約92%、約93%、約94%、約95%、約96%、約97%、約98%、約99%の配列同一性を有するアミノ酸配列を含有することができる、または(iii)(i)もしくは(ii)の特異的結合断片である。いくつかの実施形態では、野生型または非改変IgVドメインは、1つまたは複数のCTLA−4、PD−L1またはCD28などの1つまたは複数のCD80結合タンパク質に結合することができる。
いくつかの実施形態では、野生型または非改変CD80ポリペプチドのIgCドメインは、SEQ ID NO:1の残基145〜230、154〜232、または142〜232として記載されるアミノ酸配列、またはそのオーソログを含む。例えば、非改変または野生型CD80ポリペプチドのIgCドメインは、(i)SEQ ID NO:1の残基145〜230、154〜232、もしくは142〜232として記載されるアミノ酸配列を含有することができる、または(ii)SEQ ID NO:1の残基145〜230、154〜232、もしくは142〜232に対して少なくとも約85%、約86%、約87%、約88%、約89%、約90%、約91%、約92%、約93%、約94%、約95%、約96%、約97%、約98%、約99%の配列同一性を有するアミノ酸配列を含有することができる、または(iii)(i)もしくは(ii)の特異的結合断片である。いくつかの実施形態では、野生型または非改変IgCドメインは、1つまたは複数のCD80結合タンパク質と結合することができる。
いくつかの実施形態では、野生型または非改変CD80ポリペプチドは、CD80の特異的結合断片、例えばIgVドメインまたはIgCドメインの特異的結合断片を含有する。いくつかの実施形態では、特異的結合断片は、CTLA−4、PD−L1及び/またはCD28と結合することができる。特異的結合断片は、少なくとも50アミノ酸、例えば少なくとも60、70、80、90、100、または110アミノ酸のアミノ酸長を有することができる。いくつかの実施形態では、IgVドメインの特異的結合断片は、SEQ ID NO:1のアミノ酸35〜135、35〜138、37〜138または35〜141として記載されるIgVドメインの長さの少なくとも約85%、約86%、約87%、約88%、約89%、約90%、約91%、約92%、約93%、約94%、約95%、約96%、約97%、約98%、約99%であるアミノ酸配列を含有する。いくつかの実施形態では、IgCドメインの特異的結合断片は、SEQ ID NO:1のアミノ酸145〜230、154〜232、または142〜232として記載されるIgCドメインの長さの少なくとも約85%、約86%、約87%、約88%、約89%、約90%、約91%、約92%、約93%、約94%、約95%、約96%、約97%、約98%、約99%であるアミノ酸配列を含む。
いくつかの実施形態では、バリアントCD80ポリペプチドは、1つまたは複数の親和性改変IgSFドメインを含むECDドメインまたはその一部分を含む。いくつかの実施形態では、バリアントCD80ポリペプチドは、少なくとも1つのIgVドメインまたはIgCドメインが1つまたは複数のアミノ酸改変(例えば、置換)を含有する、IgVドメインもしくはIgCドメイン、またはIgVドメインの特異的結合断片もしくはIgCドメインの特異的結合断片を含むことができる。いくつかの実施形態では、バリアントCD80ポリペプチドは、IgVドメイン及びIgCドメイン、またはIgVドメインの特異的結合断片及びIgCドメインの特異的結合断片を含むことができる。いくつかの実施形態では、バリアントCD80ポリペプチドは、完全長IgVドメインを含む。いくつかの実施形態では、バリアントCD80ポリペプチドは、完全長IgCドメインを含む。いくつかの実施形態では、バリアントCD80ポリペプチドは、IgVドメインの特異的結合断片を含む。いくつかの実施形態では、バリアントCD80ポリペプチドは、IgCドメインの特異的結合断片を含む。いくつかの実施形態では、バリアントCD80ポリペプチドは、完全長IgVドメイン及び完全長IgCドメインを含む。いくつかの実施形態では、バリアントCD80ポリペプチドは、完全長IgVドメイン、及びIgCドメインの特異的結合断片を含む。いくつかの実施形態では、バリアントCD80ポリペプチドは、IgVドメインの特異的結合断片及び完全長IgCドメインを含む。いくつかの実施形態では、バリアントCD80ポリペプチドは、IgVドメインの特異的結合断片及びIgCドメインの特異的結合断片を含む。
このような実施形態のいずれかでは、バリアントCD80ポリペプチドの1つまたは複数のアミノ酸改変(例えば、置換)は、CD80ポリペプチドドメインのいずれか1つまたは複数に位置することができる。例えば、いくつかの実施形態では、1つまたは複数のアミノ酸改変(例えば、置換)は、バリアントCD80ポリペプチドの細胞外ドメインに位置する。いくつかの実施形態では、1つまたは複数のアミノ酸改変(例えば、置換)は、IgVドメインまたはIgVドメインの特異的結合断片に位置する。いくつかの実施形態では、1つまたは複数のアミノ酸改変(例えば、置換)は、IgCドメインまたはIgCドメインの特異的結合断片に位置する。
一般的に、ポリペプチドの様々な属性のそれぞれ(例えば、可溶性及び膜結合ポリペプチド、CTLA−4、PD−L1、及びCD28に対するCD80の親和性、ポリペプチド鎖当たりの変異の数、連結ポリペプチド鎖の数、バリアントCD80当たりのアミノ酸変化の数及び性質など)が、以下に個別に開示される。しかしながら、当業者に明らかであるとおり、任意の特定のポリペプチドが、これらの独立した属性の組み合わせを含むことができる。IgSFドメインのドメイン構成を説明するために使用されるSEQ ID NO:として記載される特定の配列への言及を含むアミノ酸についての言及は、例示を目的としており、提供される実施形態の範囲を限定することを意味していないことが理解されよう。ポリペプチド、及びそのドメインの説明は、類似の分子との相同性分析及びアラインメントに基づいて理論的に導出されることが理解されよう。したがって、正確な遺伝子座にはばらつきがあり得、必ずしもタンパク質毎に同じとは限らない。よって、特定のIgSFドメイン(例えば、特定のIgVドメインまたはIgCドメイン)は、いくつか(例えば、1、2、3、または4個)のアミノ酸分長いかまたは短い場合がある。
さらに、以下で考察されるような本発明の各種実施形態は、上に開示したとおりに定義された用語の意味の範囲内で頻繁に提供される。したがって、特定の定義において記載される実施形態は、定義された用語が本明細書に記載の様々な態様及び属性の考察において利用される場合、参照によって組み込まれると解釈されるべきである。したがって、見出し、様々な態様及び実施形態の提示の順序、ならびに各々独立した属性の別々の開示は、本開示の範囲に限定されることを意味するものではない。
A.例示的な改変
野生型または非改変CD80ポリペプチドに含有されるIgSFドメインと比べて、少なくとも1つの親和性改変IgSFドメイン(例えば、IgVまたはIgC)またはその特異的結合断片を含有し、その結果、該バリアントCD80ポリペプチドが、野生型または非改変CD80ポリペプチドと比較して、1つまたは複数のコグネイト結合パートナーCTLA−4、PD−L1またはCD28に対して変化した(増加または減少した)結合活性または親和性を示すバリアントCD80ポリペプチドが本明細書において提供される。いくつかの実施形態では、バリアントCD80ポリペプチドは、例えば固相ELISAイムノアッセイ、フローサイトメトリーまたは表面プラズモン共鳴(Biacore)アッセイによって測定した場合に、野生型または非改変CD80ポリペプチド対照配列のものとは異なる、CTLA−4、PD−L1またはCD28に対する結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、CTLA−4、PD−L1及び/またはCD28に対して増加した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CD28、PD−L1、及び/またはCTLA−4に対して減少した結合親和性を有する。CD28、PD−L1及び/またはCTLA−4は、哺乳動物タンパク質、例えばヒトタンパク質またはネズミタンパク質であることができる。
CTLA−4、PD−L1、及び/またはCD28に対する、変化した(例えば増加または減少した)結合活性または親和性は、野生型または非改変IgSFドメインのIgSFドメインにおける1つまたは複数のアミノ酸改変によって付与される。野生型または非改変CD80配列は、本明細書に記載のバリアントCD80ポリペプチドを生成するために、必ずしも出発組成物として使用される必要はない。したがって、「置換」という用語の使用は、提供される実施形態がバリアントCD80ポリペプチドの特定の作製法に限定されることを暗示するものではない。バリアントCD80ポリペプチドは、例えば、デノボペプチド合成によって作製されることができ、したがって、置換のためにコードするコドンを変えるという意味で、必ずしも「置換」を必要とするわけではない。この原則はまた、アミノ酸残基の「付加」及び「欠失」という用語にも及び、これも同じく特定の作製法を暗示するものではない。バリアントCD80ポリペプチドが設計または作製される手段は、いかなる特定の方法にも限定されない。しかしながら、いくつかの実施形態では、野生型または非改変CD80をコードする核酸が、実施例に開示された方法または当業者に知られている他の方法に従って、野生型または非改変CD80遺伝物質から変異誘発され、所望の特異的結合親和性及び/またはIFN−γ発現もしくは他の機能的活性の誘導についてスクリーニングされる。いくつかの実施形態では、バリアントCD80ポリペプチドは、任意の数の公的に利用可能なデータベースで利用可能なタンパク質または核酸配列を利用してデノボ合成され、次いで、その後スクリーニングされる。国立生物工学情報センターは、そのような情報を提供し、そのウェブサイトは、前述したようにUniProtKBデータベースと同じくインターネットを介して公的にアクセス可能である。
特に明記しない限り、本開示を通して示すとおり、アミノ酸改変(複数可)は、SEQ ID NO:2に記載の非改変ECD配列、または適用可能な場合は、以下のとおりSEQ ID NO:76、150、3030または3031に記載の非改変IgV配列の位置の番号付けに対応するアミノ酸位置番号によって指定される。
CD80ポリペプチド(そのIgSFドメイン(例えば、IgV)を含有するその一部分を含む)における改変(例えば、アミノ酸置換)の対応する位置を、例えば、SEQ ID NO:2またはSEQ ID NO:76またはSEQ ID NO:150またはSEQ ID NO:3030またはSEQ ID NO:3031を有する参照配列のアラインメントによって特定することは、当業者のレベルの範囲内である。本開示全体での改変の記載において、アミノ酸位置が中央に示され、対応する非改変(例えば、野生型)アミノ酸が番号の前に列挙され、特定されたバリアントのアミノ酸置換が番号の後に列挙される。改変が該位置の欠失である場合は「del」と表示され、改変が該位置における挿入である場合は「ins」と表示される。場合によっては、挿入が、中央に示されたアミノ酸位置と共に記載され、対応する非改変(例えば、野生型)アミノ酸が番号の前及び後に列挙され、特定されたバリアントのアミノ酸挿入が非改変(例えば、野生型)アミノ酸の後に列挙される。
いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80配列に1つまたは複数のアミノ酸改変(例えば、置換)を有する。1つまたは複数のアミノ酸改変(例えば、置換)は、野生型または非改変CD80配列のエクトドメイン(細胞外ドメイン)、例えば細胞外ドメインにあることができる。いくつかの実施形態では、1つまたは複数のアミノ酸改変(例えば、置換)は、IgVドメインまたはその特異的結合断片にある。いくつかの実施形態では、1つまたは複数のアミノ酸改変(例えば、置換)は、IgCドメインまたはその特異的結合断片にある。バリアントCD80ポリペプチドのいくつかの実施形態では、1つまたは複数のアミノ酸改変(例えば、置換)のいくつかは、IgVドメインまたはその特異的結合断片にあり、1つまたは複数のアミノ酸改変(例えば、置換)のいくつかは、IgCドメインまたはその特異的結合断片にある。
いくつかの実施形態では、バリアントCD80ポリペプチドは、最大1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、または20個のアミノ酸改変(例えば、置換)を有する。改変(例えば、置換)は、IgVドメインまたはIgCドメインにあることができる。いくつかの実施形態では、バリアントCD80ポリペプチドは、IgVドメインまたはその特異的結合断片に最大1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、または20個のアミノ酸改変(例えば、置換)を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、IgCドメインまたはその特異的結合断片に最大1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、または20個のアミノ酸改変(例えば、置換)を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドまたはその特異的結合断片(例えば、SEQ ID NO:2、76、150、3030または3031のアミノ酸配列)と少なくとも約85%、約86%、約87%、約88%、約89%、約90%、約91%、約92%、約93%、約94%、約95%、約96%、約97%、約98%、または約99%の配列同一性を有する。
いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:2の番号付けに基づいた7、13、15、16、20、22、23、24、25、26、27、30、31、33、34、35、36、38、41、42、43、46、47、48、51、53、54、55、57、58、61、62、65、67、68、69、70、71、72、73、74、76、77、78、79、81、82、84、85、86、87、88、92、94、95及び/または97位(複数可)に対応する、非改変CD80またはその特異的結合断片に1つまたは複数のアミノ酸改変(例えば、置換)を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:2の番号付けに基づいた7、23、26、30、34、35、46、51、55、57、58、65、71、73、78、79、82または84位に対応する、非改変CD80またはその特異的結合断片に1つまたは複数のアミノ酸改変(例えば、置換)を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、任意の2つ以上の前述の位置、例えば2、3、4、5、6、7、8、9、10、11、12、13、14、15、またはそれ以上の位置に改変、例えばアミノ酸置換を有する。
いくつかの実施形態では、バリアントCD80ポリペプチドは、
の中から選択される1つまたは複数のアミノ酸置換を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、E7D、E23D、E23G、A26E、A26P、A26S、A26T、I30F、I30T、I30V、K34E、E35D、E35G、D46E、D46V、P51A、N55D、N55I、T57A、T57I、I58V、L65P、A71D、A71G、R73S、G78A、T79A、T79I、T79L、T79P、C82R、V84A、V84I、L85Qから選択される1つまたは複数のアミノ酸置換、またはその保存的アミノ酸置換を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、任意の2つ以上の前述のアミノ酸置換、例えば2、3、4、5、6、7、8、9、10、11、12、13、14、15、または以上のアミノ酸置換を含む。いくつかの実施形態では、バリアントCD80ポリペプチドは、1つのみの前述のアミノ酸置換を含む非改変または野生型CD80ポリペプチドと比較して、1つのみのアミノ酸差異を含む。
いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:2の番号付けに基づいた12、18、29、31、37、38、41、43、44、47、61、67、68、69、70、72、77、83、88、89、90、91または93位に対応する、非改変CD80またはその特異的結合断片に1つまたは複数の追加のアミノ酸改変(例えば、置換)を含有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、A12T、A12V、H18L、H18Y、R29H、Y31H、K37E、M38T、T41A、M43I、S44P、M47L、M47T、I67T、V68A、V68M、I69T、L70P、L70R、L70Q、L72P、E77G、V83A、V83I、E88D、K89E、K89N、D90G、D90N、A91T、K93Rの中から選択される1つまたは複数の追加のアミノ酸置換を有する。
保存的アミノ酸置換は、野生型または非改変アミノ酸以外の、置換されたアミノ酸と同じクラスのアミノ酸に属する任意のアミノ酸である。アミノ酸のクラスは、脂肪族(グリシン、アラニン、バリン、ロイシン、及びイソロイシン)、ヒドロキシルまたは硫黄含有(セリン、システイン、スレオニン、及びメチオニン)、環状(プロリン)、芳香族(フェニルアラニン、チロシン、トリプトファン)、塩基性(ヒスチジン、リジン、及びアルギニン)、及び酸性/アミド(アスパラギン酸、グルタミン酸、アスパラギン、及びグルタミン)である。したがって、例えば、A26E置換の保存的アミノ酸置換には、A26D、A26N、及びA26Qアミノ酸置換が含まれる。
いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:2に記載の位置の番号付けに基づいた18位に対応する位置に非改変CD80またはその特異的結合断片のアミノ酸改変を含む。いくつかの実施形態では、アミノ酸改変は、アミノ酸置換H18Y、またはその保存的アミノ酸置換である。いくつかの実施形態では、バリアントCD80ポリペプチドは、26、35、46、47、68、71、85または90の1つまたは複数の位置に、1つまたは複数のアミノ酸改変、例えばアミノ酸置換をさらに含有する。いくつかの実施形態では、1つまたは複数のアミノ酸改変は、A26E、E35D、D46E、D46V、M47I、M47L、V68M、A71G、L85QまたはD90Gの1つまたは複数のアミノ酸置換、またはその保存的アミノ酸置換である。いくつかの実施形態では、バリアントCD80ポリペプチドは、アミノ酸改変H18Y/A26E、H18Y/E35D、H18Y/D46E、H18Y/D46V、H18Y/M47I、H18Y/M47L、H18Y/V68M、H18Y/A71G、H18Y/L85Q、H18Y/D90Gを含む。バリアントCD80ポリペプチドは、提供される実施形態に従ってさらなるアミノ酸改変を提供することができる。表1は、記載される例示的なアミノ酸改変及びバリアントCD80ポリペプチドについて記載する。
いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:2に記載の位置の番号付けに基づいた26位に対応する位置に非改変CD80またはその特異的結合断片のアミノ酸改変を含む。いくつかの実施形態では、アミノ酸改変は、アミノ酸置換A26E、またはその保存的アミノ酸置換である。いくつかの実施形態では、バリアントCD80ポリペプチドは、18、35、46、47、68、71、85または90の1つまたは複数の位置に、1つまたは複数のアミノ酸改変、例えばアミノ酸置換をさらに含有する。いくつかの実施形態では、1つまたは複数のアミノ酸改変は、H18Y、E35D、D46E、D46V、M47I、M47L、V68M、A71G、L85QまたはD90Gの1つまたは複数のアミノ酸置換、またはその保存的アミノ酸置換である。いくつかの実施形態では、バリアントCD80ポリペプチドは、アミノ酸改変H18Y/A26E、A26E/E35D、A26E/D46E、A26E/D46V、A26E/M47I、A26E/M47L、A26E/V68M、A26E/A71G、A26E/L85Q、A26E/D90Gを含む。バリアントCD80ポリペプチドは、提供される実施形態に従って、本明細書に記載されるものなどのさらなるアミノ酸改変を含むことができる。表1は、記載される例示的なアミノ酸改変及びバリアントCD80ポリペプチドについて記載する。
いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:2に記載の位置の番号付けに基づいた35位に対応する位置に非改変CD80またはその特異的結合断片のアミノ酸改変を含む。いくつかの実施形態では、アミノ酸改変は、アミノ酸置換E35D、またはその保存的アミノ酸置換である。いくつかの実施形態では、バリアントCD80ポリペプチドは、18、26、46、47、68、71、85または90の1つまたは複数の位置に、1つまたは複数のアミノ酸改変、例えばアミノ酸置換をさらに含有する。いくつかの実施形態では、1つまたは複数のアミノ酸改変は、H18Y、A26E、D46E、D46V、M47I、M47L、V68M、A71G、L85QまたはD90Gの1つまたは複数のアミノ酸置換、またはその保存的アミノ酸置換である。いくつかの実施形態では、バリアントCD80ポリペプチドは、アミノ酸改変H18Y/E35D、A26E/E35D、E35D/D46E、E35D/D46V、E35D/M47I、E35D/M47L、E35D/V68M、E35D/A71G、E35D/L85Q、E35D/D90Gを含む。バリアントCD80ポリペプチドは、提供される実施形態に従って、本明細書に記載されるものなどのさらなるアミノ酸改変を含むことができる。表1は、記載される例示的なアミノ酸改変及びバリアントCD80ポリペプチドについて記載する。いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:2に記載の位置の番号付けに基づいた46位に対応する位置に非改変CD80またはその特異的結合断片のアミノ酸改変を含む。いくつかの実施形態では、アミノ酸改変は、アミノ酸置換D46EまたはD46V、またはその保存的アミノ酸置換である。いくつかの実施形態では、バリアントCD80ポリペプチドは、18、26、35、47、68、71、85または90の1つまたは複数の位置に、1つまたは複数のアミノ酸改変、例えばアミノ酸置換をさらに含有する。いくつかの実施形態では、1つまたは複数のアミノ酸改変は、H18Y、A26E、E35D、M47I、M47L、V68M、A71G、L85QまたはD90Gの1つまたは複数のアミノ酸置換、またはその保存的アミノ酸置換である。いくつかの実施形態では、バリアントCD80ポリペプチドは、アミノ酸改変H18Y/D46E、A26E/D46E、E35D/D46E、D46E/M47I、D46E/M47L、D46E/V68M、D46E/A71G、D46E/L85Q、D46E/D90Gを含む。いくつかの実施形態では、バリアントCD80ポリペプチドは、アミノ酸改変H18Y/D46V、A26E/D46V、E35D/D46V、D46V/M47I、D46V/M47L、D46V/V68M、D46V/A71G、D46V/L85Q、D46V/D90Gを含む。バリアントCD80ポリペプチドは、提供される実施形態に従って、本明細書に記載されるものなどのさらなるアミノ酸改変を含むことができる。表1は、記載される例示的なアミノ酸改変及びバリアントCD80ポリペプチドについて記載する。
いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:2に記載の位置の番号付けに基づいた47位に対応する位置に非改変CD80またはその特異的結合断片のアミノ酸改変を含む。いくつかの実施形態では、アミノ酸改変は、アミノ酸置換M47IまたはM47L、またはその保存的アミノ酸置換である。いくつかの実施形態では、バリアントCD80ポリペプチドは、18、26、35、46、68、71、85または90の1つまたは複数の位置に、1つまたは複数のアミノ酸改変、例えばアミノ酸置換をさらに含有する。いくつかの実施形態では、1つまたは複数のアミノ酸改変は、H18Y、A26E、E35D、D46E、D46V、V68M、A71G、L85QまたはD90Gの1つまたは複数のアミノ酸置換、またはその保存的アミノ酸置換である。いくつかの実施形態では、バリアントCD80ポリペプチドは、アミノ酸改変H18Y/M47I、A26E/M47I、E35D/M47I、M47I/D46E、M47I/D46V、M47I/V68M、M47I/A71G、M47I/L85QまたはM47I/D90Gを含む。いくつかの実施形態では、バリアントCD80ポリペプチドは、アミノ酸改変H18Y/M47L、A26E/M47L、E35D/M47L、M47L/D46E、M47L/D46V、M47L/V68M、M47L/A71G、M47L/L85QまたはM47L/D90Gを含む。バリアントCD80ポリペプチドは、提供される実施形態に従って、本明細書に記載されるものなどのさらなるアミノ酸改変を含むことができる。表1は、記載される例示的なアミノ酸改変及びバリアントCD80ポリペプチドについて記載する。
いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:2に記載の位置の番号付けに基づいた68位に対応する位置に非改変CD80またはその特異的結合断片のアミノ酸改変を含む。いくつかの実施形態では、アミノ酸改変は、アミノ酸置換V68M、またはその保存的アミノ酸置換である。いくつかの実施形態では、バリアントCD80ポリペプチドは、18、26、35、46、47、71、85または90の1つまたは複数の位置に、1つまたは複数のアミノ酸改変、例えばアミノ酸置換をさらに含有する。いくつかの実施形態では、1つまたは複数のアミノ酸改変は、H18Y、A26E、E35D、D46E、D46V、M47I、M47L、A71G、L85QまたはD90Gの1つまたは複数のアミノ酸置換、またはその保存的アミノ酸置換である。いくつかの実施形態では、バリアントCD80ポリペプチドは、アミノ酸改変H18Y/V68M、A26E/V68M、E35D/V68M、D46E/V68M、D46V/D68M、M47I/V68M、M47L/V68M、V68M/A71G、V68M/L85Q、V68M/D90Gを含む。バリアントCD80ポリペプチドは、提供される実施形態に従って、本明細書に記載されるものなどのさらなるアミノ酸改変を含むことができる。表1は、記載される例示的なアミノ酸改変及びバリアントCD80ポリペプチドについて記載する。
いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:2に記載の位置の番号付けに基づいた71位に対応する位置に非改変CD80またはその特異的結合断片のアミノ酸改変を含む。いくつかの実施形態では、アミノ酸改変は、アミノ酸置換A71G、またはその保存的アミノ酸置換である。いくつかの実施形態では、バリアントCD80ポリペプチドは、18、26、35、46、47、68、85または90の1つまたは複数の位置に、1つまたは複数のアミノ酸改変、例えばアミノ酸置換をさらに含有する。いくつかの実施形態では、1つまたは複数のアミノ酸改変は、H18Y、A26E、E35D、D46E、D46V、M47I、M47L、V68M、L85QまたはD90Gの1つまたは複数のアミノ酸置換、またはその保存的アミノ酸置換である。いくつかの実施形態では、バリアントCD80ポリペプチドは、アミノ酸改変H18Y/A71G、A26E/A71G、E35D/A71G、D46E/A71G、D46V/D68M、M47I/A71G、M47L/A71G、V68M/A71G、A71G/L85Q、A71G/D90Gを含む。バリアントCD80ポリペプチドは、提供される実施形態に従って、本明細書に記載されるものなどのさらなるアミノ酸改変を含むことができる。表1は、記載される例示的なアミノ酸改変及びバリアントCD80ポリペプチドについて記載する。
いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:2に記載の位置の番号付けに基づいた85位に対応する位置に非改変CD80またはその特異的結合断片のアミノ酸改変を含む。いくつかの実施形態では、アミノ酸改変は、アミノ酸置換L85Q、またはその保存的アミノ酸置換である。いくつかの実施形態では、バリアントCD80ポリペプチドは、18、26、35、46、47、68、71または90の1つまたは複数の位置に、1つまたは複数のアミノ酸改変、例えばアミノ酸置換をさらに含有する。いくつかの実施形態では、1つまたは複数のアミノ酸改変は、H18Y、A26E、E35D、D46E、D46V、M47I、M47L、V68M、A71GまたはD90Gの1つまたは複数のアミノ酸置換、またはその保存的アミノ酸置換である。いくつかの実施形態では、バリアントCD80ポリペプチドは、アミノ酸改変H18Y/L85Q、A26E/L85Q、E35D/L85Q、D46E/L85Q、D46V/D68M、M47I/L85Q、M47L/L85Q、V68M/L85Q、A71G/L85Q、L85Q/D90Gを含む。バリアントCD80ポリペプチドは、提供される実施形態に従って、本明細書に記載されるものなどのさらなるアミノ酸改変を含むことができる。表1は、記載される例示的なアミノ酸改変及びバリアントCD80ポリペプチドについて記載する。
いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:2に記載の位置の番号付けに基づいた90位に対応する位置に非改変CD80またはその特異的結合断片のアミノ酸改変を含む。いくつかの実施形態では、アミノ酸改変は、アミノ酸置換D90G、またはその保存的アミノ酸置換である。いくつかの実施形態では、バリアントCD80ポリペプチドは、18、26、35、46、47、68、71または85 の1つまたは複数の位置に、1つまたは複数のアミノ酸改変、例えばアミノ酸置換をさらに含有する。いくつかの実施形態では、1つまたは複数のアミノ酸改変は、H18Y、A26E、E35D、D46E、D46V、M47I、M47L、V68M、A71GまたはL85Qの1つまたは複数のアミノ酸置換、またはその保存的アミノ酸置換である。いくつかの実施形態では、バリアントCD80ポリペプチドは、アミノ酸改変H18Y/D90G、A26E/D90G、E35D/D90G、D46E/D90G、D46V/D68M、M47I/D90G、M47L/D90G、V68M/D90G、A71G/D90G、L85Q/D90Gを含む。バリアントCD80ポリペプチドは、提供される実施形態に従って、本明細書に記載されるものなどのさらなるアミノ酸改変を含むことができる。表1は、記載される例示的なアミノ酸改変及びバリアントCD80ポリペプチドについて記載する。
いくつかの実施形態では、バリアントCD80ポリペプチドはSEQ ID NO:2、76または150に記載の非改変CD80ポリペプチドにアミノ酸改変を含有せず、アミノ酸改変は、H18Y/M47I/T57I/A71G、H18Y/A26T/E35D/A71D/L85QまたはH18Y/A71D/L72P/E88Vのみである。いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:41、59、66、115、133、140、189、207または214に記載のポリペプチドではない。
いくつかの実施形態では、バリアントCD80ポリペプチドはSEQ ID NO:2、76または150に記載の非改変CD80ポリペプチドにアミノ酸改変を含有せず、アミノ酸改変は、A26E/E35D/M47L/L85Qのみである。いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:73、147または221に記載のポリペプチドではない。
いくつかの実施形態では、バリアントCD80ポリペプチドはSEQ ID NO:2、76または150に記載の非改変CD80ポリペプチドにアミノ酸改変を含有せず、アミノ酸改変は、E35D/M47I/L65P/D90N、L25S/E35D/M47I/D90N、E35D/A71D、E35D/M47I、E35D/T57I/L70Q/A71D、E35D/A71D、E35D/I67L/A71D.E35D、E35D/M47I/L70M、E35D/A71D/L72V、E35D/M43L/L70M、A26P/E35D/M43I/L85Q/E88D、E35D/D46V/L85Q、Q27L/E35D/M47I/T57I/L70Q/E88D、E35D/T57A/A71D/L85Q、H18Y/A26T/E35D/A71D/L85Q、E35D/M47L、E35D/M43I/A71D、E23G/A26S/E35D/T62N/A71D/L72V/L85M、A12T/E24D/E35D/D46V/I61V/L72P/E95V、V22L/E35D/M43L/A71G/D76H、A26E/E35D/M47L/L85Q、Y31H/E35D/T41S/V68L/K93R/R94Wのみである。いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:19、20、28、29、37、46、47、50、51、52、53、54、55、56、58、59、60、64、68、69,70、73、75、93、94、102、103、111、120、121、124、125、126、127、128、129、130、132、133、134、138、142、143、144、147、149、167、168、176、177、185、194、195、198、199、200、201、202、203、204、206、207、208、212、216、217、218、221または223に記載のポリペプチドではない。
いくつかの実施形態では、バリアントCD80ポリペプチドはSEQ ID NO:2、76または150に記載の非改変CD80ポリペプチドにアミノ酸改変を含有せず、アミノ酸改変は、E35D/D46V/L85Q、A12T/E24D/E35D/D46V/I61V/L72P/E95VまたはD46E/A71Dのみである。いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:55、69、74、129、143、148、203、217または222に記載のポリペプチドではない。
いくつかの実施形態では、バリアントCD80ポリペプチドはSEQ ID NO:2、76または150に記載の非改変CD80ポリペプチドにアミノ酸改変を含有せず、アミノ酸改変は、E35D/M47I/L65P/D90N、L25S/E35D/M47I/D90N、E35D/M47I、M47L/V68A、M47I/E88D、H18Y/M47I/T57I/A71G、T13R/M42V/M47I/A71D、E35D/M47I/L70M、Q27L/E35D/M47I/T57I/L70Q/E88D、E35D/M47L、A26E/E35D/M47L/L85Qのみである。いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:19、20、29、33、38、41、49、51、56、60、73、93、94、103、107、112、115、123、125、130、134、147、167、168、177、181、186、189、197、199、204、208、221に記載のポリペプチドではない。
いくつかの実施形態では、バリアントCD80ポリペプチドはSEQ ID NO:2、76または150に記載の非改変CD80ポリペプチドにアミノ酸改変を含有せず、アミノ酸改変は、A26E/E35D/M47L/L85Qのみである。いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:62、136、210に記載のポリペプチドではない。
いくつかの実施形態では、バリアントCD80ポリペプチドはSEQ ID NO:2、76または150に記載の非改変CD80ポリペプチドにアミノ酸改変を含有せず、アミノ酸改変は、H18Y/M47I/T57I/A71GまたはV22L/E35D/M43L/A71G/D76Hのみである。いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:41、70、115、144、189または218に記載のポリペプチドではない。
いくつかの実施形態では、バリアントCD80ポリペプチドはSEQ ID NO:2、76または150に記載の非改変CD80ポリペプチドにアミノ酸改変を含有せず、アミノ酸改変は、A26P/E35D/M43I/L85Q/E88D、E35D/D46V/L85Q、E35D/T57A/A71D/L85Q、H18Y/A26T/E35D/A71D/L85QまたはA26E/E35D/M47L/L85Qのみである。いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:54、55、58、59、73、128、129、132、133、147、202、203、206、207または221に記載のポリペプチドではない。
いくつかの実施形態では、バリアントCD80ポリペプチドは、E35D及びM47Lに対応する位置に、非改変CD80またはその特異的結合断片にアミノ酸改変を含む。いくつかの実施形態では、バリアントCD80ポリペプチドは、E35D及びM47Lに対応するアミノ酸改変を、非改変CD80またはその特異的結合断片に含む。いくつかの実施形態では、バリアントCD80ポリペプチドは、E35D及びA71Gに対応するアミノ酸改変を、非改変CD80またはその特異的結合断片に含む。いくつかの実施形態では、バリアントCD80ポリペプチドは、E35D及びM47Vに対応するアミノ酸改変を、非改変CD80またはその特異的結合断片に含む。いくつかの実施形態では、バリアントCD80ポリペプチドは、E35D及びV68Mに対応するアミノ酸改変を、非改変CD80またはその特異的結合断片に含む。いくつかの実施形態では、バリアントCD80ポリペプチドは、H18Y及びE35Dに対応するアミノ酸改変を、非改変CD80またはその特異的結合断片に含む。
いくつかの実施形態では、バリアントCD80ポリペプチドは、少なくとも3つのアミノ酸改変を含み、該少なくとも3つの改変には、SEQ ID NO:2に記載の位置の番号付けに基づいた18、26、35、46、47、68、71、85または90位に対応する3つ以上の位置での改変が含まれる。いくつかの実施形態では、少なくとも3つのアミノ酸改変は、H18Y、A26E、E35D、D46E、D46V、M47I、M47L、V68M、A71G、L85Q、またはD90G、またはその保存的アミノ酸置換に対応するアミノ酸改変を、非改変CD80またはその特異的結合断片に含む。
いくつかの実施形態では、バリアントCD80ポリペプチドは、E35D/M47L/V68Mに対応するアミノ酸改変を、非改変CD80またはその特異的結合断片に含む。
いくつかの実施形態では、バリアントCD80ポリペプチドは、E35D/M47V/V68Mに対応するアミノ酸改変を、非改変CD80またはその特異的結合断片に含む。
いくつかの実施形態では、バリアントCD80ポリペプチドは、E35D/M47L/L85Qに対応するアミノ酸改変を、非改変CD80またはその特異的結合断片に含む。
いくつかの実施形態では、バリアントCD80ポリペプチドは、H18Y/E35D/M47Iに対応するアミノ酸改変を、非改変CD80またはその特異的結合断片に含む。
いくつかの実施形態では、バリアントCD80ポリペプチドは、表1に列挙された置換(変異)のいずれかを含む。表1はまた、野生型CD80または例示的なバリアントCD80ポリペプチドの細胞外ドメイン(ECD)またはIgVドメインについてSEQ ID NO:を参照することにより例示的な配列を提供する。示されるように、所与のドメインに対応する正確な遺伝子座または残基は、ドメインの特定または分類に使用される方法などに応じて異なる場合がある。さらに、場合によっては、所与のドメイン(例えば、IgV)の隣接するN末端及び/またはC末端アミノ酸も、例えば発現されたときにドメインの適切なフォールディングを確実にするために、バリアントIgSFポリペプチドの配列に含めることができる。したがって、表1におけるSEQ ID NO:の例示は、限定するものと解釈されるべきではないことが理解されよう。例えば、バリアントCD80ポリペプチドの特定のドメイン(例えば、IgVドメイン)は、それぞれのSEQ ID NO:に記載のアミノ酸配列よりもいくつかのアミノ酸分長いかまたは短く、例えば1〜10アミノ酸、例えば、1、2、3、4、5、6、または7アミノ酸分長いかまたは短い場合がある。
いくつかの実施形態では、バリアントCD80ポリペプチドは、表1に列挙された細胞外ドメイン(ECD)配列のうちのいずれか(すなわち、SEQ ID NO:3〜75、2009〜2104、2297〜2507、2930〜2960のうちのいずれか1つ)を含む。いくつかの実施形態では、バリアントCD80ポリペプチドは、表1に列挙された細胞外ドメイン(ECD)配列のうちのいずれか(すなわち、SEQ ID NO:3〜75、2009〜2104、2297〜2507、2930〜2960のうちのいずれか1つ)に対して少なくとも90%の同一性、少なくとも91%の同一性、少なくとも92%の同一性、少なくとも93%の同一性、少なくとも94%の同一性、少なくとも95%の同一性、例えば少なくとも96%の同一性、97%の同一性、98%の同一性、または99%の同一性を示すポリペプチド配列を含み、野生型または非改変CD80には存在しないアミノ酸改変(例えば、置換)(複数可)を含有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、表1に列挙された細胞外ドメイン(ECD)配列のうちのいずれか(すなわち、SEQ ID NO:3〜75、2009〜2104、2297〜2507、2930〜2960のうちのいずれか1つ)の特異的結合断片を含み、野生型または非改変CD80には存在しないアミノ酸改変(例えば、置換)(複数可)を含有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、表1に列挙されたIgV配列のうちのいずれか(すなわち、SEQ ID NO:77〜149、151〜223、2105〜2296、2508〜2929、2961〜3022のうちのいずれか1つ)を含む。いくつかの実施形態では、バリアントCD80ポリペプチドは、表1に列挙されたIgV配列のうちのいずれか(すなわち、SEQ ID NO:77〜149、151〜223、2105〜2296、2508〜2929、2961〜3022のうちのいずれか1つ)に対して少なくとも90%の同一性、少なくとも91%の同一性、少なくとも92%の同一性、少なくとも93%の同一性、少なくとも94%の同一性、少なくとも95%の同一性、例えば少なくとも96%の同一性、97%の同一性、98%の同一性、または99%の同一性を示すポリペプチド配列を含み、野生型または非改変CD80には存在しないアミノ酸改変(例えば、置換)(複数可)を含有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、表1に列挙されたIgV配列のうちのいずれか(すなわち、SEQ ID NO:77〜149、151〜223、2105〜2296、2508〜2929、2961〜3022のうちのいずれか1つ)の特異的結合断片を含み、野生型または非改変CD80には存在しないアミノ酸改変(例えば、置換)(複数可)を含有する。
表1はまた、野生型CD80または例示的なバリアントCD80ポリペプチドの細胞外ドメイン(ECD)またはIgVドメインについてSEQ ID NO:を参照することにより例示的な配列を提供する。示されるように、所与のドメインに対応する正確な遺伝子座または残基は、ドメインの特定または分類に使用される方法などに応じて異なる場合がある。さらに、場合によっては、所与のドメイン(例えば、ECD)の隣接するN末端及び/またはC末端アミノ酸も、例えば発現されたときにドメインの適切なフォールディングを確実にするために、バリアントIgSFポリペプチドの配列に含めることができる。したがって、表1におけるSEQ ID NO:の例示は、限定するものと解釈されるべきではないことが理解されよう。例えば、バリアントCD80ポリペプチドの特定のドメイン(例えば、IgVドメイン)は、それぞれのSEQ ID NO:に記載のアミノ酸配列よりもいくつかのアミノ酸分長いかまたは短く、例えば1〜10アミノ酸、例えば、1、2、3、4、5、6、または7アミノ酸分長いかまたは短い場合がある。
いくつかの実施形態では、本明細書で提供されるバリアントCD80ポリペプチドの1つまたは複数のアミノ酸改変は、野生型または非改変CD80ポリペプチドと比較して、バリアントCD80ポリペプチドが、1つまたは複数の結合パートナー、CTLA−4、PD−L1、またはCD28に対して変化した(増加または減少した)結合活性または親和性を示すように、野生型または非改変CD80ポリペプチドに含有されるIgSFドメインと比べて少なくとも1つの親和性改変IgSFドメイン(例えば、IgVまたはIgCなど)またはその特異的結合断片を産生する。いくつかの実施形態では、バリアントCD80ポリペプチドは、例えば固相ELISAイムノアッセイ、フローサイトメトリーまたは表面プラズモン共鳴(Biacore)アッセイによって測定した場合に、野生型または非改変CD80ポリペプチド対照配列のものとは異なる、CTLA−4、PD−L1またはCD28に対する結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、CTLA−4、PD−L1及び/またはCD28に対して増加した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CD28、PD−L1、及び/またはCTLA−4に対して減少した結合親和性を有する。CD28、PD−L1及び/またはCTLA−4は、哺乳動物タンパク質、例えばヒトタンパク質またはネズミタンパク質であることができる。
結合パートナーのそれぞれの結合親和性は独立しており、つまり、いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CD28、PD−L1、及びCTLA−4のうちの1つ、2つ、または3つに対する増加した結合親和性を有し、及び/またはCD28、PD−L1、及びCTLA−4のうちの1つ、2つまたは3つに対する減少した結合親和性を有する。
いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4に対して増加した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、PD−L1に対して増加した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CD28に対して増加した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CD28に対して減少した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、PD−L1に対して減少した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4に対して減少した結合親和性を有する。
いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4及びPD−L1に対して増加した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4に対して増加した結合親和性を有し、PD−L1に対して減少した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4及びPD−L1に対して減少した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4に対して減少した結合親和性を有し、PD−L1に対して増加した結合親和性を有する。
いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4及びCD28に対して増加した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4に対して増加した結合親和性を有し、CD28に対して減少した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4及びCD28に対して減少した結合親和性を有する。これらの実施形態では、
いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、PD−L1及びCD28に対して増加した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、PD−L1に対して増加した結合親和性を有し、CD28に対して減少した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、PD−L1及びCD28に対して減少した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、PD−L1に対して減少した結合親和性を有し、CD28に対して増加した結合親和性を有する。
いくつかの実施形態では、バリアントCD80ポリペプチドは、ヒトCTLA−4のエクトドメインへの非改変または野生型CD80の結合親和性以下である、ヒトCTLA−4のエクトドメインに対する結合親和性を示す。
いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4、PD−L1及びCD28に対して増加した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4及びPD−L1に対して増加した結合親和性を有し、CD28に対して減少した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4及びCD28に対して増加した結合親和性を有し、PD−L1に対して減少した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4及びPD−L1に対して減少した結合親和性を有し、CD28に対して増加した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4に対して減少した結合親和性を有し、PD−L1及びCD28に対して増加した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4に対して増加した結合親和性を有し、PD−L1及びCD28に対して減少した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4、PD−L1及びCD28に対して減少した結合親和性を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4に対して減少した結合親和性を有し、PD−L1及びCD−28に対して増加した結合親和性を有する。
いくつかの実施形態では、CD28、PD−L1、及び/またはCTLA−4に対する結合親和性が増加した、またはより大きいバリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチド対照と比べて、CTLA−4、PD−L1、及び/またはCD28結合パートナー(複数可)に対して少なくとも約5%、例えば少なくとも約10%、約15%、約20%、約25%、約35%、または約50%の結合親和性の増加を有する。いくつかの実施形態では、野生型または非改変CD80ポリペプチドと比べた結合親和性の増加は、1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、100倍、150倍、200倍、250倍、300倍、350倍、400倍より多い。このような例では、野生型または非改変CD80ポリペプチドは、1つまたは複数のアミノ酸改変(例えば、置換)を含有しないこと以外は、バリアントCD80ポリペプチドと同じ配列を有する。
いくつかの実施形態では、CTLA−4、PD−L1、及び/またはCD28に対する結合親和性が減少した、または低下したバリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチド対照と比べて、CTLA−4、PD−L1、及び/またはCD28への少なくとも5%、例えば少なくとも約10%、約15%、約20%、約30%、約40%、約50%、約60%、約70%、約80%、約90%以上の結合親和性の減少を有する。いくつかの実施形態では、野生型または非改変CD80ポリペプチドと比べた結合親和性の減少は、1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、または50倍より多い。このような例では、野生型または非改変CD80ポリペプチドは、1つまたは複数のアミノ酸改変(例えば、置換)を含有しないこと以外は、バリアントCD80ポリペプチドと同じ配列を有する。
いくつかの実施形態では、CTLA−4、PD−L1、及び/またはCD28に対する前述の実施形態のいずれかの平衡解離定数(Kd)は、少なくとも1×10−5M、1×10−6M、1×10−7M、1×10−8M、1×10−9M、1×10−10Mまたは1×10−11M、または1×10−12Mであることができる。
いくつかの実施形態では、野生型または非改変CD80ポリペプチドに含有されるIgSFドメインと比べて少なくとも1つの親和性改変IgSFドメイン(例えば、IgVまたはIgCなど)またはその特異的結合断片を含有する提供されるバリアントCD80ポリペプチドは、1つまたは複数の結合パートナーに結合時に野生型または非改変CD80ポリペプチドと比較して、細胞内シグナルに応答してサイトカインを放出することができるT細胞などのシグナル伝達可能な細胞の表面に発現したCTLA−4またはCD28などの、1つまたは複数の機能的結合パートナーによって誘導される変化した(増加する/刺激するまたは減少する/阻害する)シグナル伝達を示す。いくつかの実施形態では、変化したシグナル伝達は、同じフォーマットにおいて、特定のバリアント及び/または野生型もしくは非改変CD80ポリペプチドとのインキュベーション後に、例えばサイトカイン放出(例えばIL−2放出)を測定するアッセイによって決定されるような、野生型または非改変CD80ポリペプチド対照配列によってもたらされるものとは異なる。例示的なアッセイが実施例8〜10に記載されている。例示的なアッセイでは、サイトカイン放出は、サイトカイン放出細胞の表面に発現する機能的結合パートナーのシグナル伝達活性の合計の関数である。本書の他の場所で説明されているように、いくつかの実施形態では、提供されるバリアントCD80ポリペプチドのフォーマットが、活性のタイプ(例えば作動または拮抗)に影響を与える可能性がある。
CTLA−4は阻害性シグナル伝達を誘導するため、CTLA−4シグナル伝達の増加により、いくつかの例示的なアッセイでサイトカイン放出の減少をもたらす。逆に、CTLA−4シグナル伝達の減少により阻害性シグナル伝達が減少するが、サイトカイン放出は減少せず、これにより、いくつかのアッセイではサイトカイン放出が増加する 場合がある。CD28シグナル伝達はサイトカイン放出を刺激するため、CD28シグナル伝達の増加により、例示的なアッセイでサイトカイン放出の増加をもたらす。逆に、CD28シグナル伝達の減少により、例示的なアッセイでサイトカイン放出の減少をもたらす。
いくつかの実施形態では、バリアントCD80ポリペプチドは、CTLA−4、PD−L1、及び/またはCD28媒介性シグナル伝達を増加させる。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CD28、PD−L1、及び/またはCTLA−4媒介性シグナル伝達を減少させる。
コグネイト結合パートナーのそれぞれの結合親和性は独立しており、したがって、いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CD28、PD−L1、及びCTLA−4のうちの1つ、2つ、または3つにより誘導されるシグナル伝達を増加させることができ、及び/またはCD28、PD−L1、及びCTLA−4のうちの1つ、2つまたは3つにより誘導されるシグナル伝達を減少させることができる。
いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4により誘導されるシグナル伝達を増加させる。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、PD−L1/PD−1により誘導されるシグナル伝達を増加させる。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、結合時にCD28により誘導されるシグナル伝達を増加させる。いくつかの好ましい実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、結合時にCD28により誘導されるシグナル伝達を減少させる。いくつかの実施形態では、バリアントCD80は、野生型または非改変CD80ポリペプチドと比べて、PD−L1/PD−1により誘導されるシグナル伝達を減少させる。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4により誘導されるシグナル伝達を減少させる。
いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4及びCD28により誘導されるシグナル伝達を増加させる。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4により誘導されるシグナル伝達を増加させ、CD28により誘導されるシグナル伝達を減少させる。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4及びCD28により誘導されるシグナル伝達を減少させる。
いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4及びCD28により誘導されるシグナル伝達を増加させる。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4により誘導されるシグナル伝達を増加させ、CD28により誘導されるシグナル伝達を減少させる。いくつかの実施形態では、バリアントCD80ポリペプチドは、CTLA−4及びCD28により誘導されるシグナル伝達を増加させる。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4により誘導されるシグナル伝達を減少させ、CD28により誘導されるシグナル伝達を増加させる。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4により誘導されるシグナル伝達を減少させ、CD28により誘導されるシグナル伝達を増加させる。いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比べて、CTLA−4及びCD28により誘導されるシグナル伝達を減少させる。
いくつかの実施形態では、CTLA−4により誘導される阻害性シグナル伝達を刺激または増加させるバリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドにより誘導されるシグナルよりも90%、85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%、15%、10%、5%、またはそれ以下であるシグナルを生成する。このような例では、野生型または非改変CD80ポリペプチドは、1つまたは複数のアミノ酸改変(例えば、置換)を含有しないこと以外は、バリアントCD80ポリペプチドと同じ配列を有する。
いくつかの実施形態では、CD28により誘導されるシグナル伝達を刺激または増加させるバリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドにより誘導されるシグナルの少なくとも105%、110%、120%、150%、200%、300%、400%または500%、またはそれ以上であるシグナルを生成する。このような例では、野生型または非改変CD80ポリペプチドは、1つまたは複数のアミノ酸改変(例えば、置換)を含有しないこと以外は、バリアントCD80ポリペプチドと同じ配列を有する。
いくつかの実施形態では、CTLA−4により誘導される阻害性シグナル伝達を阻害または減少させるバリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドにより誘導されるシグナルの少なくとも105%、110%、120%、150%、200%、300%、400%または500%、またはそれ以上であるシグナルを生成する。このような例では、野生型または非改変CD80ポリペプチドは、1つまたは複数のアミノ酸改変(例えば、置換)を含有しないこと以外は、バリアントCD80ポリペプチドと同じ配列を有する。
いくつかの実施形態では、CD28により誘導される阻害性シグナル伝達を阻害または減少させるバリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドにより誘導されるシグナルの、90%、85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%、15%、10%、5%、またはそれ以下であるシグナルを生成する。このような例では、野生型または非改変CD80ポリペプチドは、1つまたは複数のアミノ酸改変(例えば、置換)を含有しないこと以外は、バリアントCD80ポリペプチドと同じ配列を有する。
いくつかの実施形態では、CTLA−4により誘導される阻害性シグナル伝達に影響を与える、及び/またはCD28によるシグナル伝達に影響を与えるバリアントCD80ポリペプチドは、対応する野生型または非改変CD80ポリペプチドによりもたらされるCTLA−4及びCD28シグナル伝達の合計より少ない、CTLA−4及びCD28シグナル伝達の合計をもたらす。かかる実施形態では、CTLA−4及びCD28シグナル伝達の合計は、対応する野生型または非改変CD80ポリペプチドによりもたらされるシグナルの、90%、85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%、15%、10%、5%以下である。このような例では、対応する野生型または非改変CD80ポリペプチドは、1つまたは複数のアミノ酸改変(例えば、置換)を含有しないこと以外は、バリアントCD80ポリペプチドと同じ配列を有する。
いくつかの実施形態では、CTLA−4により誘導される阻害性シグナル伝達に影響を与える、及び/またはCD28によるシグナル伝達に影響を与えるバリアントCD80ポリペプチドは、対応する野生型または非改変CD80ポリペプチドにより影響を受けたCTLA−4及びCD28シグナル伝達の合計より大きいCTLA−4及びCD28シグナル伝達の合計をもたらす。かかる実施形態では、CTLA−4及びCD28シグナル伝達の合計は、対応する野生型または非改変CD80ポリペプチドにより影響を受けたシグナルの少なくとも105%、110%、120%、150%、200%、300%、400%または500%、またはそれ以上である。このような例では、対応する野生型または非改変CD80ポリペプチドは、1つまたは複数のアミノ酸改変(例えば、置換)を含有しないこと以外は、バリアントCD80ポリペプチドと同じ配列を有する。
1.CTLA4
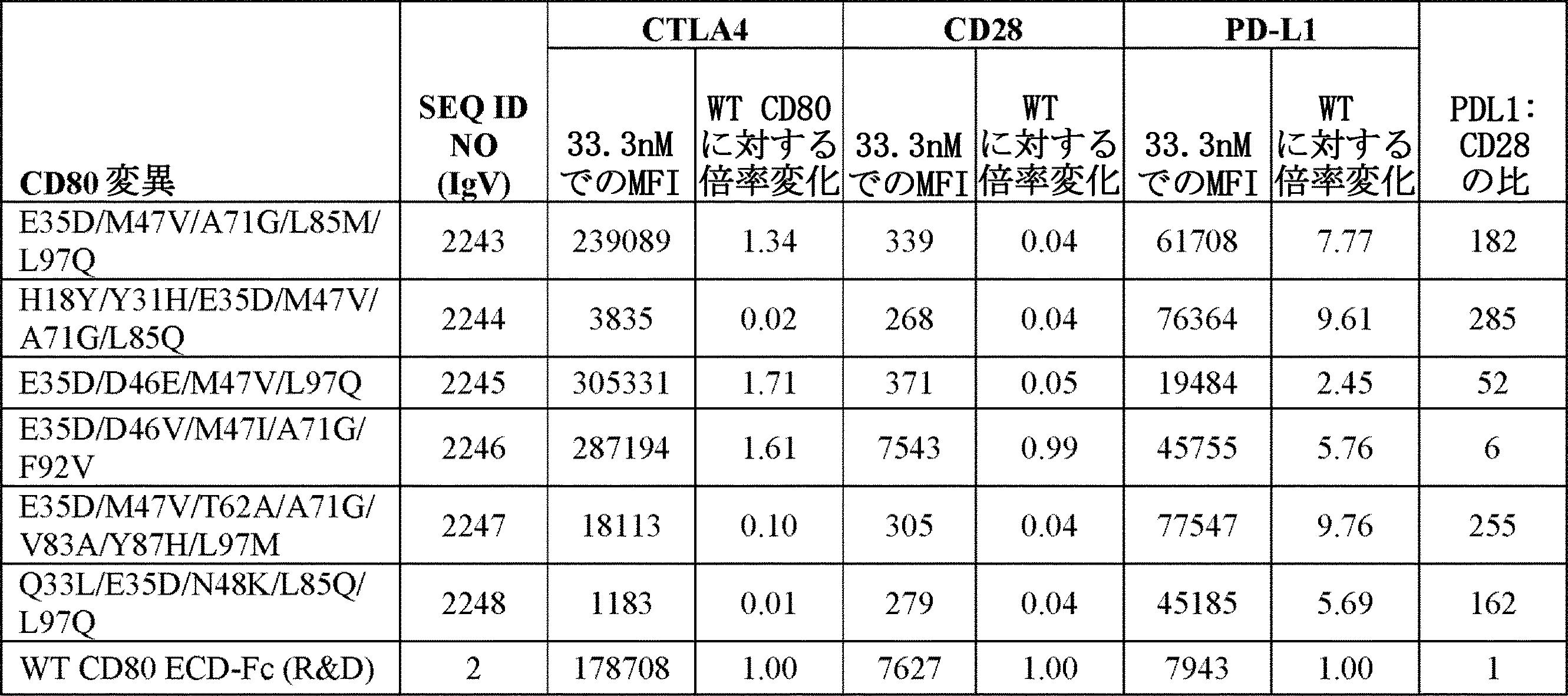
いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:2、76、150、3030、または3031に記載の配列を含む、野生型または非改変CD80ポリペプチドなどの野生型または非改変CD80ポリペプチドと比較してCTLA−4のエクトドメインに対して増加した親和性を示す。いくつかの実施形態では、バリアントCD80ポリペプチドは、例えば、SEQ ID NO:2、76、150、3030、または3031に記載の配列を含む、野生型または非改変CD80ポリペプチドと比較して、CTLA−4のエクトドメインに対して増加した親和性、及びCD28のエクトドメインに対して減少した親和性を示す。いくつかの実施形態では、CTLA−4のエクトドメインに対する増加した親和性は、CTLA−4のエクトドメインへの非改変CD80の結合親和性と比較して1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、または60倍より大きく増加する。
これらの実施形態のいくつかでは、野生型または非改変CD80ポリペプチドと比較してCTLA−4に対して増加した結合親和性を示すバリアントCD80ポリペプチドは、SEQ ID NO:2、76、150、3030、または3031の7、12、13、16、18、20、22、23、24、26、27、30、33、35、37、38、41、42、43、44、46、47、48、52、53、54、57、58、61、62、63、67、68、69、70、71、72、73、74、77、79、81、83、84、85、87、88、89、90、91、92、93、94、95、及び/または97位に対応する、1つまたは複数のアミノ酸改変(例えば、置換)を有する。これらの実施形態のいくつかでは、野生型または非改変CD80ポリペプチドと比較してCTLA−4に対して増加した結合親和性を示すバリアントCD80ポリペプチドは、SEQ ID NO:2、76、150、3030、または3031の7、23、26、30、35、46、57、58、71、73、79及び/または84位に対応する、1つまたは複数のアミノ酸改変(例えば、置換)を有する。
いくつかの実施形態では、バリアントCD80ポリペプチドは、
からなる群から選択される1つまたは複数のアミノ酸置換を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、
からなる群から選択される1つまたは複数のアミノ酸置換を有する。
いくつかの実施形態では、1つまたは複数のアミノ酸置換は、
である。
いくつかの実施形態では、バリアントCD80ポリペプチドは、1より大きいCTLA−4結合とCD28結合の比(CTLA4:CD28結合比)によって示されるように、非改変CD80ポリペプチド(例えば、SEQ ID NO:2、76、150、3030、または3031に記載される)へのCTLA−4の結合対CD28への結合の結合比と比較して、CTLA−4対CD28の増加した選択性を示す。いくつかの実施形態では、バリアントCD80ポリペプチドは、1.1、1.2、1.3、1.4、1.5、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、55、60、65、70、もしくはそれ以上より大きい、または約1.1、約1.2、約1.3、約1.4、約1.5、約2、約3、約4、約5、約6、約7、約8、約9、約10、約11、約12、約13、約14、約15、約16、約17、約18、約19、約20、約21、約22、約23、約24、約25、約26、約27、約28、約29、約30、約35、約40、約45、約50、約55、約60、約65、約70、もしくはそれ以上より大きい、または1.1、1.2、1.3、1.4、1.5、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、55、60、65、70、もしくはそれ以上のCTLA−4対CD28の結合比を示す。これらの実施形態のいくつかでは、バリアントCD80ポリペプチドは、SEQ ID NO:2、76、150、3030、または3031の30、35、57、71、または84位に対応する、1つまたは複数のアミノ酸改変(例えば、置換)を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、T13A、T13R、S15T、V22I、V22L、Q27H、I30V、Q33R、E35D、E35G、T41S、M47I、M47L、M47V、N48Y、Y53F、T57I、I61F、I61V、I67L、L70M、A71D、A71G、L72V、T79M、E81G、E81K、V84A、V84I、及びL85M、Y87C、Y87Dからなる群から選択される1つまたは複数のアミノ酸置換を有する。いくつかの実施形態では、1つまたは複数のアミノ酸置換は、


である。
2.CD28
いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比較して、CD28のエクトドメインに対して増加した親和性を示す。いくつかの実施形態では、バリアントCD80ポリペプチドは、例えば、SEQ ID NO:2、76、150、3030、または3031に記載の配列を含む、野生型または非改変CD80ポリペプチドと比較して、CD28のエクトドメインに対して増加した親和性を示す。いくつかの実施形態では、CD28のエクトドメインに対する増加した親和性は、CD28のエクトドメインへの非改変CD80の結合親和性と比較して1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、150倍、または200倍より大きく増加する。
いくつかの実施形態では、バリアントCD80ポリペプチドは、例えば、SEQ ID NO:2、76、150、3030、または3031に記載の配列を含む、野生型または非改変CD80ポリペプチドと比較して、CD28のエクトドメイン及びCTLA−4のエクトドメインに対して増加した親和性を示す。いくつかの実施形態では、バリアントCD80ポリペプチドは、例えば、SEQ ID NO:2、76、150、3030、または3031に記載の配列を含む、野生型または非改変CD80ポリペプチドと比較して、CD28のエクトドメイン、PD−L1のエクトドメイン、及びCTLA−4のエクトドメインに対して増加した親和性を示す。いくつかの実施形態では、CD28ならびにCTLA−4及びPD−L1の一方または両方のエクトドメインに対する増加した親和性は、CTLA−4またはPD−L1のエクトドメインへの非改変CD80の結合親和性と比較して1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、150倍、200倍、250倍、300倍、350倍、400倍、または450倍より大きく別々に増加する。
いくつかの実施形態では、バリアントCD80ポリペプチドは、例えば、SEQ ID NO:2、76、150、3030、または3031に記載の配列を含む、野生型または非改変CD80ポリペプチドと比較して、CD28のエクトドメインに対して増加した親和性、及びCTLA−4のエクトドメインに対して減少した親和性を示す。いくつかの実施形態では、バリアントCD80ポリペプチドは、例えば、SEQ ID NO:2、76、150、3030、または3031に記載の配列を含む、野生型または非改変CD80ポリペプチドと比較して、CD28のエクトドメイン及びPD−L1のエクトドメインに対して増加した親和性、ならびにCTLA−4のエクトドメインに対して減少した親和性を示す。いくつかの実施形態では、CTLA−4のエクトドメインに対する減少した親和性は、CTLA−4のエクトドメインへの非改変CD80の結合親和性と比較して1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、または60倍より大きく減少する。
これらの実施形態のいくつかでは、野生型または非改変CD80ポリペプチドと比較して、CD28に対して増加した結合親和性を示すバリアントCD80ポリペプチドは、SEQ ID NO:2、76、150、3030、または3031の12、13、18、20、22、23、24、26、27、31、35、41、42、43、46、47、54、55、57、58、61、62、67、68、69、70、71、72、79、83、84、85、88、90、93、94、及び/または95位に対応する、1つまたは複数のアミノ酸改変(例えば、置換)を有する。これらの実施形態のいくつかでは、野生型または非改変CD80ポリペプチドと比較してCD28に対して増加した結合親和性を示すバリアントCD80ポリペプチドは、SEQ ID NO:2、76、150、3030、または3031の23、26、35、46、55、57、58、71、79及び/または84位に対応する、1つまたは複数のアミノ酸改変(例えば、置換)を有する。
いくつかの実施形態では、バリアントCD80ポリペプチドは、A12T、T13R、S15T、H18A、H18C、H18F、H18I、H18T、H18V、H18Y、V20I、S21P、V22A、V22D、V22L、E23D、E23G、E24D、A26D、A26E、A26G、A26H、A26K、A26N、A26P、A26Q、A26R、A26S、A26T、Q27H、Q27L、Q27R、Y31H、Q33R、E35D、E35G、K37E、M38I、T41S、M42V、M43I、M43L、D46E、D46N、D46V、M47I、M47L、M47V、M47Y、N48K、N48Y、Y53F、K54E、N55I、T57A、T57I、I58V、I61F、I61V、T62A、T62N、T62S、N64S、I67L、V68E、V68I、V68L、V68M、I69F、L70M、L70Q、L70R、A71D、A71G、L72P、L72V、T79I、T79M、V83I、V84I、L85M、L85Q、Y87C、Y87D、Y87N、E88D、E88V、D90G、D90N、D90P、A91G、A91S、K93E、K93R、R94L、R94Q、R94W、E95K、E95V、及びL97Qからなる群から選択される1つまたは複数のアミノ酸置換を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、T13R、S15T、H18A、H18C、H18F、H18I、H18T、H18V,V20I、V22D、V22L、E23D、E23G、E24D、A26D,A26E、A26G、A26H、A26K、A26N、A26P、A26Q、A26R、A26S、A26T、Q27H、Q27L、Q33R、E35D、E35G、T41S、M42V、M43L、D46E、D46N、D46V、M47I、M47L、M47V、M47Y、N48K、N48Y、Y53F、K54E、N55I、T57A、T57I、I58V、I61F、I61V、T62A、T62N、I67L、V68E、V68I、V68L、I69F、L70M、A71D、A71G、L72V、T79I、T79M、V84I、L85M、L85Q、Y87C、Y87D、E88V、D90P、R94Q、R94W、E95V、L97Qからなる群から選択される1つまたは複数のアミノ酸置換を有する。
いくつかの実施形態では、1つまたは複数のアミノ酸置換は、
である。
3.PD−L1
いくつかの実施形態では、バリアントCD80ポリペプチドは、野生型または非改変CD80ポリペプチドと比較して、PD−L1に対して増加した親和性を示す。いくつかの実施形態では、バリアントCD80ポリペプチドは、例えば、SEQ ID NO:2、76、150、3030、または3031に記載の配列を含む、野生型または非改変CD80ポリペプチドと比較して、PD−L1のエクトドメイン及びCTLA−4のエクトドメインに対して増加した親和性を示す。いくつかの実施形態では、PD−L1のエクトドメインに対する増加した親和性は、PD−L1のエクトドメインへの非改変CD80の結合親和性と比較して、1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、150倍、200倍、250倍、300倍、350倍、400倍、または450倍より大きく増加する。
いくつかの実施形態では、バリアントCD80ポリペプチドは、例えば、SEQ ID NO:2、76、150、3030、または3031に記載の配列を含む、野生型または非改変CD80ポリペプチドと比較して、PD−L1のエクトドメインに対して増加した親和性、及びCTLA−4のエクトドメインに対して減少した親和性を示す。いくつかの実施形態では、バリアントCD80ポリペプチドは、例えば、SEQ ID NO:2、76、150、3030、または3031に記載の配列を含む、野生型または非改変CD80ポリペプチドと比較して、PD−L1のエクトドメインに対して増加した親和性、及びCD28のエクトドメインに対して減少した親和性を示す。いくつかの実施形態では、CTLA−4またはCD28のエクトドメインに対する減少した親和性は、CTLA−4またはCD28のエクトドメインへの非改変CD80の結合親和性と比較して1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、または60倍より大きく減少する。
これらの実施形態のいくつかでは、野生型または非改変CD80ポリペプチドと比較してPD−L1に対して増加した結合親和性を示すバリアントCD80ポリペプチドは、SEQ ID NO:2、76、150、3030、または3031の7、12、13、15、16、18、20、22、23、24、25、26、27、28、29、30、31、33、34、35、36、37、38、41、42、43、44、46、47、48、51、53、54、55、57、58、61、62、63、65、67、68、69、70、71、72、73、74、76、77、78、79、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、及び/または97位に対応する、1つまたは複数のアミノ酸改変(例えば、置換)を有する。これらの実施形態のいくつかでは、野生型または非改変CD80ポリペプチドと比較してPD−L1に対して増加した結合親和性を示すバリアントCD80ポリペプチドは、SEQ ID NO:2、76、150、3030、または3031の7、23、26、30、34、35、46、51、55、57、58、65、71、73、78、79、82及び/または84位に対応する、1つまたは複数のアミノ酸改変(例えば、置換)を有する。
いくつかの実施形態では、バリアントCD80ポリペプチドは、
からなる群から選択される1つまたは複数のアミノ酸置換を有する。いくつかの実施形態では、バリアントCD80ポリペプチドは、
からなる群から選択される1つまたは複数のアミノ酸置換を有する。
いくつかの実施形態では、1つまたは複数のアミノ酸置換は、
である。
いくつかの実施形態では、野生型または非改変CD80ポリペプチドと比較して、PD−L1のエクトドメインに対して増加した親和性を示す本明細書において提供されるバリアントCD80ポリペプチドは、PD−L1依存性CD28共刺激を示すことができるか、またはPD−L1依存性CD28共刺激活性をもたらすことができる。いくつかの実施形態では、バリアントCD80ポリペプチドは、PD−L1依存性CD28共刺激活性を媒介するか、またはこれをもたらし、バリアントCD80ポリペプチドの親和性は、PD−L1のエクトドメインへの非改変CD80の結合親和性と比較して、少なくとも1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、150倍、200倍、250倍、300倍、350倍、400倍、または450倍増加する。
いくつかの実施形態では、PD−L1依存性CD28共刺激活性を示し、媒介し、またはそれをもたらす本明細書で提供されるバリアントCD80ポリペプチドは、野生型または非改変CD80と比較して、CD28のエクトドメインに対する結合を保持する。例えば、バリアントCD80ポリペプチドは、CD28のエクトドメインに対する非改変CD80ポリペプチドの結合親和性と比較して、CD28のエクトドメインに対する親和性の、少なくとも2%、3%、4%、5%、6%、7%、8%、9%、10%、12%、15%、20%、25%、30%、35%、40%、50%、55%、60%、65%、70%、75%、80%、85%、90%もしくは95%、または少なくとも約2%、約3%、約4%、約5%、約6%、約7%、約8%、約9%、約10%、約12%、約15%、約20%、約25%、約30%、約35%、約40%、約50%、約55%、約60%、約65%、約70%、約75%、約80%、約85%、約90%もしくは約95%を保持することができる。
いくつかの実施形態では、PD−L1依存性CD28共刺激活性を示し、媒介し、またはそれをもたらす本明細書で提供されるバリアントCD80ポリペプチドは、CD28のエクトドメインへの非改変CD80の結合親和性と比較してCD28のエクトドメインに対する増加した親和性を示す。例えば、バリアントCD80ポリペプチドは、CD28のエクトドメインへの非改変CD80の結合親和性と比較して、1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、150倍、または200倍より大きく増加するCD28のエクトドメインに対する増加した親和性を示すことができる。
III.バリアントポリペプチドのフォーマット
vIgDが含まれる本明細書で提供されるバリアントCD80を含む免疫調節ポリペプチドは、可溶性タンパク質、膜結合タンパク質または分泌タンパク質などを含む多種多様な方法でフォーマットをとることができる。いくつかの実施形態では、特定のフォーマットは、所望の治療用途に合わせて選択できる。場合によっては、バリアントCD80ポリペプチドを含む免疫調節ポリペプチドは、その結合パートナー、例えばCTLA−4、CD28、及び/またはPD−L1の活性に拮抗するかまたはそれを遮断するフォーマットで提供される。いくつかの実施形態では、CTLA−4またはPD−L1/PD−1の拮抗作用は、腫瘍学における免疫の促進において有用であり得る。場合によっては、バリアントCD80ポリペプチドを含む免疫調節ポリペプチドは、その結合パートナー、例えばCTLA−4及び/またはCD28の活性を作動させるまたは刺激するフォーマットで提供される。いくつかの実施形態では、CD28の作動作用は、腫瘍学における免疫の促進において有用であり得る。いくつかの実施形態では、CD28の作動作用は、PD−L1のCD80結合に依存し得るか、またはそれにより増強され得る。このようなCD28のPD−L1依存性作動作用は、腫瘍学における免疫の促進において有用であり得る。いくつかの実施形態では、CTLA−4の作動作用は、炎症または自己免疫の治療において有用であり得る。当業者は、例えば1つまたは複数の特異的コグネイト結合パートナーに拮抗するかまたはそれを作動させるための特定のフォーマットの活性を容易に決定することができる。そのような活性を評価するための例示的な方法は、実施例を含む、本明細書において提供される。
いくつかの態様では、可溶性であるCD80のvIgDを含む免疫調節タンパク質(例えばFc鎖に融合する)が提供される。いくつかの態様では、1つまたは複数の追加のIgSFドメイン(例えば、1つまたは複数の追加のvIgD)は、本明細書において提供されるとおりのCD80のvIgDに連結され得る(以下「スタック」または「スタックされた」免疫調節タンパク質と呼ばれる)。いくつかの実施形態では、提供される免疫調節タンパク質のモジュールフォーマットは、複数のカウンター構造体(複数のコグネイト結合パートナー)の活性を調節するための、免疫調節タンパク質を操作または生成するための柔軟性を提供する。いくつかの実施形態では、そのような「スタック」分子を、可溶性フォーマットで提供することができ、場合によっては、膜結合または分泌型タンパク質として提供してもよい。いくつかの実施形態では、バリアントCD80免疫調節タンパク質は、例えば対象に投与されたときに、例えばvIgDを特定の環境または細胞にターゲティングまたは局在化するために、リガンド(例えば、抗原)に特異的に結合するターゲティング物質または部分(例えば、抗体または他の結合分子)に直接的または間接的に連結されたCD80のvIgDを含有するコンジュゲートとして提供される。いくつかの実施形態では、ターゲティング物質、例えば、抗体または他の結合分子は、腫瘍抗原に結合し、それによりvIgDを含有するバリアントCD80を腫瘍微小環境に局在化させ、例えば、腫瘍微小環境に特異的な腫瘍浸潤リンパ球(TIL)の活性を調節する。
いくつかの実施形態では、提供される免疫調節タンパク質は、細胞において発現され、操作された細胞療法(ECT)の一部として提供される。いくつかの実施形態では、バリアントCD80ポリペプチドは、細胞、例えば免疫細胞(例えば、T細胞または抗原提示細胞)において、膜結合形態で発現し、それにより膜貫通型免疫調節タンパク質(以下「TIP」とも呼ばれる)を提供する。いくつかの実施形態では、TIPによって認識されるコグネイト結合パートナーに応じて、TIPを発現する操作された細胞は、他の操作された細胞及び/または内在性T細胞に陽性または陰性のいずれかの共刺激シグナルを提供することによって、コグネイト結合パートナーを作動させることができる。いくつかの態様では、バリアントCD80ポリペプチドは、細胞、例えば免疫細胞(例えば、T細胞または抗原提示細胞)において分泌可能形態で発現し、それにより例えば細胞が対象に投与されたときに、分泌または可溶性形態のバリアントCD80ポリペプチド(以下「SIP」とも呼ばれる)を産生する。いくつかの態様では、SIPは、それが分泌される環境(例えば、腫瘍微小環境)において、コグネイト結合パートナーに拮抗することができる。いくつかの実施形態では、バリアントCD80ポリペプチドは、細胞中でのバリアントポリペプチドのTIPまたはSIPとしての送達または発現のために、対象への投与によって、細胞、例えば免疫細胞(例えば、T細胞または抗原提示細胞)にin vivoで感染することができる感染性物質(例えば、ウイルス性または細菌性物質)中で発現される。
いくつかの実施形態では、可溶性免疫調節ポリペプチド、例えばvIgDを含有するバリアントCD80は、提供されるコンジュゲートのいずれか1つまたは任意の組み合わせ(例えば、ターゲティング部分)にそれ自体コンジュゲートされることができるリポソーム内にカプセル化されることができる。いくつかの実施形態では、本発明の可溶性または膜結合型免疫調節ポリペプチドは、脱グリコシル化される。より具体的な実施形態では、バリアントCD80配列は脱グリコシル化される。さらにより具体的な実施形態では、バリアントCD80のIgV及び/またはIgC(例えば、IgC2)ドメイン(複数可)は脱グリコシル化される。
提供されるフォーマットの非限定的な例を図1A〜1Cに記載し、以下にさらに記載する。
A.可溶性タンパク質
いくつかの実施形態では、バリアントCD80ポリペプチドを含有する免疫調節タンパク質は、可溶性タンパク質である。当業者であれば、細胞表面タンパク質が、典型的には、細胞内ドメイン、膜貫通ドメイン、及び細胞外ドメイン(ECD)を有すること、ならびに、細胞外ドメインまたはその免疫学的に活性な配列を使用してそのようなタンパク質の可溶性形態を作製することができることを認識するだろう。したがって、いくつかの実施形態では、バリアントCD80ポリペプチドを含有する免疫調節タンパク質は、膜貫通ドメインまたは膜貫通ドメインの一部分を欠く。いくつかの実施形態では、バリアントCD80を含有する免疫調節タンパク質は、細胞内(細胞質)ドメインを欠いているか、または細胞内ドメインの一部分を欠く。いくつかの実施形態では、バリアントCD80ポリペプチドを含有する免疫調節タンパク質は、アミノ酸改変(複数可)を含有するIgVドメイン及び/またはIgC(例えば、IgC2)ドメイン(複数可)またはその特異的結合断片を含有するECDドメインまたはその一部分を含有するvIgD部分のみを含有する。
いくつかの実施形態では、バリアントCD80を含む免疫調節ポリペプチドは、本発明の1つまたは複数のバリアントCD80ポリペプチドを含むことができる。いくつかの実施形態では、本発明のポリペプチドは、正確に1、2、3、4、5つのバリアントCD80配列を含む。いくつかの実施形態では、バリアントCD80配列のうちの少なくとも2つは、同一のバリアントCD80配列である。
いくつかの実施形態では、提供される免疫調節ポリペプチドは、CD80の2つ以上のvIgD配列を含む。ポリペプチド鎖内の複数のバリアントCD80ポリペプチドは、互いに同一(すなわち、同種)または非同一(すなわち、異種)のバリアントCD80配列であることができる。単一のポリペプチド鎖の実施形態に加えて、いくつかの実施形態では、本発明のポリペプチドの2つ、3つ、4つ、またはより多くが、互いに共有結合または非共有結合していてもよい。したがって、単量体、二量体、及びより高次の(例えば、3、4、5、またはより高次の)多量体タンパク質が本明細書において提供される。例えば、いくつかの実施形態では、正確に2つの本発明のポリペプチドが、互いに共有結合または非共有結合して二量体を形成することができる。いくつかの実施形態では、結合は、鎖間システインジスルフィド結合を介してなされる。本発明の2つ以上のポリペプチドを含む組成物は、同一種もしくは実質的に同一種のポリペプチド(例えば、ホモ二量体)または非同一種のポリペプチド(例えば、ヘテロ二量体)のものであることができる。本発明の複数の連結されたポリペプチドを有する組成物は、上に述べたとおり、各ポリペプチド鎖に1つまたは複数の同一または非同一の本発明のバリアントCD80ポリペプチドを有することができる。
いくつかの実施形態では、免疫調節タンパク質は、単量体形態である及び/またはその結合パートナーへの1価の結合を示すバリアントCD80ポリペプチドであるか、またはそれを含む。いくつかの態様では、可溶性である及び/または膜貫通ドメイン及び細胞内シグナル伝達ドメインを欠くバリアントCD80などの、記載されるバリアントCD80ポリペプチドは、さらなる部分に直接的または間接的に連結される。いくつかの実施形態では、さらなる部分は、タンパク質、ペプチド、小分子または核酸である。いくつかの実施形態では、1価の免疫調節タンパク質は、融合タンパク質である。いくつかの実施形態では、部分は、半減期延長部分である。このような半減期延長部分の例には、限定されないが、アルブミン、アルブミン結合ポリペプチド、Pro/Ala/Ser(PAS)、ヒト絨毛性ゴナドトロピンのベータサブユニットのC末端ペプチド(CTP)、ポリエチレングリコール(PEG)、アミノ酸の長い非構造化親水性配列(XTEN)、ヒドロキシエチルデンプン(HES)、アルブミン結合小分子、またはこれらの組み合わせが含まれる。
いくつかの実施形態では、バリアントCD80を含む免疫調節ポリペプチドは、アミノ酸Pro、Ala、及びSerから構成される立体構造的に乱れたポリペプチド配列を含む部分に連結することができる(例えば、WO2008/155134、SEQ ID NO:904を参照)。場合によっては、アミノ酸リピートは少なくとも3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30以上のアミノ酸残基であり、各リピートは、Ala、Ser、及びPro残基(複数可)を含む。したがって、PAS化タンパク質である免疫調節タンパク質が本明細書で提供され、該バリアントCD80ポリペプチドは、直接的またはリンカーを介して間接的にPro/Ala/Ser(PAS)に連結する。いくつかの実施形態では、1つまたは複数の追加のリンカー構造が使用され得る。
いくつかの実施形態では、該部分は、バリアントCD80ポリペプチドの検出または精製を促す。場合によっては、免疫調節ポリペプチドは、CD80ポリペプチドのN末端及び/またはC末端に直接または間接的に連結されたタグまたは融合ドメイン、例えば親和性または精製タグを含む。様々な好適なポリペプチドタグ及び/または融合ドメインが知られており、これらに限定されないが、ポリヒスチジン(His)タグ、FLAGタグ(SEQ ID NO:3037)、Mycタグ、及び蛍光タンパク質タグ(例えば、SEQ ID NO:3033〜3035に記載のEGFP)が挙げられる。場合によっては、バリアントCD80を含む免疫調節ポリペプチドは、少なくとも6つのヒスチジン残基を含む(SEQ ID NO:3038に記載)。場合によっては、バリアントCD80を含む免疫調節ポリペプチドは、部分の様々な組み合わせをさらに含む。例えば、バリアントCD80を含む免疫調節ポリペプチドは、1つまたは複数のポリヒスチジンタグ及びFLAGタグをさらに含む。
いくつかの実施形態では、CD80ポリペプチドは、SEQ ID NO:374に記載されるような1価形態のままである改変免疫グロブリン重鎖定常領域(Fc)に連結される。
いくつかの実施形態では、免疫調節タンパク質は、直接的またはリンカーを介して間接的に多量体化ドメインに連結されるバリアントCD80ポリペプチドを含有する。いくつかの態様では、多量体化ドメインは、分子の半減期を延長する。2つ以上のバリアントCD80ポリペプチドの相互作用は、直接的または間接的に、それらのそれ自体が相互作用して安定な構造を形成できる任意の部分または他のポリペプチドに対する連結により促され得る。例えば、別々のコードされたバリアントCD80ポリペプチド鎖は、多量体化により結合され得、そのポリペプチドの多量体化は、多量体化ドメインによって媒介される。典型的には、多量体化ドメインは、第1のバリアントCD80ポリペプチドと第2のバリアントCD80ポリペプチドとの間の安定したタンパク質−タンパク質相互作用の形成を提供する。
ホモまたはヘテロ多量体ポリペプチドは、別々のバリアントCD80ポリペプチドの共発現から生成することができる。第1及び第2のバリアントCD80ポリペプチドは、同一であっても異なっていてもよい。特定の実施形態では、第1及び第2のバリアントCD80ポリペプチドは、ホモ二量体では同じであり、それぞれが同じ多量体化ドメインに連結されている。他の実施形態では、ヘテロ二量体を、異なる第1及び第2のバリアントCD80ポリペプチドを連結することにより形成することができる。このような実施形態のいくつかでは、第1及び第2のバリアントCD80ポリペプチドは、ヘテロ二量体形成を促進することができる異なる多量体化ドメインに連結される。
いくつかの実施形態では、多量体化ドメインには、安定したタンパク質−タンパク質相互作用を形成可能な任意のものが含まれる。多量体化ドメインは、免疫グロブリン配列(例えば、Fcドメイン;例えば、国際特許公開WO93/10151及びWO2005/063816 US;米国特許番号第2006/0024298号;米国特許番号第5,457,035号を参照);ロイシンジッパー(例えば、核転写タンパク質fos及びjunもしくはがん原遺伝子c−myc由来または窒素の一般制御(GCN4)由来)(例えば、Busch and Sassone−Corsi(1990)Trends Genetics,6:36−40;Gentz et al.,(1989)Science,243:1695−1699を参照);疎水性領域;親水性領域;またはホモもしくはヘテロ多量体のキメラ分子間に分子間ジスルフィド結合を形成する遊離チオール、を介して相互作用することができる。加えて、多量体化ドメインは、例えば、米国特許第5,731,168号;国際特許公開WO98/50431及びWO2005/063816;Ridgway et al.(1996)Protein Engineering,9:617−621に記載されているような、穴を含むアミノ酸配列に相補的な突起を含むアミノ酸配列を含むことができる。そのような多量体化領域は、立体相互作用が安定した相互作用を促進するだけでなく、キメラ単量体の混合物からのホモ二量体よりもヘテロ二量体の形成をさらに促進するように操作することができる。一般的に、突起は、第1のポリペプチドの界面の小さなアミノ酸側鎖をより大きな側鎖(例えば、チロシンまたはトリプトファン)で置き換えることにより構築される。突起と同一または類似のサイズの代償性の空洞は、より大きなアミノ酸側鎖をより小さいもの(例えば、アラニンまたはスレオニン)で置き換えることにより、第2のポリペプチドの界面に任意で作製される。例示的な多量体化ドメインについて以下に説明する。
バリアントCD80ポリペプチドは、任意の場所で結合できるが、典型的にはそのN末端またはC末端を介して多量体化ドメインのN末端またはC末端に結合してキメラポリペプチドを形成できる。連結は、直接的またはリンカーを介して間接的であり得る。キメラポリペプチドは、融合タンパク質であり得るか、または共有または非共有相互作用などによる化学的連結により形成され得る。例えば、多量体化ドメインを含有するキメラポリペプチドを調製する場合、バリアントCD80ポリペプチドの全てまたは一部をコードする核酸は、直接的または間接的または任意でリンカードメインを介して、多量体化ドメイン配列をコードする核酸に作動可能に連結できる。場合によっては、構築物は、バリアントCD80ポリペプチドのC末端が多量体化ドメインのN末端に結合しているキメラタンパク質をコードする。場合によっては、構築物は、バリアントCD80ポリペプチドのN末端が多量体化ドメインのC末端に結合しているキメラタンパク質をコードすることができる。
ポリペプチド多量体は、同一または異なるバリアントCD80ポリペプチドの2つを、直接的または間接的に多量体化ドメインに直接または間接的に連結することにより作製された複数の(例えば2つの)キメラタンパク質を含有する。いくつかの実施例では、多量体化ドメインがポリペプチドである場合、バリアントCD80ポリペプチド及び多量体化ドメインをコードする遺伝子融合体が適切な発現ベクターに挿入される。得られたキメラまたは融合タンパク質は、組換え発現ベクターで形質転換された宿主細胞で発現させることができ、会合して多量体となることが可能にされ、多量体化ドメインは相互作用して多価ポリペプチドを形成する。バリアントCD80ポリペプチドに対する多量体化ドメインの化学的連結は、ヘテロ二官能性リンカーを使用して実施することができる。
融合タンパク質などの得られたキメラポリペプチド、及びそれから形成された多量体は、例えば、プロテインAまたはプロテインGカラムでのアフィニティークロマトグラフィーなどの任意の適切な方法によって精製することができる。異なるポリペプチドをコードする2つの核酸分子が細胞に形質転換される場合、ホモ及びヘテロ二量体の形成が起こる。発現条件は、ホモ二量体形成よりもヘテロ二量体形成が優先されるように調整できる。
いくつかの実施形態では、多量体化ドメインは、免疫グロブリン由来のFcドメインまたはその一部分である。いくつかの実施形態では、免疫調節タンパク質は、免疫グロブリンFcに結合したバリアントCD80ポリペプチドを含む(CD80 vIgD−Fc融合体とも呼ばれる「バリアントCD80−Fc融合体」などの「免疫調節Fc融合体」を得る)。いくつかの実施形態では、バリアントCD80ポリペプチドの結合は、FcのN末端である。いくつかの実施形態では、バリアントCD80ポリペプチドの結合は、FcのC末端である。いくつかの実施形態では、2つ以上のCD80バリアントポリペプチド(同一または異なる)は、N末端及びC末端に独立して結合している。
いくつかの実施形態では、FcはネズミまたはヒトFcである。いくつかの実施形態では、Fcは、哺乳動物またはヒトIgG1、IgG2、IgG3、またはIgG4Fc領域である。いくつかの実施形態では、Fcは、IgG1、例えばヒトIgG1に由来する。いくつかの実施形態では、Fcは、SEQ ID NO:277、359、または1712に記載のアミノ酸配列、またはSEQ ID NO:277、359または1712に対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、またはそれ以上の配列同一性を示すアミノ酸の配列を含む。
いくつかの実施形態では、Fc領域は、1つまたは複数の通常の機能を変化(例えば、低減)させるためのもう1つの改変を含有する。概して、Fc領域は、免疫グロブリンの主な機能である抗原結合能力に加えて、補体依存性細胞傷害(CDC)及び抗体依存性細胞傷害(ADCC)などのエフェクター機能に関与する。加えて、Fc領域に存在するFcRn配列は、in vivo FcRn受容体へのコンジュゲーションによりin vivo半減期を延長することにより、血清中のIgGレベルを調節する役割を果たす。いくつかの実施形態では、そのような機能は、提供されるFc融合タンパク質とともに使用するために、Fcにおいて低下または変化させることができる。
いくつかの実施形態では、本明細書で提供されるCD80−Fcバリアント融合体のFc領域に1つまたは複数のアミノ酸改変を導入することができ、これにより、Fc領域バリアントが生成される。いくつかの実施形態では、Fc領域バリアントは、エフェクター機能が低下している。エフェクター機能を変化させる可能性があるFc配列に対する変更または変異の例は数多くある。例えば、WO00/42072、WO2006019447、WO2012125850、WO2015/107026、US2016/0017041及びShields et al.J Biol.Chem.9(2):6591−6604(2001)は、FcRへの結合が改善または減少した例示的なFcバリアントについて記載する。これらの刊行物の内容は、参照により本明細書に明確に組み込まれている。
いくつかの実施形態では、提供されるバリアントCD80−Fc融合体は、エフェクター機能の低下を示すFc領域を含み、これにより、in vivoでのCD80−Fcバリアント融合体の半減期が重要であるが、特定のエフェクター機能(CDC及びADCCなど)が不要または有害である用途に対する望ましい候補となる。in vitro及び/またはin vivo細胞傷害アッセイを実施して、CDC及び/またはADCC活性の減少/枯渇を確認することができる。例えば、Fc受容体(FcR)結合アッセイを実施して、CD80−Fcバリアント融合体がFcγR結合を欠く(したがってADCC活性を欠く可能性が高い)が、FcRn結合能力は保持することを確認できる。ADCCを媒介する主な細胞であるNK細胞は、FcγRIIIのみを発現するが、一方、単球はFcγRI、FcγRII及びFcγRIIIを発現する。造血細胞でのFcR発現は、Ravetch and Kinet,Annu.Rev.Immunol.9:457−492(1991)の464頁の表3にまとめられている。関心対象の分子のADCC活性を評価するためのin vitroアッセイの非限定的な例は、米国特許第5,500,362号(例えば、Hellstrom,I.et al.Proc.Nat’l Acad.Sci.USA 83:7059−7063(1986)を参照)、及びHellstrom,I et al.,Proc.Nat’l Acad.Sci.USA 82:1499−1502(1985);米国特許第5,821,337号(Bruggemann,M.et al.,J.Exp.Med.166:1351−1361(1987)を参照のこと)に記載されている。あるいは、非放射性アッセイ法を使用してもよい(例えば、フローサイトメトリー用のACTI(商標)非放射性細胞傷害性アッセイ(CellTechnology,Inc.Mountain View,Calif.;及びCytoTox 96(商標)非放射性細胞傷害性アッセイ(Promega,Madison,Wis.)を参照のこと)。そのようなアッセイに有用なエフェクター細胞には、末梢血単核細胞(PBMC)及びナチュラルキラー(NK)細胞が含まれる。あるいは、またはこれに加えて、関心対象の分子のADCC活性は、例えば、Clynes et al.Proc.Nat’l Acad.Sci.USA 95:652−656(1998)に開示されているような動物モデルにおいて、in vivoで評価され得る。CD80−Fcバリアント融合体がC1qに結合できず、したがってCDC活性を欠いていることを確認するために、C1q結合アッセイを実施することもできる。例えば、WO2006/029879及びWO2005/100402のC1q及びC3c結合ELISAを参照のこと。補体の活性化を評価するために、CDCアッセイを実施してよい(例えば、Gazzano−Santoro et al.,J.Immunol.Methods 202:163(1996);Cragg,M.S.et al.,Blood 101:1045−1052(2003);及びCragg,M.S.and M.J.Glennie,Blood 103:2738−2743(2004)を参照のこと)。また、当技術分野において公知の方法を使用してFcRn結合及びin vivoクリアランス/半減期決定を実施することもできる(例えば、Petkova,S.B.et al.,Int’l.Immunol.18(12):1759−1769(2006)を参照のこと)。
エフェクター機能が低下しているCD80−Fcバリアント融合体には、EU番号付けによるFc領域の残基238、265、269、270、297、327、及び329のうちの1つまたは複数の置換を有するものが含まれる(米国特許第6,737,056号)。そのようなFc変異体には、EU番号付けによるアミノ酸位置265、269、270、297、及び327のうちの2つ以上に置換を有するFc変異体が含まれ、残基265及び297がアラニンに置換されたいわゆる「DANA」Fc変異体を含む(米国特許第7,332,581号)。
いくつかの実施形態では、CD80−Fcバリアント融合体のFc領域は、位置234、235、236、237、238、239、270、297、298、325、及び329(EU番号付けによって示される)におけるアミノ酸のいずれか1つまたは複数が、天然Fc領域と比較して異なるアミノ酸で置換されている、Fc領域を有する。そのようなFc領域の変化は、上記の変化に限定されず、例えば、Current Opinion in Biotechnology(2009)20(6),685−691に記載されている脱グリコシル化鎖(N297A及びN297Q)、IgG1−N297G、IgG1−L234A/L235A、IgG1−L234A/L235E/G237A、IgG1−A325A/A330S/P331S、IgG1−C226S/C229S、IgG1−C226S/C229S/E233P/L234V/L235A、IgG1− E233P/L234V/L235A/G236del/S267K、IgG1−L234F/L235E/P331S、IgG1−S267E/L328F、IgG2−V234A/G237A、IgG2−H268Q/V309L/A330S/A331S、IgG4−L235A/G237A/E318A、及びIgG4−L236Eなどの変化;WO2008/092117に記載されているG236R/L328R、L235G/G236R、N325A/L328R、及びN325LL328Rなどの変化;233、234、235、及び237位(EU番号付けによって示される)におけるアミノ酸挿入;ならびにWO2000/042072に記載されている部位における変化を含む。
FcRへの結合が改善または減少した、ある特定のFcバリアントが記載されている(例えば、米国特許第6,737,056号;WO2004/056312、WO2006019447及びShields et al.,J.Biol.Chem.9(2):6591−6604(2001)を参照のこと)。
いくつかの実施形態では、半減期を延長させる及び/または新生児Fc受容体(FcRn)への結合を改善する1つまたは複数のアミノ酸置換を含むバリアントFc領域を含む、CD80−Fcバリアント融合体が提供される。半減期が延長された及びFcRnに対する結合が改善された抗体が、US2005/0014934A1(Hintonら)またはWO2015107026に記載されている。これらの抗体は、FcRnへのFc領域の結合を改善する1つまたは複数の置換をその中に有するFc領域を含む。そのようなFcバリアントは、EU番号付けによるFc領域残基238、256、265、272、286、303、305、307、311、312、317、340、356、360、362、376、378、380、382、413、424、または434の1つまたは複数に置換、例えばFc領域残基434の置換、を有するものを含む(米国特許第7,371,826号)。
いくつかの実施形態では、CD80−Fcバリアント融合体のFc領域は、1つまたは複数のアミノ酸置換E356D及びM358L(EU番号付けによる)を含む。いくつかの実施形態では、CD80−Fcバリアント融合体のFc領域は、1つまたは複数のアミノ酸置換C220S、C226S及び/またはC229S(EU番号付けによる)を含む。いくつかの実施形態では、CD80バリアント融合体のFc領域は、1つまたは複数のアミノ酸置換R292C及びV302Cを含む。また、Fc領域バリアントの他の例に関して、Duncan&Winter,Nature 322:738−40(1988);米国特許第5,648,260号;米国特許第5,624,821号;及びWO94/29351も参照されたい。
いくつかの実施形態では、例えば、米国特許第6,194,551号、WO99/51642、及びIdusogie et al.,J.Immunol.164:4178−4184(2000)に記載される低下したC1q結合及び/または補体依存性細胞傷害(CDC)をもたらす変化がFc領域でなされる。
いくつかの実施形態では、1つまたは複数のアミノ酸改変を含むバリアントFc領域を含み、該バリアントFc領域がIgG1、例えばヒトIgG1に由来する、CD80−Fcバリアント融合体が提供される。いくつかの実施形態では、バリアントFc領域は、SEQ ID NO:277に記載のアミノ酸配列に由来する。いくつかの実施形態では、Fcは、SEQ ID NO:277の番号付けによるN82G(EU番号付けによるN297Gに対応する)である少なくとも1つのアミノ酸置換を含有する。いくつかの実施形態では、Fcは、SEQ ID NO:277の番号付けによるR77CまたはV87C(EU番号付けによるR292CまたはV302Cに対応する)である少なくとも1つのアミノ酸置換をさらに含有する。いくつかの実施形態では、バリアントFc領域は、SEQ ID NO:1429に記載のFc領域のような、SEQ ID NO:277の番号付けによるC5S(EU番号付けによるC220Sに対応する)アミノ酸改変をさらに含む。例えば、いくつかの実施形態では、バリアントFc領域は、以下のアミノ酸改変:EU番号付けによる、V297G及び次のアミノ酸改変C220S、R292CまたはV302Cの1つまたは複数(SEQ ID NO:277に基づいて、N82G及び次のアミノ酸改変C5S、R77CまたはV87Cの1つまたは複数に対応する)を含み、例えば、該Fc領域はSEQ ID NO:356に記載の配列を含む。いくつかの実施形態では、バリアントFc領域は、アミノ酸改変C220S、L234A、L235EまたはG237Aの1つまたは複数を含み、例えば、該Fc領域はSEQ ID NO:357に記載の配列を含む。いくつかの実施形態では、バリアントFc領域は、アミノ酸改変C220S、L235P、L234V、L235A、G236delまたはS267Kの1つまたは複数を含み、例えば、該Fc領域はSEQ ID NO:358に記載の配列を含む。いくつかの実施形態では、バリアントFcは、アミノ酸改変C220S、L234A、L235E、G237A、E356DまたはM358Lの1つまたは複数を含み、例えば、該Fc領域はSEQ ID NO:376に記載の配列を含む。
いくつかの実施形態では、本明細書で提供されるCD80−Fcバリアント融合体は、上記セクションIIに記載の説明に従ってバリアントCD80ポリペプチドを含む。いくつかの実施形態では、バリアントFc領域に連結された記載のバリアントCD80ポリペプチドのいずれか1つを含み、該バリアントFc領域が、変異R292C、N297G及びV302C(SEQ ID NO:xxxに記載の野生型ヒトIgG1 Fcに基づくとR77C、N82G及びV87Cに対応する)を含有するヒトIgG1 Fcではない、CD80−Fcバリアント融合体が提供される。いくつかの実施形態では、Fc領域またはバリアントFc領域に連結されたバリアントCD80ポリペプチドのいずれか1つを含み、該バリアントCD80ポリペプチドが、3つのアラニンからなるリンカーによってFcに連結していない、CD80−Fcバリアントが提供される。
いくつかの実施形態では、Fc領域は、SEQ ID NO:277に記載の野生型または非改変Fcの232位に対応するC末端リジンを欠く(EU番号付けによるK447delに対応)。いくつかの態様では、そのようなFc領域は、1つまたは複数の追加の改変、例えば、記載されたものなどのアミノ酸置換をさらに含むことができる。そのようなFc領域の例は、SEQ ID NO:356〜358、376、または1713〜1715に記載される。
いくつかの実施形態では、バリアントFc領域を含み、該バリアントFcは、SEQ ID NO:376、356、357、358、1429、もしくは1713〜1715のいずれかに記載のアミノ酸配列、またはSEQ ID NO:376、356、357、358、1429、もしくは1713〜1715のいずれかに対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、またそれ以上の配列同一性を示すアミノ酸の配列を含む、CD80−Fcバリアント融合体が提供される。
いくつかの実施形態では、Fcは、IgG2、例えばヒトIgG2に由来する。いくつかの実施形態では、Fcは、SEQ ID NO:278に記載のアミノ酸配列、またはSEQ ID NO:278に対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、またはそれ以上の配列同一性を示すアミノ酸の配列を含む。
いくつかの実施形態では、Fcは、SEQ ID NO:1427に記載のアミノ酸配列、またはSEQ ID NO:1427に対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または以上の配列同一性を示すアミノ酸の配列を含む。いくつかの実施形態では、IgG4 Fcは、ヒトIgG4のCH3ドメインがヒトIgG1のCH3ドメインで置換されており、阻害された凝集体形成を示す安定化されたFc、ヒトIgG4のCH3及びCH2ドメインがそれぞれヒトIgG1のCH3及びCH2ドメインで置換されている抗体、またはヒトIgG4のKabatらによって提案されたEUインデックスで示される位置409においてアルギニンがリジンで置換されており、阻害された凝集体形成を示す抗体である(例えば、米国特許第8,911,726号を参照のこと)。いくつかの実施形態では、Fcは、Fabアーム交換によって治療用抗体と内在性IgG4との間の組換えを防止すると示されている、S228P変異を含有するIgG4である(例えば、Labrijin et al.(2009)Nat.Biotechnol.,27(8)767−71を参照のこと)。いくつかの実施形態では、Fcは、SEQ ID NO:1428に記載のアミノ酸配列、またはSEQ ID NO:1428に対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、またはそれ以上の配列同一性を示すアミノ酸の配列を含む。
いくつかの実施形態では、バリアントCD80ポリペプチドは、例えばリンカーを介して、Fc配列に間接的に連結されている。いくつかの実施形態では、1つまたは複数の「ペプチドリンカー」がバリアントCD80ポリペプチドとFcドメインを連結する。いくつかの実施形態では、ペプチドリンカーは、単一アミノ酸残基またはそれより大きい長さであることができる。いくつかの実施形態では、ペプチドリンカーは、少なくとも1つのアミノ酸残基を有するが、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2、または1アミノ酸残基長以下である。いくつかの実施形態では、リンカーは柔軟なリンカーである。いくつかの実施形態では、リンカーは、(一文字アミノ酸コードで)GGGGS(「4GS」または「G4S」;SEQ ID NO:1717)または4GSリンカーの多量体、例えばSEQ ID NO:330に記載されるような(2xGGGGS;(G4S)2)またはSEQ ID NO:329に記載されるような(3xGGGGS;(G4S)3)例えば2つ、3つ、4つ、または5つの4GSリンカーの繰り返しである。いくつかの実施形態では、リンカーは、一連のアラニン残基を単独で、または別のペプチドリンカー(a4GSリンカーまたはその多量体など)に加えて含むことができる。いくつかの実施形態では、各連のアラニン残基の数は、2、3、4、5、または6個のアラニンである。いくつかの実施形態では、リンカーは、3つのアラニン(AAA)である。いくつかの実施形態では、バリアントCD80ポリペプチドは、リンカーを介してFc配列に間接的に連結されており、該リンカーは、3つのアラニン(AAA)で構成されていない。いくつかの実施例では、リンカーは、2xGGGGSの後に3つのアラニンが続く(GGGGSGGGGSAAA;SEQ ID NO:331)。いくつかの実施形態では、リンカーは、クローニングによって及び/または制限部位から導入されたアミノ酸をさらに含むことができ、例えば、リンカーは、制限部位BAMHIの使用によって導入されたアミノ酸GS(1文字のアミノ酸コード)を含むことができる。例えば、いくつかの実施形態では、リンカー(1文字のアミノ酸コード)は、GSGGGGS(SEQ ID NO:1716)、GS(G4S)3(SEQ ID NO:3028)、またはGS(G4S)5(SEQ ID NO:3029)である。いくつかの実施形態では、リンカーは剛性リンカーである。例えば、リンカーはαヘリックスリンカーである。いくつかの実施形態では、リンカーは、(一文字アミノ酸コードで)EAAAKまたはEAAAKリンカーの多量体、例えばSEQ ID NO:3026に記載されるような(1xEAAAK)、SEQ ID NO:3027に記載されるような(3xEAAAK)またはSEQ ID NO:3036に記載されるような(5xEAAAK)例えば2つ、3つ、4つ、または5つのEAAAKリンカーの繰り返しである。場合によっては、バリアントCD80を含む免疫調節ポリペプチドは、ペプチドリンカーの様々な組み合わせを含む。
いくつかの実施形態では、バリアントCD80ポリペプチドは、Fc配列に直接的に連結される。いくつかの実施形態では、バリアントCD80ポリペプチドは、ヒンジ領域の全てまたは一部をさらに欠いていた不活性FcなどのFcに直接的に連結している。ヒンジ領域の一部(6アミノ酸)を欠く例示的なFcは、SEQ ID NO:3025に記載されている。いくつかの実施形態では、CD80ポリペプチドは、Fc配列に直接的に連結される場合、該CD80ポリペプチドは、C末端において1、2、3、4、5、6、7、8、9、10、12、13、14、15、またはそれ以上のアミノ酸分切断され得る。いくつかの実施形態では、バリアントCD80ポリペプチドは、IgV領域をIgC領域に接続する1、2、3、4、5、6、7、8、9、10以上のアミノ酸を除去するために切断される。例えば、バリアントCD80ポリペプチドは、SEQ ID NO:3030に記載の例示的な野生型CD80主鎖に改変を含有することができる。
いくつかの実施形態では、バリアントCD80−Fc融合タンパク質は、Fcドメインに連結された2つのバリアントCD80 Fcポリペプチドによって形成される二量体である。いくつかの特定の実施形態では、CD80−Fcバリアント融合ポリペプチドの同一または実質的に同一の種(3つ以下のN末端またはC末端アミノ酸配列の差異を可能にする)は、二量体化してホモ二量体を作成する。いくつかの実施形態では、二量体は、2つのバリアントCD80 Fcポリペプチドが同一であるホモ二量体である。あるいは、異なる種のCD80−Fcバリアント融合ポリペプチドを二量体化してヘテロ二量体を得ることができる。したがって、いくつかの実施形態では、二量体は、2つのバリアントCD80 Fcポリペプチドが異なるヘテロ二量体である。
また、バリアントCD80−Fc融合タンパク質をコードする核酸分子も提供される。いくつかの実施形態では、Fc融合タンパク質の産生のために、バリアントCD80−Fc融合タンパク質をコードする核酸分子が適切な発現ベクターに挿入される。得られたバリアントCD80−Fc融合タンパク質は、Fc部分間に形成された鎖間ジスルフィド結合によりFcドメイン間のアセンブリが起こり、二量体、例えば二価のバリアントCD80−Fc融合タンパク質を生じさせる発現を伴う形質転換された宿主細胞で発現されることができる。
得られたFc融合タンパク質は、プロテインAまたはプロテインGカラムでのアフィニティークロマトグラフィーによって容易に精製することができる。ヘテロ二量体の生成の場合、精製のために追加ステップが必要になる可能性がある。例えば、異なるバリアントCD80ポリペプチドをコードする2つの核酸が細胞に形質転換される場合、Fcドメインを保持するバリアントCD80分子はジスルフィド連結ホモ二量体としても発現されるため、ヘテロ二量体の形成は生化学的に達成されなければならない。したがって、ホモ二量体は、鎖間ジスルフィドの破壊に有利であるが、鎖内ジスルフィドには影響しない条件下で減らすことができる。場合によっては、異なるバリアントCD80 Fc単量体を等モル量で混合し、酸化させてホモ二量体及びヘテロ二量体の混合物を形成する。この混合物の成分は、クロマトグラフ技術によって分離される。あるいは、以下に説明するノブ・イントゥ・ホール法を使用してバリアントCD80ポリペプチドを含有するFc融合分子を遺伝子操作し、発現させることにより、このタイプのヘテロ二量体の形成は偏り得る。
B.追加のIgSFドメインを有するスタック分子
いくつかの実施形態では、免疫調節タンパク質は、1つまたは複数の他の免疫グロブリンスーパーファミリー(IgSF)ドメインに直接的または間接的に連結された本明細書において提供されるバリアントCD80ポリペプチドのいずれかを含有することができる(「スタックされた」免疫調節タンパク質構築物、また「II型」免疫調節タンパク質とも呼ばれる)。いくつかの態様では、これは、2つ以上、例えば3つ以上のコグネイト結合パートナーと結合することによって免疫シナプスの多ターゲティング調節を提供する、固有のマルチドメイン免疫調節タンパク質を作製することができる。
いくつかの実施形態では、免疫調節タンパク質は、バリアントCD80ドメインと、野生型IgSFファミリーメンバーに見いだされない別のIgSFファミリーメンバー(例えば、哺乳動物IgSFファミリーメンバー)の1つまたは複数の他の親和性改変IgSFドメイン配列及び/または非親和性改変IgSFドメイン配列との組み合わせ(「非野生型組み合わせ」)及び/または配置(「非野生型配置」または「非野生型順列」)を含む。いくつかの実施形態では、免疫調節タンパク質は、2つ、3つ、4つ、5つまたは6つの免疫グロブリンスーパーファミリー(IgSF)ドメインを含有し、該IgSFドメインの少なくとも1つは、提供される記載によるバリアントCD80 IgSFドメイン(CD80のvIgD)である。
いくつかの実施形態では、追加のIgSFドメインの配列は、野生型または非改変IgSFドメインと比較して1つまたは複数のアミノ酸改変(例えば、置換)を含有する改変されたIgSFドメインであることができる。いくつかの実施形態では、IgSFドメインは、非親和性改変であってもよく(例えば、野生型)、または親和性が改変されていてもよい。いくつかの実施形態では、非改変または野生型IgSFドメインは、マウス、ラット、カニクイザル、もしくはヒト起源、またはそれらの組み合わせ由来であることができる。いくつかの実施形態では、追加のIgSFドメインは、表2に記載のIgSFファミリーメンバーのIgSFドメインであることができる。いくつかの実施形態では、追加のIgSFドメインは、表2に記載のIgSFファミリーメンバーに含有されるIgSFドメインと比較して、1つまたは複数のアミノ酸改変(例えば、置換)を含有する親和性改変IgSFドメインであることができる。
いくつかの実施形態では、追加のIgSFドメインは、以下から選択されるファミリーのIgSFファミリーメンバーに含有される、親和性改変または非親和性改変IgSFドメインである:シグナル制御タンパク質(SIRP)ファミリー、骨髄細胞に発現するトリガー受容体様(TREML)ファミリー、がん胎児性抗原関連細胞接着分子(CEACAM)ファミリー、シアル酸結合Ig様レクチン(SIGLEC)ファミリー、ブチロフィリンファミリー、B7ファミリー、CD28ファミリー、Vセット及び免疫グロブリンドメイン含有(VSIG)ファミリー、Vセット膜貫通ドメイン(VSTM)ファミリー、主要組織適合複合体(MHC)ファミリー、シグナル伝達リンパ球活性化分子(SLAM)ファミリー、白血球免疫グロブリン様受容体(LIR)、ネクチン(Nec)ファミリー、ネクチン様(NECL)ファミリー、ポリオウイルス受容体関連(PVR)ファミリー、天然細胞傷害誘発受容体(NCR)ファミリー、T細胞免疫グロブリン及びムチン(TIM)ファミリー、またはキラー細胞免疫グロブリン様受容体(KIR)ファミリー。いくつかの実施形態では、追加のIgSFドメインは独立して、CD80(B7−1)、CD86(B7−2)、CD274(PD−L1,B7−H1)、PDCD1LG2(PD−L2,CD273)、ICOSLG(B7RP1,CD275,ICOSL、B7−H2)、CD276(B7−H3)、VTCN1(B7−H4)、CD28、CTLA4、PDCD1(PD−1)、ICOS、BTLA(CD272)、CD4、CD8A(CD8−α)、CD8B(CD8−β)、LAG3、HAVCR2(TIM−3)、CEACAM1、TIGIT、PVR(CD155)、PVRL2(CD112)、CD226、CD2、CD160、CD200、CD200R1(CD200R)、及びNC R3(NKp30)からなる群より選択されるIgSFタンパク質に由来する。
表2の1列目は、その特定のIgSFメンバーについての名称、及び任意でいくつかの可能な別名を提供する。2列目は、uniprot.orgでインターネットを介してアクセス可能な公的に利用可能なデータベースである、UniProtKBデータベースのタンパク質識別子を提供し、場合によっては、GenBank番号を提供する。Universal Protein Resource(UniProt)は、タンパク質配列及び注釈データ用の包括的リソースである。UniProtデータベースは、UniProt知識ベース (UniProtKB)を含む。UniProtは、欧州バイオインフォマティクス研究所(EMBL−EBI)、SIBスイスバイオインフォマティクス研究所、及びタンパク質情報リソース(PIR)の間の共同組織であり、米国国立衛生研究所(NIH)の寄付金によって主に支援されている。GenBankは、NIHの遺伝子配列データベースであり、全ての公的に利用可能なDNA配列が注釈付きで集められている(Nucleic Acids Research,2013 Jan;41(D1):D36−42)。3列目は、表示のIgSFドメインが位置している領域を提供する。該領域は、ドメインが範囲を規定している残基を包含する範囲として特定される。3列目はまた、特定のIgSF領域のIgSFドメインクラスを示す。4列目は、表示の追加のドメインが位置している領域を提供する(シグナルペプチドはS、細胞外ドメインはE、膜貫通ドメインはT、細胞質ドメインはC)。ドメインの記載は、当該ドメインの特定または分類に用いる方法に応じて異なり得ること、及び異なる源から異なって特定され得ることを理解されたい。表2のドメインに対応する残基の記載は、例示ものにすぎず、アミノ酸数個(例えば、1個、2個、3個、または4個)分長いまたは短い場合がある。5列目は、列挙されたIgSFメンバーのうちのいくつか(そのコグネイトな細胞表面結合パートナーのうちのいくつか)を示す。
「スタックされた」免疫調節タンパク質構築物に存在するそのような非親和性改変または親和性改変IgSFドメイン(非野生型組み合わせまたは非野生型配置にかかわらず)の数は、少なくとも2つ、3つ、4つ、または5つ、そして、いくつかの実施形態では、正確に2つ、3つ、4つ、または5つのIgSFドメインである(その親和性改変IgSFドメインの数の決定は、あらゆるその非特異的結合部分配列及び/または実質的に免疫学的に不活性なその部分配列を無視する)。
本明細書において提供されるスタックされた免疫調節タンパク質のいくつかの実施形態では、IgSFドメインの数は少なくとも2つであり、親和性改変IgSFドメインの数及び非親和性改変IgSFドメインの数は、それぞれ独立して、少なくとも0、1つ、2つ、3つ、4つ、5つ、または6つである。したがって、親和性改変IgSFドメインの数及び非親和性改変IgSFドメインの数はそれぞれ(親和性改変IgSFドメイン:非親和性改変IgSFドメイン)、正確にまたは少なくとも2:0(親和性改変:野生型)、0:2、2:1、1:2、2:2、2:3、3:2、2:4、4:2、1:1、1:3、3:1、1:4、4:1、1:5、または5:1であることができる。
スタックされた免疫調節タンパク質のいくつかの実施形態では、非親和性改変IgSFドメイン及び/または親和性改変IgSFドメインの少なくとも2つは、同一のIgSFドメインである。
いくつかの実施形態では、本明細書において提供されるスタックされた免疫調節タンパク質は、単一のIgSFメンバー由来であるが非野生型配置(あるいは「順列」)の、少なくとも2つの親和性改変IgSFドメイン及び/または非親和性改変IgSFドメインを含む。非野生型配置または順列の1つの実例は、そのIgSFドメイン配列が本明細書において提供されるとおりのバリアントIgSFドメインの供給源としての役割を果たす野生型CD80に見いだされるものと比べて、非野生型順序の親和性改変IgSFドメイン配列及び/または非親和性改変IgSFドメイン配列を含む免疫調節タンパク質である。したがって、一例では、免疫調節タンパク質は、非親和性改変形態及び/または親和性改変形態にかかわらず、膜貫通ドメインに近位のIgV及び膜貫通ドメインから遠位のIgCを含むことができる。非親和性改変IgSFドメイン及び/または親和性改変IgSFドメインの非野生型組み合わせ及び非野生型配置の両方が、本明細書において提供される免疫調節タンパク質に存在することも、提供される主題の範囲内である。
スタックされた免疫調節タンパク質のいくつかの実施形態では、非親和性改変IgSFドメイン及び/または親和性改変IgSFドメインは、非同一(すなわち、異なる)IgSFドメインである。非同一親和性改変IgSFドメインは、特異的結合条件下で、異なるコグネイト結合パートナーと特異的に結合し、これらが操作される野生型または非改変IgSFドメインが同じあったか否かに関係なく「非同一」である。したがって、例えば、免疫調節タンパク質における少なくとも2つの非同一IgSFドメインの非野生型組み合わせは、その起源が1つのCD80に由来しかつこれに固有である少なくとも1つのIgSFドメイン配列、及びその起源がCD80ではない別のIgSFファミリーメンバーに由来しかつこれに固有である少なくとも1つの第2のIgSFドメイン配列を含むことができ、該免疫調節タンパク質のIgSFドメインは、非親和性改変形態及び/または親和性改変形態である。しかしながら、その他の実施形態では、2つの非同一IgSFドメインは、同じIgSFドメイン配列に由来するが、少なくとも1つは、該非同一IgSFドメインが異なるコグネイト結合パートナーに特異的に結合するように親和性が改変されている。
いくつかの実施形態では、提供される免疫調節タンパク質は、バリアントCD80ポリペプチドを含有することに加えて、少なくとも1、2、3、4、5または6個の追加の免疫グロブリンスーパーファミリー(IgSF)ドメイン、例えば表2に記載のIgSFファミリーメンバーのIgDドメインも含有する。いくつかの実施形態では、提供される免疫調節タンパク質は、少なくとも1つの追加のIgSFドメイン(例えば、第2のIgSFドメイン)を含有する。いくつかの実施形態では、提供される免疫調節タンパク質は、少なくとも2つの追加のIgSFドメイン(例えば、第2及び第3のIgSFドメイン)を含有する。いくつかの実施形態では、提供される免疫調節タンパク質は、少なくとも3つの追加のIgSFドメイン(例えば、第2、第3、及び第4)を含有する。いくつかの実施形態では、提供される免疫調節タンパク質は、少なくとも4つの追加のIgSFドメイン(例えば、第2、第3、第4、及び第5)を含有する。いくつかの実施形態では、提供される免疫調節タンパク質は、少なくとも5つの追加のIgSFドメイン(例えば、第2、第3、第4、第5、及び第6)を含有する。いくつかの実施形態では、提供される免疫調節タンパク質は、少なくとも6つの追加のIgSFドメイン(例えば、第2、第3、第4、第5、第6、及び第7)を含有する。いくつかの実施形態では、免疫調節タンパク質のIgSFドメインのそれぞれは異なる。いくつかの実施形態では、追加のIgSFドメインの少なくとも1つは、免疫調節タンパク質の少なくとも1つの他のIgSFドメインと同じである。いくつかの実施形態では、IgSFドメインのそれぞれは、異なるIgSFファミリーメンバーに由来するか、または異なるIgSFファミリーメンバーから誘導される。いくつかの実施形態では、IgSFドメインの少なくとも2つは、同一のIgSFファミリーメンバーに由来するか、または同一のIgSFファミリーメンバーから誘導される。
いくつかの実施形態では、追加のIgSFドメインは、IgVドメインもしくはIgC(例えば、IgC2)ドメイン(複数可)、またはIgVドメインの特異的結合断片もしくはIgC(例えば、IgC2)ドメイン(複数可)の特異的結合断片を含む。いくつかの実施形態では、追加のIgSFドメインは、完全長IgVドメインであるか、それを含む。いくつかの実施形態では、追加のIgSFドメインは、完全長IgC(例えば、IgC2)ドメイン(複数可)であるか、それを含む。いくつかの実施形態では、追加のIgSFドメインは、IgVドメインの特異的結合断片であるか、それを含む。いくつかの実施形態では、追加のIgSFドメインは、IgC(例えば、IgC2)ドメイン(複数可)の特異的結合断片であるか、それを含む。いくつかの実施形態では、免疫調節タンパク質は、単一の(同じ)IgSFメンバー由来の少なくとも2つの追加のIgSFドメインを含有する。例えば、いくつかの態様では、免疫調節タンパク質は、完全長IgVドメイン及び完全長IgC(例えば、IgC2)ドメイン(複数可)またはその特異的結合断片を含有するIgSFメンバーのECDまたはその一部分を含有する。
いくつかの実施形態では、提供される免疫調節タンパク質は、少なくとも1つの追加のIgSFドメイン(例えば、第2の、または場合によっては、第3のIgSFドメインなども)を含有し、少なくとも1つの追加のまたは第2のIgSFドメインは、SEQ ID NO:224〜249及び306のいずれかに記載のアミノ酸配列に含有される野生型または非改変IgSFドメインまたはその特異的結合断片に記載のIgSFドメインである。いくつかの実施形態では、野生型または非改変IgSFドメインは、IgVドメインまたはIgCドメイン、例えばIgC1またはIgC2ドメインである。
いくつかの実施形態では、提供される免疫調節タンパク質は、バリアントCD80ポリペプチドを含有することに加えて、少なくとも1つの追加の親和性改変IgSFドメイン(例えば、第2の、または場合によっては、第3の親和性改変IgSFドメインなども)も含有し、少なくとも1つの追加のIgSFドメインは、野生型または非改変IgSFドメイン内のIgSFドメイン、例えば表2に記載のIgSFファミリーメンバーのIgSFドメインと比較して、1つまたは複数のアミノ酸改変(例えば、置換、欠失または変異)を含有するvIgDである。いくつかの実施形態では、追加の、例えば第2または第3の親和性改変IgSFドメインは、SEQ ID NO:224〜249及び306のいずれかに記載のアミノ酸配列に含有される野生型または非改変IgSFドメインまたはその特異的結合断片に対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、またはそれ以上の配列同一性を含む。いくつかの実施形態では、野生型または非改変IgSFドメインは、IgVドメインまたはIgCドメイン、例えばIgC1またはIgC2ドメインである。いくつかの実施形態では、追加の、例えば第2または第3のIgSFドメインは、親和性改変IgVドメイン及び/またはIgCドメインである。いくつかの実施形態では、1つまたは複数の追加のIgSFドメインは、IgVドメイン及び/またはIgC(例えば、IgC2)ドメイン(複数可)、またはIgVドメインの特異的結合断片及び/またはIgC(例えば、IgC2)ドメイン(複数可)の特異的結合断片を含有する親和性改変IgSFドメインであり、該IgVドメイン及び/またはIgCドメインは、アミノ酸改変(例えば、置換)(複数可)を含有する。いくつかの実施形態では、1つまたは複数の追加の親和性改変IgSFドメインは、アミノ酸改変(例えば、置換)(複数可)を含有するIgVドメインを含有する。いくつかの実施形態では、1つまたは複数の追加の親和性改変IgSFドメインは、対応する非改変IgSFファミリーメンバーのECDまたはECDの一部分に存在するIgSFドメイン、例えば、完全長IgVドメイン及び完全長IgC(例えば、IgC2)ドメイン(複数可)またはその特異的結合断片を含み、該IgV及びIgCの一方または両方は、アミノ酸改変(例えば、置換)(複数可)を含有する。
いくつかの実施形態では、提供される免疫調節タンパク質は、CD80以外の野生型または非改変IgSFドメインのIgSFドメイン(例えば、IgV)と比較して、1つまたは複数のアミノ酸置換を含有するvIgDである少なくとも1つの追加のまたは第2のIgSFドメインを含有する。
いくつかの実施形態では、1つまたは複数の追加のIgSFドメイン(例えば、第2または第3のIgSF)ドメインは、それ自体も阻害性受容体に結合する別のIgSFファミリーメンバーのIgSFドメイン(例えば、IgV)である。いくつかの態様では、1つまたは複数の追加のIgSFドメイン(例えば、第2または第3のIgSF)ドメインは、阻害性受容体に結合し、IgSFドメイン(例えば、IgV)に1つまたは複数のアミノ酸置換を含有するIgSFファミリーメンバーのバリアントIgSFドメイン(vIgD)である親和性改変IgSFドメインであり、場合によっては、該1つまたは複数のアミノ酸改変により阻害性受容体への結合が増加する。いくつかの実施形態では、vIgDは、阻害性受容体に結合するIgSFファミリーメンバーの野生型または非改変IgSFドメイン(例えば、IgV)に1つまたは複数のアミノ酸改変(例えば、置換、欠失または付加)を含有する。CTLA−4に加えて、そのような阻害性受容体の例は、PD−1、LAG3、TIGIT、TIM−3、またはBTLAである。いくつかの実施形態では、1つまたは複数の追加のIgSFドメインは、CD155、CD112、PD−L1、PD−L2、またはCEACAM1から選択されるIgSFファミリーメンバー由来である。したがって、いくつかの態様では、2つ以上の阻害性受容体の活性を標的とする、または遮断するマルチターゲットチェックポイント拮抗物質が提供される。いくつかの実施形態では、少なくとも2つ、3つ、4つ以上の阻害性受容体の活性を標的とする、または遮断するマルチターゲットチェックポイント拮抗物質における免疫調節タンパク質である。
いくつかの実施形態では、バリアントCD80ポリペプチドのいずれか1つ、及び野生型または非改変阻害性受容体などの阻害性受容体の1つまたは複数のIgSFドメインを含有する免疫調節タンパク質が提供される。いくつかの実施形態では、バリアントCD80ポリペプチドのいずれか1つ、及びCD112、例えば野生型または非改変CD112の1つまたは複数のIgSFドメイン、例えば、SEQ ID NO:734もしくは829に記載のIgVドメイン、またはSEQ ID NO:269またはその一部分に記載のECDもしくはその一部分(IgV及びIgCドメインまたはその特異的結合断片を含有する)を含有する免疫調節タンパク質が提供される。いくつかの実施形態では、バリアントCD80ポリペプチドのいずれか1つ、及びCD155、例えば野生型または非改変CD155の1つまたは複数のIgSFドメイン、例えば、SEQ ID NO:378もしくは421に記載のIgVドメイン、またはSEQ ID NO:268またはその一部分に記載のECDもしくはその一部分(IgV及びIgCドメインまたはその特異的結合断片を含有する)を含有する免疫調節タンパク質が提供される。いくつかの実施形態では、バリアントCD80ポリペプチドのいずれか1つ、及びPD−L1、例えば野生型または非改変PD−L1の1つまたは複数のIgSFドメイン、例えば、SEQ ID NO:1000もしくは1196に記載のIgVドメイン、またはSEQ ID NO:251もしくは1721またはその一部分に記載のECDもしくはその一部分(IgV及びIgCドメインまたはその特異的結合断片を含有する)を含有する免疫調節タンパク質が提供される。いくつかの実施形態では、バリアントCD80ポリペプチドのいずれか1つ、及びPD−L2、例えば野生型または非改変PD−L2の1つまたは複数のIgSFドメイン、例えば、SEQ ID NO:1197もしくは1257に記載のIgVドメイン、またはSEQ ID NO:252またはその一部分に記載のECDもしくはその一部分(IgV及びIgCドメインまたはその特異的結合断片を含有する)を含有する免疫調節タンパク質が提供される。
いくつかの実施形態では、阻害性受容体に結合するIgSFファミリーメンバーのvIgDである1つまたは複数の追加のIgSFドメイン(例えば、第2または第3のIgSF)を含有する免疫調節タンパク質が提供され、IgSFドメイン(例えば、IgV)の1つまたは複数のアミノ酸改変により、非改変IgSFドメインと比較して、vIgD、または該vIgDを含有する融合体または免疫調節タンパク質の、その阻害性受容体コグネイト結合パートナーに対する結合親和性が増加し、例えば、結合親和性は1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、または50倍より大きく増加する。いくつかの実施形態では、IgSFドメイン(例えば、IgV)の1つまたは複数のアミノ酸改変により、非改変IgSFドメインと比較して、vIgD、または該vIgDを含有する融合体または免疫調節タンパク質の、その阻害性受容体に対する選択性が増加する。いくつかの実施形態では、選択性の増加は、阻害性受容体へのvIgDの結合と阻害性受容体ではないコグネイト結合パートナーなどの別のコグネイト結合パートナーへのvIgDの結合の比が、阻害性受容体への非改変IgSFの結合と別のコグネイト結合パートナーへの非改変IgSFの結合の比と比較して大きい。いくつかの実施形態では、該比率は、少なくとも1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍40倍もしくは50倍、または少なくとも約1.2倍、約1.5倍、約2倍、約3倍、約4倍、約5倍、約6倍、約7倍、約8倍、約9倍、約10倍、約15倍、約20倍、約30倍約40倍もしくは約50倍大きい。
いくつかの実施形態では、少なくとも1つの追加(例えば、第2または第3)vIgDは、非改変または野生型CD112と比較して、IgSFドメイン(例えば、IgV)に1つまたは複数のアミノ酸改変(例えば、置換、欠失または付加)を含有するバリアントCD112ポリペプチドのIgSFドメイン(例えば、IgV)であり、阻害性受容体TIGITに結合するIgSFファミリーメンバーである。バリアントCD112ポリペプチドのIgSFドメイン(例えば、IgV、またはIgV及びIgCを含有するECD)における置換、欠失または付加などの例示的なアミノ酸改変を表3に記載する。いくつかの実施形態では、提供されるバリアントCD80ポリペプチドのいずれか、及び表3に記載のアミノ酸改変のいずれかを含むIgVドメイン、例えば、SEQ ID NO:782〜828、830〜876、918〜999、1454〜1501のいずれかに記載のIgVドメイン、またはSEQ ID NO:782〜828、830〜876、918〜999、1454〜1501のいずれかに対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%を有し、1つまたは複数のアミノ酸改変を含むIgVドメインを含有するバリアントCD112ポリペプチドを含有する免疫調節タンパク質が提供される。いくつかの実施形態では、提供されるバリアントCD80ポリペプチドのいずれか、ならびに表3に記載のアミノ酸改変のいずれかが含まれるIgVドメイン及び/またはIgCドメインを含有するECDまたはその一部分、例えば、SEQ ID NO:735〜781、877〜917、1430〜1453のいずれかに記載のECD、またはSEQ ID NO:735〜781、877〜917、1430〜1453のいずれかに対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%を含有し、1つまたは複数のアミノ酸改変を含むECDを含有するバリアントCD112ポリペプチド、を含有する免疫調節タンパク質が提供される。
いくつかの実施形態では、少なくとも1つの追加(例えば、第2または第3)vIgDは、非改変または野生型CD155と比較して、IgSFドメイン(例えば、IgV)に1つまたは複数のアミノ酸改変(例えば、置換、欠失または付加)を含有するバリアントCD155ポリペプチドのIgSFドメイン(例えば、IgV)であり、阻害性受容体TIGITに結合するIgSFファミリーメンバーである。バリアントCD155ポリペプチドのIgSFドメイン(例えば、IgV、またはIgV及びIgCを含有するECD)における置換、欠失または付加などの例示的なアミノ酸改変を表4に記載する。いくつかの実施形態では、提供されるバリアントCD80ポリペプチドのいずれか、及び表4に記載のアミノ酸改変のいずれかを含むIgVドメイン、例えば、SEQ ID NO:400〜420、422〜442、540〜733、1502〜1547、1572、1573、1620〜1711のいずれかに記載のIgVドメイン、またはSEQ ID NO:400〜420、422〜442、540〜733、1502〜1547、1572、1573、1620〜1711のいずれかに対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%を有し、1つまたは複数のアミノ酸改変を含むIgVドメインを含有するバリアントCD155ポリペプチドを含有する免疫調節タンパク質が提供される。いくつかの実施形態では、提供されるバリアントCD80ポリペプチドのいずれか、ならびに表4に記載のアミノ酸改変のいずれかを含有するIgVドメイン及び/またはIgCドメインを含有するECDまたはその一部分、例えば、SEQ ID NO:379〜399、443〜539、1548〜1571、1574〜1619のいずれかに記載のECD、またはSEQ ID NO:379〜399、443〜539、1548〜1571、1574〜1619のいずれかに対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%を含有し、1つまたは複数のアミノ酸改変を含むECDを含有するバリアントCD155ポリペプチド、を含有する免疫調節タンパク質が提供される。
いくつかの実施形態では、少なくとも1つの追加(例えば、第2または第3)vIgDは、非改変または野生型PD−L1と比較して、IgSFドメイン(例えば、IgVまたはECD)に1つまたは複数のアミノ酸改変(例えば、置換、欠失または付加)を含有するバリアントPD−L1ポリペプチドのIgSFドメイン(例えば、IgV)であり、これにより、いくつかの態様では、阻害性受容体PD−1への結合が増加する。バリアントPD−L1ポリペプチドのIgSFドメイン(例えば、IgV、またはIgV及びIgCを含有するECD)における置換、欠失または付加などの例示的なアミノ酸改変を表5に記載する。いくつかの実施形態では、提供されるバリアントCD80ポリペプチドのいずれか、及び表5に記載のアミノ酸改変のいずれかを含むIgVドメイン、例えば、SEQ ID NO:1066〜1195、1719、1720、1901〜1930のいずれかに記載のIgVドメイン、またはSEQ ID NO:1066〜1195、1719、1720、1901〜1930のいずれかに対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%を有し、1つまたは複数のアミノ酸改変を含むIgVドメインを含有するバリアントPD−L1ポリペプチドを含有する免疫調節タンパク質が提供される。いくつかの実施形態では、提供されるバリアントCD180ポリペプチドのいずれか、ならびに表5に記載のアミノ酸改変のいずれかを含有するIgVドメイン及び/またはIgCドメインを含有するECDまたはその一部分、例えば、SEQ ID NO:1001〜1065、1718、1722〜1900、1931〜1996のいずれかに記載のECD、またはSEQ ID NO:1001〜1065、1718、1722〜1900、1931〜1996のいずれかに対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%を含有し、1つまたは複数のアミノ酸改変を含むECDを含有するバリアントPD−L1ポリペプチドを含有する免疫調節タンパク質が提供される。
いくつかの実施形態では、少なくとも1つの追加(例えば、第2または第3)vIgDは、非改変または野生型PD−L2と比較して、IgSFドメイン(例えば、IgV)に1つまたは複数のアミノ酸改変(例えば、置換、欠失または付加)を含有するバリアントPD−L2ポリペプチドのIgSFドメイン(例えば、IgV)でありこれにより、いくつかの態様では、阻害性受容体PD−1への結合が増加する。バリアントPD−L2ポリペプチドのIgSFドメイン(例えば、IgV、またはIgV及びIgCを含有するECD)における置換、欠失または付加などの例示的なアミノ酸改変を表6に記載する。いくつかの実施形態では、提供されるバリアントCD80ポリペプチドのいずれか、及び表6に記載のアミノ酸改変のいずれかを含むIgVドメイン、例えば、SEQ ID NO:1275〜1325、1327〜1401、1403〜1426のいずれかに記載のIgVドメイン、またはSEQ ID NO:1275〜1325、1327〜1401、1403〜1426のいずれかに対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%を有し、1つまたは複数のアミノ酸改変を含むIgVドメインを含有するバリアントPD−L2ポリペプチドを含有する免疫調節タンパク質が提供される。いくつかの実施形態では、提供されるバリアントCD80ポリペプチドのいずれか、ならびに表6に記載のアミノ酸改変のいずれかを含有するIgVドメイン及び/またはIgCドメインを含有するECDまたはその一部分、例えば、SEQ ID NO:1198〜1248、1250〜1256、1258〜1274のいずれかに記載のECD、またはSEQ ID NO:1198〜1248、1250〜1256、1258〜1274のいずれかに対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%を含有し、1つまたは複数のアミノ酸改変を含むECDを含有するバリアントPD−L2ポリペプチド、を含有する免疫調節タンパク質が提供される。
いくつかの実施形態では、CD155、CD112、PD−L1、またはPD−L2または前述のいずれかのバリアントのIgSFドメイン(例えば、IgV)を含有する本明細書で提供される免疫調節タンパク質は、上記セクションIIに記載の説明に従ってバリアントCD80ポリペプチドが含まれたものである。いくつかの実施形態では、CD155、CD112、PD−L1、またはPD−L2または前述のいずれかのバリアントのIgSFドメイン(例えば、IgV)及びバリアントCD80ポリペプチドのIgSFドメインを含有する提供される免疫調節タンパク質は、SEQ ID NO:2、76または150に記載の非改変CD80ポリペプチドにアミノ酸改変を含まず、唯一のアミノ酸改変が
であるバリアントCD80ポリペプチドが含まれたものである。いくつかの実施形態では、バリアントCD80ポリペプチドは、SEQ ID NO:3〜75、77〜149または151〜223に記載のポリペプチドではない。
いくつかの実施形態では、提供される免疫調節タンパク質は、CD155またはそのいずれかのバリアントのIgSFドメインを含有しない。いくつかの実施形態では、提供される免疫調節タンパク質は、CD112またはそのいずれかのバリアントのIgSFドメインを含有しない。いくつかの実施形態では、提供される免疫調節タンパク質は、PD−L1またはそのいずれかのバリアントのIgSFドメインを含有しない。いくつかの実施形態では、提供される免疫調節タンパク質は、PD−L2またはそのいずれかのバリアントのIgSFドメインを含有しない。
いくつかの実施形態では、1つまたは複数の追加のIgSFドメイン(例えば、第2または第3のIgSF)ドメインは、腫瘍抗原と結合またはそれを認識する別のIgSFファミリーメンバーのIgSFドメイン(例えば、IgV)である。かかる実施形態では、IgSFファミリーメンバーは腫瘍局在化部分として機能し、これによりCD80のvIgDを腫瘍微小環境内の免疫細胞に極めて接近させる。いくつかの実施形態では、追加のIgSFドメイン(例えば、第2のIgSF)ドメインは、NKp30のIgSFドメインであり、腫瘍細胞に発現するB7−H6と結合またはそれを認識する。いくつかの実施形態では、少なくとも1つの追加の(例えば、第2の)IgSFドメイン、例えばNKp30は、1つまたは複数のアミノ酸改変(例えば、置換、欠失または付加)を含有する親和性改変IgSFドメインまたはvIgDである。いくつかの実施形態では、1つまたは複数のアミノ酸改変は、非改変IgSFドメイン、例えばNKp30と比較して、B7−H6に対する結合親和性及び/または選択性を、少なくとも1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍40倍もしくは50倍、または少なくとも約1.2倍、約1.5倍、約2倍、約3倍、約4倍、約5倍、約6倍、約7倍、約8倍、約9倍、約10倍、約15倍、約20倍、約30倍約40倍もしくは約50倍増加させる。バリアントNKp30ポリペプチドのIgSFドメイン(例えば、IgC様または完全ECD)における置換、欠失または付加などの例示的なアミノ酸改変を表7に記載する。例示的なポリペプチドの中には、SEQ ID NO:275に記載の位置に対応するNKp30細胞外ドメインの位置に基づいて変異L30V/A60V/S64P/S86Gを含有するNKp30バリアントがある。いくつかの実施形態では、提供されるバリアントCD80ポリペプチドのいずれか、及び表7に記載のアミノ酸改変のいずれかを含むIgC様ドメイン、例えばSEQ ID NO:344〜348のいずれかに記載のIgC様ドメイン、またはSEQ ID NO:344〜348のいずれかに対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%を有し、1つまたは複数のアミノ酸改変を含むIgVドメインを含有するバリアントNKp30ポリペプチドを含有する免疫調節タンパク質が提供される。いくつかの実施形態では、提供されるバリアントCD180ポリペプチドのいずれか、ならびに表7に記載のアミノ酸改変のいずれかを含有するIgSFドメイン(複数可)を含有するECDまたはその一部分、例えば、SEQ ID NO:334〜338のいずれかに記載のECD、またはSEQ ID NO:334〜338のいずれかに対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%を含有し、1つまたは複数のアミノ酸改変を含むECDを含有するバリアントNKp30ポリペプチド、を含有する免疫調節タンパク質が提供される。
いくつかの実施形態では、少なくとも1つの追加(例えば、第2または第3)vIgDは、非改変または野生型CD86と比較して、IgSFドメイン(例えば、IgV)に1つまたは複数のアミノ酸改変(例えば、置換、欠失または付加)を含有するバリアントCD86ポリペプチドのIgSFドメイン(例えば、IgV)であり、これにより、いくつかの態様では、そのコグネイト結合受容体への結合が増加する。バリアントCD86ポリペプチドのIgSFドメイン(例えば、IgV、またはIgV及びIgCを含有するECD)における置換、欠失または付加などの例示的なアミノ酸改変を表8に記載する。例示的なポリペプチドの中には、SEQ ID NO:250に記載の位置に対応するCD86細胞外ドメインの位置に基づいた変異Q35H/H90L/Q102Hを含有するCD86バリアントがある。いくつかの実施形態では、提供されるバリアントCD80ポリペプチドのいずれか、及び表8に記載のアミノ酸改変のいずれかを含むIgVドメイン、例えば、SEQ ID NO:350〜353のいずれかに記載のIgVドメイン、またはSEQ ID NO:350〜353のいずれかに対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%を有し、1つまたは複数のアミノ酸改変を含むIgVドメインを含有するバリアントCD86ポリペプチドを含有する免疫調節タンパク質が提供される。いくつかの実施形態では、提供されるバリアントCD80ポリペプチドのいずれか、ならびに表8に記載のアミノ酸改変のいずれかを含有するIgVドメイン及び/またはIgCドメインを含有するECDまたはその一部分、例えば、SEQ ID NO:339〜342のいずれかに記載のECD、またはSEQ ID NO:339〜342のいずれかに対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%を含有し、1つまたは複数のアミノ酸改変を含むECDを含有するバリアントCD86ポリペプチド、を含有する免疫調節タンパク質が提供される。
表3〜8は、本明細書で提供されるスタック構築物で使用することができる1つまたは複数の親和性改変IgSFドメインを含有する例示的なポリペプチドを提供する。
いくつかの実施形態では、CD80のvIgDを含む2つ以上のIgSFドメイン、及び別のIgSFファミリーメンバーの1つまたは複数の追加のIgSFドメイン(例えば、第2または第3のバリアントIgSFドメイン)は、共有結合または非共有結合的に連結する。スタックされた免疫調節タンパク質ポリペプチド鎖における複数の非親和性改変IgSFドメイン及び/または親和性改変IgSFドメインは、互いに直接共有結合的に連結する必要はない。いくつかの実施形態では、2つ以上のIgSFドメインは、直接、または、例えばリンカーを介して間接的に連結される。いくつかの実施形態では、1つまたは複数のアミノ酸残基の介在範囲は、IgSFドメインを互いに間接的に共有結合する。連結は、N末端からC末端残基を介して行うことができる。いくつかの実施形態では、連結は、IgSFドメイン(複数可)のN末端またはC末端に位置しないアミノ酸残基の側鎖を介してなされ得る。したがって、連結は、末端または内部アミノ酸残基またはそれらの組み合わせを介してなされ得る。
いくつかの実施形態では、免疫調節タンパク質は、少なくとも2つのIgSFドメインを含有し、それぞれ直接またはリンカーを介して間接的に連結されている。いくつかの実施形態では、免疫調節タンパク質は、少なくとも3つの免疫調節タンパク質を含有し、それぞれ直接またはリンカーを介して間接的に連結されている。様々な配置が図5A及び5Bに示される。
いくつかの実施形態では、1つまたは複数の「ペプチドリンカー」は、CD80のvIgD及び1つまたは複数の追加のIgSFドメイン(例えば、第2または第3のバリアントIgSFドメイン)を連結する。いくつかの実施形態では、ペプチドリンカーは、単一アミノ酸残基またはそれより大きい長さであることができる。いくつかの実施形態では、ペプチドリンカーは、少なくとも1つのアミノ酸残基を有するが、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2、または1アミノ酸残基長以下である。いくつかの実施形態では、リンカーは柔軟なリンカーである。いくつかの実施形態では、リンカーは、(一文字アミノ酸コードで)GGGGS(「4GS」)または4GSリンカーの多量体、例えば2つ、3つ、4つ、または5つの4GSリンカーの繰り返しである。いくつかの実施形態では、ペプチドリンカーは、(GGGGS)2(SEQ ID NO:330)または(GGGGS)3(SEQ ID NO:329)である。いくつかの実施形態では、リンカーはまた、一連のアラニン残基を単独で、または別のペプチドリンカー(4GSリンカーまたはその多量体など)に加えて含むこともできる。いくつかの実施形態では、各連のアラニン残基の数は、2、3、4、5、または6個のアラニンである。いくつかの実施形態では、リンカーはまた、一連のアラニン残基を単独で、または別のペプチドリンカー(4GSリンカーまたはその多量体など)に加えて含むこともできる。いくつかの実施形態では、各連のアラニン残基の数は、2、3、4、5、または6個のアラニンである。いくつかの実施形態では、リンカーは剛性リンカーである。例えば、リンカーはαヘリックスリンカーである。いくつかの実施形態では、リンカーは、(一文字アミノ酸コードで)EAAAKまたはEAAAKリンカーの多量体、例えばSEQ ID NO:3026に記載されるような(1xEAAAK)、SEQ ID NO:3027に記載されるような(3xEAAAK)またはSEQ ID NO:3036に記載されるような(5xEAAAK)例えば2つ、3つ、4つ、または5つのEAAAKリンカーの繰り返しである。いくつかの実施形態では、リンカーは、クローニングによって及び/または制限部位から導入されたアミノ酸をさらに含むことができ、例えば、リンカーは、制限部位BAMHIの使用によって導入されたアミノ酸GS(1文字のアミノ酸コード)を含むことができる。いくつかの実施例では、リンカーは、2xGGGGSの後に3つのアラニンが続く(GGGGSGGGGSAAA;SEQ ID NO:331)。
いくつかの実施形態では、非親和性改変及び/または親和性改変IgSFドメインは、非親和性改変及び/または親和性改変IgSFドメインのN末端及び/またはC末端に挿入された「野生型ペプチドリンカー」によって連結されている。これらのリンカーは、前方(leading)配列(N末端から非親和性改変または親和性改変IgSFドメイン)または後方(trailing)配列(C末端から非親和性改変または親和性改変IgSFドメイン)とも呼ばれ、IgSFのIgフォールドの構造予測のすぐ外側に伸びる野生型タンパク質に存在する配列である。いくつかの実施形態では、「野生型リンカー」とは、野生型タンパク質のアミノ酸配列において、シグナル配列の後であるが定義されたIgVドメインなどのIgSFドメインの前に存在するアミノ酸配列である。いくつかの実施形態では、「野生型」リンカーとは、野生型タンパク質のアミノ酸配列において、IgSFドメインの直後、例えば定義されたIgVドメインの直後であるがIgCドメインの前に存在するアミノ酸配列である。これらのリンカー配列は、隣接するIgSFドメイン(複数可)の適切なフォールディング及び機能に寄与することができる。いくつかの実施形態では、第1のIgSFドメインのN末端に挿入された前方ペプチドリンカー、及び/または第1の非親和性改変及び/または親和性改変IgSFドメインのC末端に挿入された後方配列が存在する。いくつかの実施形態では、第2のIgSFドメインのN末端に挿入された第2の前方ペプチドリンカー、及び/または第2の非親和性改変及び/または親和性改変IgSFドメインのC末端に挿入された第2の後方配列が存在する。第1及び第2の非親和性改変及び/または親和性改変IgSFドメインが同じ親タンパク質に由来し、同一方向に接続される場合、第1及び第2の非親和性改変及び/または親和性改変IgSFドメイン間の野生型ペプチドリンカーは複製されない。例えば、第1の後方の野生型ペプチドリンカーと第2の前方の野生型ペプチドリンカーが同じ場合、タイプII免疫調節タンパク質は、第1の後方の野生型ペプチドリンカーまたは第2の前方の野生型ペプチドリンカーのいずれも含まない。
いくつかの実施形態では、タイプII免疫調節タンパク質は、第1の非親和性改変及び/または親和性改変IgSFドメインのN末端に挿入された第1の前方の野生型ペプチドリンカーを含み、該第1の前方の野生型ペプチドリンカーは、第1の非親和性改変及び/または親和性改変IgSFドメインが親IgSFドメインと直前のドメイン(シグナルペプチドまたはIgSFドメインなど)の間に生じる野生型タンパク質の介在配列の少なくとも5個(少なくとも約6、7、8、9、10、11、12、13、14、15、またはそれ以上のいずれかなど)の連続アミノ酸を含む。いくつかの実施形態では、第1の前方の野生型ペプチドリンカーは、第1の非親和性改変及び/または親和性改変IgSFドメインが親IgSFドメインと直前のドメイン(シグナルペプチドまたはIgSFドメインなど)の間に生じる野生型タンパク質の完全な介在配列を含む。
いくつかの実施形態では、タイプII免疫調節タンパク質はさらに、第1の非親和性改変及び/または親和性改変IgSFドメインのC末端に挿入された第1の後方の野生型ペプチドリンカーを含み、該第1の後方の野生型ペプチドリンカーは、第1の非親和性改変及び/または親和性改変IgSFドメインが親IgSFドメインと直後のドメイン(IgSFドメインまたは膜貫通ドメインなど)の間に生じる野生型タンパク質の介在配列の少なくとも5個(少なくとも約6、7、8、9、10、11、12、13、14、15、またはそれ以上のいずれかなど)の連続アミノ酸を含む。いくつかの実施形態では、第1の後方の野生型ペプチドリンカーは、第1の非親和性改変及び/または親和性改変IgSFドメインが親IgSFドメインと直後のドメイン(IgSFドメインまたは膜貫通ドメインなど)の間に生じる野生型タンパク質の完全な介在配列を含む。
いくつかの実施形態では、タイプII免疫調節タンパク質はさらに、第2の非親和性改変及び/または親和性改変IgSFドメインのN末端に挿入された第2の前方の野生型ペプチドリンカーを含み、該第2の前方の野生型ペプチドリンカーは、第2の非親和性改変及び/または親和性改変IgSFドメインが親IgSFドメインと直前のドメイン(シグナルペプチドまたはIgSFドメインなど)の間に生じる野生型タンパク質の介在配列の少なくとも5個(少なくとも約6、7、8、9、10、11、12、13、14、15、またはそれ以上のいずれかなど)の連続アミノ酸を含む。いくつかの実施形態では、第2の前方の野生型ペプチドリンカーは、第2の非親和性改変及び/または親和性改変IgSFドメインが親IgSFドメインと直前のドメイン(シグナルペプチドまたはIgSFドメインなど)の間に生じる野生型タンパク質の完全な介在配列を含む。
いくつかの実施形態では、タイプII免疫調節タンパク質はさらに、第2の非親和性改変及び/または親和性改変IgSFドメインのC末端に挿入された第2の後方の野生型ペプチドリンカーを含み、該第2の後方の野生型ペプチドリンカーは、第2の非親和性改変及び/または親和性改変IgSFドメインが親IgSFドメインと直後のドメイン(IgSFドメインまたは膜貫通ドメインなど)の間に生じる野生型タンパク質の介在配列の少なくとも5個(少なくとも約6、7、8、9、10、11、12、13、14、15、またはそれ以上のいずれかなど)の連続アミノ酸を含む。いくつかの実施形態では、第2の後方の野生型ペプチドリンカーは、第2の非親和性改変及び/または親和性改変IgSFドメインが親IgSFドメインと直後のドメイン(IgSFドメインまたは膜貫通ドメインなど)の間に生じる野生型タンパク質の完全な介在配列を含む。
いくつかの実施形態では、CD80のvIgDを含む2つ以上のIgSFドメインと、別のIgSFファミリーメンバーの1つまたは複数の追加のIgSFドメイン(例えば、第2及び/または第3のバリアントIgSFドメイン)が、Fcに連結または結合してFc融合体(細胞内で発現すると、いくつかの態様では、二量体のマルチドメインスタック免疫調節タンパク質を産生し得る)を形成する。したがって、二量体のマルチドメイン免疫調節タンパク質も提供される。
いくつかの実施形態では、バリアントCD80ポリペプチド及び1つまたは複数のIgSFドメインは、Fc領域のN末端またはC末端に、直接的または間接的に独立して連結される。いくつかの実施形態では、バリアントCD80ポリペプチド及び1つまたは複数の追加のIgSFドメインの少なくとも1つは直接的または間接的に連結され、バリアントCD80の1つ及び1つまたは複数の追加のIgSFドメインの1つもFc領域のN末端またはC末端に直接的または間接的に連結される。いくつかの実施形態では、Fc領域のN末端またはC末端はバリアントCD80ポリペプチドに連結される、または、1つまたは複数の追加のIgSFドメイン及びFc領域のN末端またはC末端の他方は、もう一方のCD80バリアントまたは1つもしくは複数の追加のIgSFドメインの他方に連結される。いくつかの実施形態では、Fcへの連結は、ペプチドリンカー、例えば上記のようなペプチドリンカーを介する。いくつかの実施形態では、バリアントCD80と1つまたは複数の追加のIgSFドメインとの間の連結は、ペプチドリンカー、例えば上記のようなペプチドリンカーを介する。いくつかの実施形態では、CD80のvIgD、1つまたは複数の追加のIgSFドメイン、及びFcドメインは、図5A及び5Bに示されるように、多数の配置のいずれかで一緒に連結され得る。例示的な配置が、実施例に記載される。
いくつかの実施形態では、スタック免疫調節タンパク質は、2つの免疫調節性Fc融合ポリペプチドによって形成される二量体である。また、スタック免疫調節タンパク質のいずれかをコードする核酸分子も提供される。いくつかの実施形態では、二量体マルチドメインスタック免疫調節タンパク質は、二量体Fc融合タンパク質の生成に応じて上記のようなスタック免疫調節Fc融合ポリペプチドの発現、または場合によっては共発現によって細胞内で産生され得る。
いくつかの実施形態では、二量体マルチドメインスタック免疫調節タンパク質は、各Fc領域で二価、各サブユニットで一価、または一方のサブユニットで二価そしてもう一方のサブユニットで四価である。
いくつかの実施形態では、二量体マルチドメインスタック免疫調節タンパク質は、ホモ二量体マルチドメインスタックFcタンパク質である。いくつかの実施形態では、二量体マルチドメインスタック免疫調節タンパク質は、第1のスタック免疫調節Fc融合ポリペプチド、ならびに第1及び第2のポリペプチドが同じである第2のスタック免疫調節Fc融合ポリペプチドを含む。いくつかの実施形態では、マルチドメインスタック分子は、バリアントCD80及び第2のIgSFドメインを含有する第1のFc融合ポリペプチド、ならびにバリアントCD80及び第2のIgSFドメインを含有する第2のFc融合ポリペプチドを含有する。いくつかの実施形態では、マルチドメインスタック分子は、バリアントCD80、第2のIgSFドメイン、及び第3のIgSFドメインを含有する第1のFc融合ポリペプチド、ならびにバリアントCD80、第2のIgSFドメイン、及び第3のIgSFドメインを含有する第2のFc融合ポリペプチドを含有する。いくつかの実施形態では、第1及び/または第2の融合ポリペプチドのFc部分は、上記のような任意のFcであり得る。いくつかの実施形態では、第1及び第2の融合ポリペプチドのFc部分または領域は同じである。
いくつかの実施形態では、マルチドメインスタック分子はヘテロ二量体であり、2つの異なるFc融合ポリペプチド、例えば、第1及び第2のFc融合ポリペプチドを含み、少なくとも1つは、少なくとも1つのバリアントCD80ポリペプチドを含有するFc融合ポリペプチドであり、及び/または少なくとも1つは、第2のIgSFドメイン(例えば、第2のバリアントIgSFドメイン)を含有するFc融合ポリペプチドである。いくつかの実施形態では、第1または第2のFc融合ポリペプチドは、第3のIgSFドメイン(例えば、第3のバリアントIgSFドメイン)をさらに含有する。いくつかの実施形態では、マルチドメインスタック分子は、バリアントCD80を含有する第1のFc融合ポリペプチドと、第2のIgSFドメインを含有する第2のFc融合ポリペプチドを含み、場合によっては、第1または第2のFc融合ポリペプチドはさらに、第3のIgSFドメインを含有する。いくつかの実施形態では、マルチドメインスタック分子は、バリアントCD80、第2のIgSFドメインを含有する第1のFc融合ポリペプチド、場合によっては、第3のIgSFドメイン、及びバリアントCD80ポリペプチドまたは追加のIgSFドメインのいずれにも連結されていない第2のFc融合ポリペプチドを含有する。いくつかの実施形態では、第1及び第2の融合ポリペプチドのFc部分または領域は同じである。いくつかの実施形態では、第1及び第2の融合ポリペプチドのFc部分または領域は異なる。
いくつかの実施形態では、マルチドメインスタック分子は、1、2、3、4、またはそれ以上のバリアントCD80ポリペプチド及び1、2、3、4、またはそれ以上の追加のIgSFドメインを含有する第1のFc融合ポリペプチドを含有し、該第1のスタックFc融合ポリペプチド中のIgSFドメインの総数は、2、3、4、5、6、またはそれ以上よりも多い。そのような実施形態の一例では、第2のスタックFc融合ポリペプチドは、1、2、3、4、またはそれ以上のバリアントCD80ポリペプチド及び1、2、3、4、またはそれ以上の追加のIgSFドメインを含有し、該第1のスタックFc融合ポリペプチド中のIgSFドメインの総数は、2、3、4、5、6、またはそれ以上よりも多い。そのような実施形態の別の例では、第2のFc融合ポリペプチドは、バリアントCD80ポリペプチドまたは追加のIgSFドメインのいずれにも連結されていない。
いくつかの実施形態では、ヘテロ二量体スタック分子は、第1及び第2のポリペプチドが異なる第1スタック免疫調節Fc融合ポリペプチド及び第2のスタック免疫調節Fc融合ポリペプチドを含有する。いくつかの実施形態では、ヘテロ二量体スタック分子は、Fc領域及び第1のバリアントCD80ポリペプチド及び/または第2のIgSFドメイン(例えば、第2のバリアントIgSFドメイン)を含有する第1のFcポリペプチド融合体ならびにFc領域及びもう一方の第1のバリアントCD80ポリペプチドまたは第2のIgSFドメインを含有する第2のFcポリペプチド融合体を含有する。いくつかの実施形態では、ヘテロ二量体スタック分子は、Fc領域及び第1のバリアントCD80ポリペプチド及び/または第2のIgSFドメイン(例えば、第2のバリアントIgSFドメイン)を含有する第1のFcポリペプチド融合体、ならびにFc領域及び第1のバリアントCD80ポリペプチドと第2のIgSFドメイン(例えば、第2のバリアントIgSFドメイン)の両方を含有するが第1のFc領域とは異なる方向または配置である第2のFcポリペプチド融合体を含有する。いくつかの実施形態では、第1及び/または第2のFc融合ポリペプチドはまた、第3のIgSFドメイン(例えば、第3のバリアントIgSFドメイン)を含有する。
いくつかの実施形態では、第1及び第2のスタック免疫調節Fc融合ポリペプチドの一方または両方のFcドメインは、Fc分子の界面がヘテロ二量体化を促す及び/または促進するように改変されるような改変(例えば、置換)を含む。いくつかの実施形態では、改変には、第1のFcポリペプチドへの突起(ノブ)の導入、及び第2のFcポリペプチドへの空洞(ホール)の導入が含まれ、これにより突起が空洞内に配置され、第1及び第2のFc含有ポリペプチドの複合体形成が促進される。ポリペプチドに突起または空洞を作製するための置換及び/または改変の標的となるアミノ酸は、典型的には、第2のポリペプチドの界面の1つまたは複数のアミノ酸と相互作用または接触する界面アミノ酸である。
いくつかの実施形態では、Fc配列が配列のN末端部分である構築物の場合、Fc配列の前にアミノ酸の配列が付加される。場合によっては、アミノ酸配列HMSSVSAQ(SEQ ID NO:377)が、Fc配列が配列のN末端部分である構築物のFc配列の直前に付加される。いくつかの実施形態では、ヘテロ二量体スタック分子は、Fc領域(ノブ;例えば、SEQ ID NO:374に記載のFc配列)及び第1のバリアントポリペプチド及び/または第2のIgSFドメイン(例えば、第2のバリアントIgSFドメイン)を含有する第1のFcポリペプチド融合体、ならびにFc領域(ホール;例えば、SEQ ID NO:375に記載のFc配列)及びスタッファー配列HMSSVSAQ(SEQ ID NO:377)を含有する第2のFcポリペプチド融合体が、第1及び第2のFcポリペプチド融合体の両方のFc領域の直前に付加される。
いくつかの実施形態では、突起(ホール)アミノ酸を含有するように改変された第1のポリペプチドは、天然または元のアミノ酸の、第1のポリペプチドの界面から突出する少なくとも1つの側鎖を有するアミノ酸による置換を含み、その結果、第2のポリペプチドの隣接界面の代償性の空洞(ホール)に配置可能である。ほとんどの場合、置換アミノ酸は、元のアミノ酸残基よりも大きな側鎖体積を有するものである。当業者は、アミノ酸残基の特性を決定及び/または評価して、突起を作製するための理想的な置換アミノ酸を特定する方法を知っている。いくつかの実施形態では、突起の形成のための置換残基は、天然に存在するアミノ酸残基であり、例えば、アルギニン(R)、フェニルアラニン(F)、チロシン(Y)、またはトリプトファン(W)が挙げられる。いくつかの実施例では、置換のために特定された元の残基は、例えばアラニン、アスパラギン、アスパラギン酸、グリシン、セリン、スレオニン、またはバリンなどの小さな側鎖を有するアミノ酸残基である。
いくつかの実施形態では、空洞(ホール)を含有するように改変された第2のポリペプチドは、天然または元のアミノ酸の、第2のポリペプチドの界面からくぼんだ少なくとも1つの側鎖を有するアミノ酸による置換を含み、これにより、第1のポリペプチドの界面の対応する突起に適合可能である。ほとんどの場合、置換アミノ酸は、元のアミノ酸残基よりも小さい側鎖体積を有するものである。当業者は、アミノ酸残基の特性を決定及び/または評価して、空洞を形成するための理想的な置換残基を特定する方法を知っている。一般的に、空洞の形成のための置換残基は、天然に存在するアミノ酸であり、例えば、アラニン(A)、セリン(S)、スレオニン(T)、及びバリン(V)が挙げられる。いくつかの実施例では、置換のために特定された元のアミノ酸は、例えば、チロシン、アルギニン、フェニルアラニン、またはトリプトファンなどの大きな側鎖を有するアミノ酸である。
例えば、ヒトIgG1のCH3界面には、各表面から1090Å2埋め込まれる4つの逆平行βストランド上に位置する各ドメインに16残基が含まれる(例えば、Deisenhofer et al.(1981) Biochemistry,20:2361−2370;Miller et al.,(1990)J Mol.Biol.,216,965−973;Ridgway et al.,(1996)Prot.Engin. 9:617−621;米国特許第5,731,168号参照のこと)。突起または空洞を作製するためのCH3ドメインの改変は、例えば、米国特許第5,731,168号;国際特許出願WO98/50431及びWO2005/063816;及びRidgway et al.,(1996)Prot.Engin.9:617−621に記載されている。いくつかの実施例では、突起または空洞を作製するためのCH3ドメインの改変は、典型的には2つの中央の逆平行βストランドに位置する残基を標的としている。その目的は、作製された突起が、パートナーCH3ドメインの代償性の空洞により適合されるのではなく、周囲の溶媒へと突出することにより適合され得るリスクを最小限に抑えることである。
いくつかの実施形態では、ヘテロ二量体分子は、「ノブ鎖」のCH3ドメインにT366W変異を、「ホール鎖」のCH3ドメインにT366S、L368A、Y407V変異を含有する。場合によっては、CH3ドメイン間の追加の鎖間ジスルフィド架橋も、例えば「ノブ」または「ホール」鎖のCH3ドメインにY349C変異、及び他方の鎖のCH3ドメインにE356C変異またはS354C変異を導入することによって、使用することができる(Merchant,A.M.,et al.,Nature Biotech.16(1998)677−681)。いくつかの実施形態では、ヘテロ二量体分子は、2つのCH3ドメインのうちの1つにS354C、T366W変異を、2つのCH3ドメインのうちの他方にY349C、T366S、L368A、Y407V変異を含有する。いくつかの実施形態では、ヘテロ二量体分子は、2つのCH3ドメインのうちの1つにE356C、T366W変異を、2つのCH3ドメインのうちの他方にY349C、T366S、L368A、Y407V変異を含む。いくつかの実施形態では、ヘテロ二量体分子は、2つのCH3ドメインのうちの1つにY349C、T366W変異を、2つのCH3ドメインのうちの他方にE356C、T366S、L368A、Y407V変異を含む。いくつかの実施形態では、ヘテロ二量体分子は、2つのCH3ドメインのうちの1つにY349C、T366W変異を、2つのCH3ドメインのうちの他方にS354C、T366S、L368A、Y407V変異を含む。他のノブ・イン・ホール技術の例は、例えば欧州特許第1870459A1に記載されるように、当技術分野において公知である。
いくつかの実施形態では、ヘテロ二量体分子のFc領域はさらに、上記のいずれかのような1つまたは複数の他のFc変異を含有することができる。いくつかの実施形態では、ヘテロ二量体分子は、エフェクター機能を低下させる変異を有するFc領域を含有する。
いくつかの実施形態では、CH3突起(ノブ)または空洞(ホール)改変を含有するFcバリアントは、どこでも、ただし、典型的には、そのN末端またはC末端を介して、融合ポリペプチドを形成するなどのために、第1及び/または第2のスタック免疫調節ポリペプチドのN末端またはC末端にスタック免疫調節ポリペプチドに結合できる。連結は、直接的またはリンカーを介して間接的であり得る。典型的には、ノブ分子及びホール分子は、CH3突起改変(複数可)を含有するFcバリアントに連結された第1のスタック免疫調節ポリペプチドと、CH3空洞改変(複数可)を含有するFcバリアントに連結された第2のスタック免疫調節ポリペプチドとの共発現によって生成される。
本明細書では、バリアントCD80ポリペプチドのIgSFドメイン、例えばIgVドメイン、及びバリアントCD155ポリペプチドの第2のIgSFドメイン、例えばIgVを含有するスタック免疫調節Fc融合ポリペプチドから産生されるホモ二量体マルチドメインスタック分子が提供される。いくつかの実施形態では、得られたマルチドメインスタック分子は、CTLA−4及びTIGITの両方に結合する。いくつかの態様では、TIGITへの結合は、非改変または野生型CD155の対応するIgSFドメインのTIGITへの結合と比較して、同程度または類似の程度、または、場合によっては、増加する。いくつかの態様では、CTLA−4への結合は、非改変または野生型CD80の対応するIgSFドメインのCTLA−4への結合と比較して、同程度または類似の程度、または、場合によっては、増加する。いくつかの実施形態では、TIGITまたはCTLA−4への結合は、非スタック形態のバリアントCD80 IgSF−FcのTIGITまたはCTLA−4への結合の少なくとも30%、40%、50%、60%、70%、80%、90%、またはそれ以上である。いくつかの実施形態では、TIGITへの結合は、非スタック形態のバリアントCD155 IgSF−FcのTIGITへの結合の少なくとも30%、40%、50%、60%、70%、80%、90%、またはそれ以上である。いくつかの実施形態では、得られたマルチドメインスタック分子は、レポーターアッセイで測定されるように、非スタックバリアントCD80 IgSF−Fc及び/またはバリアントCD155−IgSF−Fcと比較して、T細胞免疫応答を増加させる。いくつかの実施形態では、増加は、1.2倍、1.3倍、1.4倍、1.5倍、2.0倍、3.0倍、4.0倍、5.0倍、またはそれ以上より大きい。
本明細書では、バリアントCD80ポリペプチドのIgSFドメイン、例えばIgVドメイン、及びバリアントCD112ポリペプチドの第2のIgSFドメイン、例えばIgVを含有するスタック免疫調節Fc融合ポリペプチドから産生されるホモ二量体マルチドメインスタック分子が提供される。いくつかの実施形態では、得られたマルチドメインスタック分子は、CTLA−4及びCD112Rの両方に結合する。いくつかの態様では、CD112Rへの結合は、非改変または野生型CD112の対応するIgSFドメインのCD112Rへの結合と比較して、同程度または類似の程度、または、場合によっては、増加する。いくつかの態様では、CTLA−4への結合は、非改変または野生型CD80の対応するIgSFドメインのCTLA−4への結合と比較して、同程度または類似の程度、または、場合によっては、増加する。いくつかの実施形態では、CD112RまたはCTLA−4への結合は、非スタック形態のバリアントCD80 IgSF−FcのCD112RまたはCTLA−4への結合の少なくとも30%、40%、50%、60%、70%、80%、90%、またはそれ以上である。いくつかの実施形態では、CD112Rへの結合は、非スタック形態のバリアントCD112 IgSF−FcのCD112Rへの結合の少なくとも30%、40%、50%、60%、70%、80%、90%、またはそれ以上である。いくつかの実施形態では、得られたマルチドメインスタック分子は、レポーターアッセイで測定されるように、非スタックバリアントCD80 IgSF−Fc及び/またはバリアントCD112−IgSF−Fcと比較して、T細胞免疫応答を増加させる。いくつかの実施形態では、増加は、1.2倍、1.3倍、1.4倍、1.5倍、2.0倍、3.0倍、4.0倍、5.0倍、またはそれ以上より大きい。
本明細書では、バリアントCD80ポリペプチドのIgSFドメイン、例えばIgVドメイン、バリアントCD155またはCD112ポリペプチドの第2のIgSFドメイン、例えばIgV、及びバリアントPD−L1またはPD−L2ポリペプチドの第3のIgSFドメイン、例えばIgVを含有するスタック免疫調節Fc融合ポリペプチドから産生されるホモ二量体マルチドメインスタック分子が提供される。いくつかの実施形態では、得られたマルチドメインスタック分子は、CTLA−4、TIGIT、CD112R及びPD−1に結合する。いくつかの態様では、CTLA−4への結合は、非改変または野生型CD80の対応するIgSFドメインのCTLA−4への結合と比較して同程度または類似の程度である、または場合によっては増加する。いくつかの態様では、TIGITへの結合は、非改変または野生型CD155の対応するIgSFドメインのTIGITへの結合と比較して同程度または類似の程度である、または場合によっては増加する。いくつかの態様では、CD112Rへの結合は、非改変または野生型CD112の対応するIgSFドメインのCD112Rへの結合と比較して、同程度または類似の程度である、または場合によっては増加する。いくつかの態様では、PD−1への結合は、非改変または野生型PD−L1の対応するIgSFドメインのPD−1への結合と比較して、同程度または類似の程度、または、場合によっては、増加する。いくつかの態様では、PD−1への結合は、非改変または野生型PD−L2の対応するIgSFドメインのPD−1への結合と比較して、同程度または類似の程度、または、場合によっては、増加する。いくつかの実施形態では、CTLA−4への結合は、非スタック形態のバリアントCD80 IgSF−FcのCTLA−4への結合の少なくとも30%、40%、50%、60%、70%、80%、90%、またはそれ以上である。いくつかの実施形態では、TIGITまたはCD112Rへの結合は、非スタック形態のバリアントCD112 IgSF−FcのTIGITまたはCD112Rへの結合の少なくとも30%、40%、50%、60%、70%、80%、90%、またはそれ以上である。いくつかの実施形態では、TIGITへの結合は、非スタック形態のバリアントCD155 IgSF−FcのTIGITへの結合の少なくとも30%、40%、50%、60%、70%、80%、90%、またはそれ以上である。いくつかの実施形態では、PD−1への結合は、非スタック形態のバリアントPD−1 IgSF−FcのPD−1への結合の少なくとも30%、40%、50%、60%、70%、80%、90%、またはそれ以上である。いくつかの実施形態では、得られたマルチドメインスタック分子は、レポーターアッセイで測定されるように、非スタックバリアントCD80 IgSF−Fc、バリアントCD112 IgSF−Fc、バリアントCD155−IgSF−Fc、PD−L1−IgSF−Fc、及び/またはバリアントPD−L2−IgSF−Fcと比較して、T細胞免疫応答を増加させる。いくつかの実施形態では、増加は、1.2倍、1.3倍、1.4倍、1.5倍、2.0倍、3.0倍、4.0倍、5.0倍、またはそれ以上より大きい。
C.バリアントポリペプチドと免疫調節タンパク質のコンジュゲート及び融合体
いくつかの実施形態では、IgSFファミリーのIgドメイン(vIgD)のバリアントを含む免疫調節タンパク質である本明細書において提供されるバリアントポリペプチドは、部分、例えばエフェクター部分、例えば別のタンパク質と、直接的または間接的に、コンジュゲートまたは融合して、コンジュゲートを形成することができる(「IgSFコンジュゲート」)。いくつかの実施形態では、結合は、共有結合または非共有結合(例えば、ビオチン−ストレプトアビジン非共有結合性相互作用を介したもの)であることができる。CD80−Fcバリアント融合体のいくつかの実施形態では、任意の2つ以上の前述のコンジュゲートのいずれか1つまたは組み合わせを、FcまたはバリアントCD80ポリペプチドまたは両方に結合させることができる。
いくつかの実施形態では、部分は、ターゲティング部分、小分子薬物(500ダルトンモル質量未満の非ポリペプチド薬物)、毒素、細胞増殖抑制剤、細胞傷害剤、免疫抑制剤、診断目的に好適な放射性物質、治療目的の放射性金属イオン、プロドラッグ活性化酵素、生物学的半減期を延長させる物質、または診断用もしくは検出可能物質であることができる。
いくつかの実施形態では、エフェクター部分は、治療用物質、例えばがん治療用物質であり、細胞傷害性、細胞増殖抑制性であるか、またはさもなければいくらかの治療効果をもたらす。いくつかの実施形態では、エフェクター部分は、ターゲティング部分または物質、例えば、細胞表面抗原、例えば腫瘍細胞の表面上の抗原を標的とする物質である。いくつかの実施形態では、エフェクター部分は、検出可能シグナルを直接的または間接的のいずれかで生成することができる標識である。いくつかの実施形態では、エフェクター部分は、毒素である。いくつかの実施形態では、エフェクター部分は、タンパク質、ペプチド、核酸、小分子またはナノ粒子である。
いくつかの実施形態では、同一であっても異なっていてもよい1つ、2つ、3つ、4つ、5つ以上のエフェクター部分は、バリアントポリペプチドまたはタンパク質にコンジュゲート、連結、または融合してIgSFコンジュゲートを形成する。いくつかの実施形態では、そのようなエフェクター部分を、当技術分野において公知かつ以下に記載される様々な分子生物学的または化学的コンジュゲーション及び連結法を使用して、バリアントポリペプチドまたは免疫調節タンパク質に結合させることができる。いくつかの実施形態では、リンカー、例えばペプチドリンカー、切断可能リンカー、非切断可能リンカー、またはコンジュゲーション反応を助けるリンカーを使用して、エフェクター部分をバリアントポリペプチドまたは免疫調節タンパク質に連結するまたはコンジュゲートすることができる。
いくつかの実施形態では、IgSFコンジュゲートは、以下の成分、すなわち(タンパク質またはポリペプチド)、(L)q及び(エフェクター部分)mを含み、該タンパク質またはポリペプチドは、記載される1つまたは複数のコグネイトカウンター構造体リガンドと結合することができる記載のバリアントポリペプチドまたは免疫調節タンパク質のいずれかであり;Lは、タンパク質またはポリペプチドを部分に連結するためのリンカーであり;mは、少なくとも1であり;qは、0以上であり;得られたIgSFコンジュゲートは、1つまたは複数のカウンター構造体リガンドに結合する。特定の実施形態では、mは1〜4であり、qは0〜8である。
いくつかの実施形態では、細胞表面分子に結合するターゲティング物質とコンジュゲートされた本明細書において提供されるバリアントポリペプチドまたは免疫調節タンパク質を含むIgSFコンジュゲートであって、例えば、バリアントポリペプチドまたは免疫調節タンパク質を特定の細胞へターゲティング送達するための、IgSFコンジュゲートが提供される。いくつかの実施形態では、ターゲティング物質は、対象における正常な細胞/組織及び/または腫瘍細胞/腫瘍上に存在する分子を局在化してそれに結合する能力を有する分子(複数可)である。言い換えると、ターゲティング物質を含むIgSFコンジュゲートは、細胞、例えば腫瘍細胞上に存在するリガンドに結合(直接的または間接的に)することができる。使用が企図される本発明のターゲティング物質は、標的細胞または分子の成分と結合することができる、抗体、ポリペプチド、ペプチド、アプタマー、他のリガンド、またはそれらの任意の組み合わせを含む。
いくつかの実施形態では、ターゲティング物質は、対象への投与後に、腫瘍細胞(複数可)と結合するか、または腫瘍細胞(複数可)の近く(例えば、腫瘍血管系または腫瘍微小環境)に結合することができる。ターゲティング物質は、がん細胞の表面上の受容体またはリガンドに結合し得る。本発明の別の態様において、非がん性細胞または組織に特異的であるターゲティング物質が選択される。例えば、ターゲティング物質は、特定の細胞または組織上に通常存在する分子に特異的であることができる。さらに、いくつかの実施形態では、同じ分子が正常細胞及びがん細胞上に存在することができる。様々な細胞成分及び分子が公知である。例えば、ターゲティング物質がEGFRに特異的である場合、得られたIgSFコンジュゲートは、EGFRを発現するがん細胞もEGFRを発現する正常な皮膚上皮細胞も標的とすることができる。したがって、いくつかの実施形態では、本発明のIgSFコンジュゲートは、2つの別々の機序(がん細胞及び非がん細胞を標的とする)によって作用することができる。
本明細書に開示される本発明の種々の態様において、本発明のIgSFコンジュゲートは、細胞成分、例えば腫瘍抗原、細菌抗原、ウイルス抗原、マイコプラズマ抗原、真菌抗原、プリオン抗原、寄生生物由来の抗原と結合する/標的とすることができる、ターゲティング物質を含む。いくつかの態様では、細胞成分、抗原または分子は各々、ターゲティング物質の所望の標的を意味するために使用することができる。例えば、各種実施形態では、ターゲティング物質は、限定されないが、上皮成長因子受容体(EGFR、ErbB−1、HERl)、ErbB−2(HER2/neu)、ErbB−3/HER3、ErbB−4/HER4、EGFRリガンドファミリー;インスリン様成長因子受容体(IGFR)ファミリー、IGF結合タンパク質(IGFBP)、IGFRリガンドファミリー;血小板由来成長因子受容体(PDGFR)ファミリー、PDGFRリガンドファミリー;線維芽細胞成長因子受容体(FGFR)ファミリー、FGFRリガンドファミリー、血管内皮成長因子受容体(VEGFR)ファミリー、VEGFファミリー;HGF受容体ファミリー;TRK受容体ファミリー;エフリン(EPH)受容体ファミリー;AXL受容体ファミリー;白血球チロシンキナーゼ(LTK)受容体ファミリー;TIE受容体ファミリー、アンジオポエチン1,2;受容体チロシンキナーゼ様オーファン受容体(ROR)受容体ファミリー、例えば、ROR1;CD171(L1CAM);B7−H6(NCR3LG1);CD80、腫瘍グリコシル化抗原、例えば、sTnまたはTn、例えばMUC1のsTn Ag;LHR(LHCGR);ホスファチジルセリン、ジスコイジンドメイン受容体(DDR)ファミリー;RET受容体ファミリー;KLG受容体ファミリー;RYK受容体ファミリー;MuSK受容体ファミリー;トランスフォーミング成長因子−α(TGF−α)受容体、TGF−β;サイトカイン受容体、クラスI(ヘマトポエチンファミリー)及びクラスII(インターフェロン/IL−10ファミリー)受容体、腫瘍壊死因子(TNF)受容体スーパーファミリー(TNFRSF)、死受容体ファミリー;がん−精巣(CT)抗原、系列特異的抗原、分化抗原、α−アクチニン−4、ARTCl、切断点クラスタ領域−アベルソン(Abelson)(Bcr−abl)融合産物、B−RAF、カスパーゼ−5(CASP−5)、カスパーゼ−8(CASP−8)、β−カテニン(CTNNBl)、細胞分裂周期27(CDC27)、サイクリン依存性キナーゼ4(CDK4)、CDKN2A、COA−I、dek−can融合タンパク質、EFTUD−2、伸長因子2(ELF2)、Etsバリアント遺伝子6/急性骨髄性白血病1遺伝子ETS(ETC6−AML1)融合タンパク質、フィブロネクチン(FN)、例えば、フィブロネクチンのエクストラドメインA(EDA)、GPNMB、低密度脂質受容体/GDP−Lフコース:β−Dガラクトース2−α−Lフコシルトランスフェラーゼ(LDLR/FUT)融合タンパク質、HLA−A2.HLA−A2遺伝子におけるα2ドメインのαヘリックスの残基170におけるアルギニン−イソロイシン交換(HLA−A*201−R170I)、HLA−Al 1、熱ショックタンパク質70−2変異型(HSP70−2M)、K1AA0205、MART2、黒色腫遍在性変異型1、2、3(MUM−I、2、3)、前立腺酸性ホスファターゼ(PAP)、ネオ−PAP、ミオシンクラスI、NFYC、OGT、OS−9、pml−RARα融合タンパク質、PRDX5、PTPRK、K−ras(KRAS2)、N−ras(NRAS)、HRAS、RBAF600、SIRT2、SNRPDl、SYT−SSXlまたは−SSX2融合タンパク質、トリオースリン酸イソメラーゼ、BAGE、BAGK−1、BAGE−2,3,4,5、GAGE−1,2,3,4,5,6,7,8、GnT−V(異常なN−アセチルグルコサミニルトランスフェラーゼV、MGAT5)、HERV−K−MEL、KK−LC、KM−HN−I、LAGE、LAGE−I、黒色腫上のCTL認識抗原(CAMEL)、MAGE−Al(MAGE−I)、MAGE−A2、MAGE−A3、MAGE−A4、MAGE−A5、MAGE−A6、MAGE−A8、MAGE−A9、MAGE−AlO、MAGE−AI l、MAGE−A12、MAGE−3、MAGE−Bl、MAGE−B2、MAGE−B5、MAGE−B6、MAGE−Cl、MAGE−C2、ムチン1(MUCl)、MART−1/Melan−A(MLANA)、gplOO、gplOO/Pmell7(SILV)、チロシナーゼ(TYR)、TRP−I、HAGE、NA−88、NY−ESO−I、NY−ESO−l/LAGE−2、SAGE、Spl7、SSX−1,2,3,4、TRP2−INT2、がん胎児性抗原(CEA)、カリクレイン4、マンマグロビン−A、OAl、前立腺特異抗原(PSA)、TRP−1/gp75、TRP−2、アディポフィリン、黒色腫には存在しないインターフェロン誘導性タンパク質2(AIM−2)、BING−4、CPSF、サイクリンDl、上皮細胞接着分子(Ep−CAM)、EphA3、線維芽細胞成長因子−5(FGF−5)、糖タンパク質250(gp250)、EGFR(ERBBl)、HER−2/neu(ERBB2)、インターロイキン13受容体α2鎖(IL13Rα2)、IL−6受容体、腸カルボキシルエステラーゼ(iCE)、α−フェトタンパク質(AFP)、M−CSF、mdm−2、MUCl、p53(TP53)、PBF、PRAME、PSMA、RAGE−I、RNF43、RU2AS、SOXlO、STEAPl、サバイビン(BIRC5)、ヒトテロメラーゼ逆転写酵素(hTERT)、テロメラーゼ、ウィルムス腫瘍遺伝子(WTl)、SYCPl、BRDT、SPANX、XAGE、ADAM2、PAGE−5、LIPl、CTAGE−I、CSAGE、MMAl、CAGE、BORIS、HOM−TES−85、AF15ql4、HCA661、LDHC、MORC、SGY−I、SPOl 1、TPXl、NY−SAR−35、FTHL17、NXF2、TDRDl、TEX15、FATE、TPTE、免疫グロブリンイディオタイプ、ベンスジョーンズタンパク質、エストロゲン受容体(ER)、アンドロゲン受容体(AR)、CD40、CD30、CD20、CD19、CD33、がん抗原72−4(CA 72−4)、がん抗原15−3(CA 15−3)、がん抗原27−29(CA 27−29)、がん抗原125(CA 125)、がん抗原19−9(CA 19−9)、β−ヒト絨毛性ゴナドトロピン、β−2ミクログロブリン、扁平上皮がん抗原、神経特異的エノラーゼ、熱ショックタンパク質gp96、GM2、サルグラモスチム、CTLA−4、707アラニンプロリン(707−AP)、T細胞によって認識される腺がん抗原4(ART−4)、がん胎児性抗原ペプチド−1(CAP−I)、カルシウム活性化クロライドチャネル−2(CLCA2)、シクロフィリンB(Cyp−B)、ヒト印環腫瘍−2(HST−2)、ヒトパピローマウイルス(HPV)タンパク質(HPV−E6、HPV−E7、メジャーまたはマイナーカプシド抗原、他)、エプスタイン・バール・ウイルス(EBV)タンパク質(EBV潜伏膜タンパク質−LMPl、LMP2;他)、BまたはC型肝炎ウイルスタンパク質、ならびにHIVタンパク質を含む成分に特異的であるかまたはそれに結合する。
いくつかの実施形態では、IgSFコンジュゲートは、そのターゲティング物質により、腫瘍細胞、腫瘍血管系または腫瘍微小環境の細胞成分と結合し、それにより免疫応答の調節(例えば、共刺激分子の活性化または免疫細胞活性化の負の調節分子の阻害による)、生存シグナルの阻害(例えば、成長因子またはサイトカインまたはホルモン受容体拮抗物質)、死シグナルの活性化、及び/または免疫媒介性細胞傷害性(例えば、抗体依存性細胞傷害性による)を介して、標的とした細胞の殺傷を促進する。このようなIgSFコンジュゲートは、例えばIgSFコンジュゲートの受容体媒介性エンドサイトーシスにより、例えば、コンジュゲートされたエフェクター部分の腫瘍標的への送達を促すなど、腫瘍細胞を抑制、低減または排除するようにいくつかの機序によって機能することができる;または、そのようなコンジュゲートは、免疫細胞(例えば、NK細胞、単球/マクロファージ、樹状細胞、T細胞、B細胞)を動員、それと結合、及び/またはそれを活性化することができる。さらに、場合によっては、前述の経路の1つまたは複数が、本発明の1つまたは複数のIgSFコンジュゲートの投与によって作用し得る。
いくつかの実施形態では、IgSFコンジュゲートは、そのターゲティング物質により、腫瘍細胞、腫瘍血管系または腫瘍微小環境の細胞成分に局在化、例えば結合し、これにより腫瘍の近くで免疫応答の細胞を調節する。いくつかの実施形態では、ターゲティング物質は、コンジュゲートされたIgSF(例えば、vIgD)の腫瘍標的への送達を促し、例えばそのコグネイト結合パートナーと相互作用して、コグネイト結合パートナーを保有する免疫細胞(例えば、NK細胞、単球/マクロファージ、樹状細胞、T細胞、B細胞)のシグナル伝達を変化させる。いくつかの実施形態では、局在化送達は、CTLA−4阻害性受容体の拮抗作用または遮断作用を媒介する。いくつかの実施形態では、局在化送達は、CTLA−4阻害性受容体を作動させ、これは場合により、活性化受容体のクラスタリングが近接する場合に起こる可能性がある。
いくつかの実施形態では、ターゲティング物質は、免疫グロブリンである。本明細書において使用される場合、「免疫グロブリン」という用語は、限定されないが、ポリクローナル、モノクローナル、多重特異性、ヒト、ヒト化またはキメラ抗体、単鎖抗体、Fab断片、F(ab’)断片、Fab発現ライブラリーによって産生される断片、単鎖Fv(scFv);抗イディオタイプ(抗Id)抗体(例えば、本発明の抗体に対する抗Id抗体を含む)、及び上のいずれかのエピトープ結合断片を含む、天然または人工の一価または多価抗体を含む。「抗体」という用語は、本明細書において使用される場合、免疫グロブリン分子及び免疫グロブリン分子の免疫学的に活性な部分、例えば、抗原と免疫特異的に結合する抗原結合部位を含有する分子を指す。本発明の免疫グロブリン分子は、任意のタイプ(例えば、IgG、IgE、IgM、IgD、IgA、及びIgY)、クラス(例えば、IgG1、IgG2、IgG3、IgG4、IgA1、及びIgA2)またはサブクラスの免疫グロブリン分子であることができる。
いくつかの実施形態では、IgSFコンジュゲートは、その抗体ターゲティング部分により、腫瘍細胞、腫瘍血管系または腫瘍微小環境の細胞成分と結合し、それにより免疫応答の調節(例えば、共刺激分子の活性化または免疫細胞活性化の負の調節分子の阻害による)、生存シグナルの阻害(例えば、成長因子またはサイトカインまたはホルモン受容体拮抗物質)、死シグナルの活性化、及び/または免疫媒介性細胞傷害性(例えば、抗体依存性細胞傷害性による)を介して、標的とした細胞のアポ卜ーシスを促進する。このようなIgSFコンジュゲートは、例えばIgSFコンジュゲートの受容体媒介性エンドサイトーシスにより、例えば、コンジュゲートされたエフェクター部分の腫瘍標的への送達を促すなど、腫瘍細胞を抑制、低減または排除するようにいくつかの機序によって機能することができる;または、そのようなコンジュゲートは、免疫細胞(例えば、NK細胞、単球/マクロファージ、樹状細胞、T細胞、B細胞)を動員、それと結合、及び/またはそれを活性化することができる。
いくつかの実施形態では、IgSFコンジュゲートは、その抗体ターゲティング部分により、腫瘍細胞、腫瘍血管系または腫瘍微小環境の細胞成分と結合し、それにより免疫応答を調節する(例えば、共刺激分子の活性化または免疫細胞活性化の負の調節分子の阻害による)。いくつかの実施形態では、そのようなコンジュゲートは、免疫細胞(例えば、NK細胞、単球/マクロファージ、樹状細胞、T細胞、B細胞)を認識し、それと結合し、及び/またそれを調節(例えば、阻害または活性化)することができる。
本発明の抗体ターゲティング部分は、限定されないが、Fab、Fab’及びF(ab’)2、Fd、単鎖Fv(scFv)、単鎖抗体、ジスルフィド連結されたFv(sdFv)ならびにVLまたはVHドメインのいずれかを含む断片を含む抗体断片を含む。単鎖抗体を含む抗原結合抗体断片は、可変領域(複数可)を、単独でまたは以下:ヒンジ領域、CH1、CH2、及びCH3ドメインの全体もしくは一部分と組み合わせて含み得る。また、可変領域(複数可)とヒンジ領域、CH1、CH2、及びCH3ドメインの任意の組み合わせをまた含む抗原結合断片も本発明に含まれる。また、Fc断片、抗原−Fc融合タンパク質、及びFc−ターゲティング部分コンジュゲートまたは融合産物(Fc−ペプチド、Fc−アプタマー)も本発明に含まれる。本発明の抗体ターゲティング部分は、鳥類及び哺乳動物を含む任意の動物起源由来であり得る。一態様では、抗体ターゲティング部分は、ヒト、ネズミ(例えば、マウス及びラット)、ロバ、ヒツジ、ウサギ、ヤギ、モルモット、ラクダ、ウマ、またはニワトリである。さらに、そのような抗体は、動物抗体のヒト化バージョンであってもよい。本発明の抗体ターゲティング部分は、単一特異性、二重特異性、三重特異性であっても、より高次の多重特異性のものであってもよい。
各種実施形態では、抗体/ターゲティング部分は、免疫細胞(例えば、NK細胞、単球/マクロファージ、樹状細胞)を、Fc(抗体内)とFc受容体(免疫細胞上)との間の相互作用を介して及び本明細書において提供されるコンジュゲートされたバリアントポリペプチドまたは免疫調節タンパク質を介して、動員、結合、及び/または活性化する。いくつかの実施形態では、抗体/ターゲティング部分は、本明細書において提供されるコンジュゲートされたバリアントポリペプチドまたは免疫調節タンパク質を介して、腫瘍物質を認識するまたはそれと結合して、それを腫瘍細胞に局在化し、腫瘍の近くで免疫細胞の調節を促す。
IgSFコンジュゲートに組み込むことができる抗体の例は、限定されないが、抗体、例えばセツキシマブ(IMC−C225;Erbitux(登録商標))、トラスツズマブ(Herceptin(登録商標))、リツキシマブ(Rituxan(登録商標);MabThera(登録商標))、ベバシズマブ(Avastin(登録商標))、アレムツズマブ(Campath(登録商標);Campath−1H(登録商標);Mabcampath(登録商標))、パニツムマブ(ABX−EGF;Vectibix(登録商標))、ラニビズマブ(Lucentis(登録商標))、イブリツモマブ、イブリツモマブチウキセタン(Zevalin(登録商標))、トシツモマブ、ヨウ素I 131トシツモマブ(BEXXAR(登録商標))、カツマキソマブ(Removab(登録商標))、ゲムツズマブ、ゲムツズマブオゾガマイシン(Mylotarg(登録商標))、アバタセプト(CTLA4−Ig;Orencia(登録商標))、ベラタセプト(L104EA29YIg;LEA29Y;LEA)、イピリムマブ(MDX−010;MDX−101)、トレメリムマブ(チシリムマブ;CP−675,206)、PRS−010、PRS−050、アフリベルセプト(VEGF Trap、AVE005)、ボロシキシマブ(M200)、F200、MORAb−009、SS1P(CAT−5001)、シクスツムマブ(IMC−A12)、マツズマブ(EMD72000)、ニモツズマブ(h−R3)、ザルツムマブ(HuMax−EGFR)、ネシツムマブIMC−11F8、mAb806/ch806、Sym004、mAb−425、Panorex@(17−1A)(ネズミモノクローナル抗体);Panorex@(17−1A)(キメラネズミモノクローナル抗体);IDEC−Y2B8(ネズミ、抗CD2O MAb);BEC2(抗イディオタイプMAb、GDエピトープを模倣)(BCGを含む);Oncolym(Lym−1モノクローナル抗体);SMART MI95 Ab、ヒト化13’I LYM−I(Oncolym)、Ovarex(B43.13、抗イディオタイプマウスMAb);MDX−210(ヒト化抗HER−2二重特異性抗体);腺がん上のEGP40(17−1A)汎がん腫(pancarcinoma)抗原に結合する3622W94 Mab;抗VEGF、Zenapax(SMART抗Tac(IL−2受容体);SMART MI95 Ab、ヒト化Ab、ヒト化);MDX−210(ヒト化抗HER−2二重特異性抗体);MDX−447(ヒト化抗EGF受容体二重特異性抗体);NovoMAb−G2(汎がん腫特異的Ab);TNT(ヒストン抗原に対するキメラMAb);TNT(ヒストン抗原に対するキメラMAb);Gliomab−H(Monoclon s−ヒト化Ab);GNI−250 Mab;EMD−72000(キメラ−EGF拮抗物質);LymphoCide(ヒト化LL2抗体);及びMDX−260二重特異性、標的GD−2、ANA Ab、SMART IDlO Ab、SMART ABL 364 AbまたはImmuRAIT−CEAを含む。前述のリストに例示されるとおり、特定の標的エピトープに対する抗体を作製することは慣用的である。
いくつかの実施形態では、抗体ターゲティング部分は、Fcドメインを含有する、完全長抗体またはその抗原結合断片である。いくつかの実施形態では、バリアントポリペプチドまたは免疫調節タンパク質は、例えば抗体のFc部分のN末端へのコンジュゲーションによって、抗体ターゲティング部分のFc部分にコンジュゲートされる。
いくつかの実施形態では、vIgDは、直接的または間接的に、抗体の軽鎖及び/または重鎖のN末端またはC末端に連結されている。いくつかの実施形態では、連結は、ペプチドリンカー、例えば上記のいずれかを介した連結であることができる。様々な配置を構築することができる。図8A〜8Cは、例示的な配置を示す。いくつかの実施形態では、抗体コンジュゲートを、細胞において抗体の重鎖及び軽鎖の共発現によって産生することができる。
本発明の一態様では、ターゲティング物質は、アプタマー分子である。例えば、いくつかの実施形態では、アプタマーは、ターゲティング物質として機能する核酸からなる。様々な実施形態では、本発明のIgSFコンジュゲートは、腫瘍細胞、腫瘍血管系、及び/または腫瘍微小環境上の分子に特異的なアプタマーを含む。いくつかの実施形態では、アプタマーはそれ自体が、ターゲティングモジュール(配列)に加えて、生物学的に活性な配列を含むことができ、該生物学的に活性な配列は、標的細胞に対する免疫応答を誘導することができる。言い換えれば、そのようなアプタマー分子は、二重使用物質である。いくつかの実施形態では、本発明のIgSFコンジュゲートは、アプタマーの抗体へのコンジュゲーションを含み、該アプタマー及び抗体は、腫瘍細胞、腫瘍血管系、腫瘍微小環境、及び/または免疫細胞上の別々の分子への結合に特異的である。
「アプタマー」という用語は、特定の分子への特異的結合特性に基づいて選択された、DNA、RNAまたはペプチドを含む。例えば、本明細書に開示されるとおりの腫瘍細胞、腫瘍血管系、腫瘍微小環境、及び/または免疫細胞内の特定の遺伝子または遺伝子産物と結合するように、アプタマー(複数可)を選択することができ、この場合、選択は、当技術分野において公知及び当業者によく知られている方法によってなされる。
本発明のいくつかの態様では、ターゲティング物質はペプチドである。例えば、本明細書において提供されるバリアントポリペプチドまたは免疫調節タンパク質は、がんまたは腫瘍細胞の成分と結合することができるペプチドにコンジュゲートすることができる。したがって、本発明のそのようなIgSFコンジュゲートは、腫瘍細胞、腫瘍血管系の細胞成分、及び/または腫瘍微小環境の成分に結合するペプチドターゲティング物質を含む。いくつかの実施形態では、ターゲティング物質ペプチドは、インテグリンの拮抗物質または作動物質であることができる。α及びβサブユニットを含むインテグリンは、当業者に周知の多数のタイプを含む。
一実施形態では、ターゲティング物質はVvβ3である。インテグリンVvβ3は、多種多様な細胞上に発現され、骨マトリックスへの破骨細胞の接着、血管平滑筋細胞の遊走、及び血管新生を含むいくつかの生物学的に関連するプロセスを媒介することが示されている。インテグリンに対する好適なターゲティング分子は、他のインテグリン、例えばV4.βi(VLA−4)、V4−P7(例えば、米国特許第6,365,619号;Chang et al,Bioorganic&Medicinal Chem Lett,12:159−163(2002);Lin et al.,Bioorganic&Medicinal Chem Lett,12:133−136(2002)を参照のこと)などに対する、RGDペプチドまたはペプチドミメティック及び非RGDペプチドまたはペプチドミメティック(例えば、米国特許第5,767,071号及び第5,780,426号を参照のこと)を含む。
いくつかの実施形態では、治療用物質とコンジュゲートした本明細書において提供されるバリアントポリペプチドまたは免疫調節タンパク質を含むIgSFコンジュゲートが提供される。いくつかの実施形態では、治療用物質は、例えば、ダウノマイシン、ドキソルビシン、メトトレキサート、及びビンデシンを含む(Rowland et al.,Cancer Immunol.Immunother.21:183−187,1986)。いくつかの実施形態では、治療用物質は、細胞内活性を有する。いくつかの実施形態では、IgSFコンジュゲートは内在化され、治療用物質は、細胞のタンパク質合成を遮断し、その中で細胞死を導く細胞毒素である。いくつかの実施形態では、治療用物質は、例えば、ゲロニン、ボウガニン、サポリン、リシン、リシンA鎖、ブリオジン、ジフテリア毒素、レストリクトシン(restrictocin)、Pseudomonas外毒素A及びそのバリアントを含む、リボソーム不活性化活性を有するポリペプチドを含む細胞毒素である。いくつかの実施形態では、治療用物質がリボソーム不活性化活性を有するポリペプチドを含む細胞毒素である場合、タンパク質が細胞に対して細胞傷害性となるために、IgSFコンジュゲートは標的細胞に結合したときに内在化されなければならない。
いくつかの実施形態では、毒素とコンジュゲートした本明細書において提供されるバリアントポリペプチドまたは免疫調節タンパク質を含むIgSFコンジュゲートが提供される。いくつかの実施形態では、毒素は、例えば、細菌毒素、例えばジフテリア毒素、植物毒素、例えばリシン、小分子毒素、例えばゲルダナマイシン(Mandler et al.,J.Nat.Cancer Inst.92(19):1573−1581(2000);Mandler et al.,Bioorganic&Med.Chem.Letters 10:1025−1028(2000);Mandler et al.,Bioconjugate Chem.13:786−791(2002))、メイタンシノイド(欧州特許第1391213号;Liu et al.,Proc.Natl.Acad.Sci.USA 93:8618−8623(1996))、及びカリケアミシン(Lode et al.,Cancer Res.58:2928(1998);Hinman et al.,Cancer Res.53:3336−3342(1993))を含む。毒素は、チューブリン結合、DNA結合、またはトポイソメラーゼ阻害を含む機序によって、それらの細胞傷害性及び細胞増殖阻害効果を発揮し得る。
いくつかの実施形態では、間接的または直接的に検出可能なシグナルを生成できる標識とコンジュゲートした本明細書において提供されるバリアントポリペプチドまたは免疫調節タンパク質を含むIgSFコンジュゲートが提供される。これらのIgSFコンジュゲートを、研究または診断用途に、例えばがんのin vivo検出に使用することができる。標識は、好ましくは、直接的または間接的のいずれかで、検出可能シグナルを産生することができる。例えば、標識は、放射線不透過性または放射性同位体、例えば3H、14C、32P、35S、123I、125I、131I;蛍光(フルオロフォア)もしくは化学発光(クロモフォア)化合物、例えばフルオレセインイソチオシアナート、ローダミンもしくはルシフェリン;酵素、例えばアルカリホスファターゼ、β−ガラクトシダーゼもしくは西洋ワサビペルオキシダーゼ;イメージング剤;または金属イオンであり得る。いくつかの実施形態では、標識は、シンチグラフィー研究用の放射性原子、例えば99Tcもしくは123I、または核磁気共鳴(NMR)イメージング(磁気共鳴イメージング、MRIとしても公知)用のスピン標識、例えばジルコニウム−89、ヨウ素−123、ヨウ素−131、インジウム−111、フッ素−19、炭素−13、窒素−15、酸素−17、ガドリニウム、マンガンもしくは鉄である。ジルコニウム−89を、例えばPETイメージング用に、様々な金属キレート剤に錯体化して抗体にコンジュゲートしてよい(WO2011/056983)。いくつかの実施形態では、IgSFコンジュゲートは、間接的に検出可能である。例えば、IgSFコンジュゲートに特異的でかつ検出可能標識を含有する二次抗体を使用して、IgSFコンジュゲートを検出することができる。
IgSFコンジュゲートを、当技術分野において公知の任意の方法を使用して調製してよい。例えば、WO2009/067800、WO2011/133886、及び米国特許出願公開第2014322129号(その全体が本明細書に参照により組み込まれる)を参照のこと。
IgSFコンジュゲートのバリアントポリペプチドまたは免疫調節タンパク質は、バリアントポリペプチドまたは免疫調節タンパク質がエフェクター部分と会合またはそれに連結できる任意の手段によって、エフェクター部分に「結合」され得る。例えば、IgSFコンジュゲートのバリアントポリペプチドまたは免疫調節タンパク質は、化学的または組換え手段によって、エフェクター部分に結合され得る。融合体またはコンジュゲートを調製するための化学的手段は、当技術分野において公知であり、これを使用してIgSFコンジュゲートを調製することができる。バリアントポリペプチドまたは免疫調節タンパク質とエフェクター部分をコンジュゲートするために使用される方法は、バリアントポリペプチドまたは免疫調節タンパク質のそれらの1つまたは複数のカウンター構造体リガンドに結合する能力に干渉することなく、バリアントポリペプチドまたは免疫調節タンパク質とエフェクター部分とを接続できなければならない。
IgSFコンジュゲートのバリアントポリペプチドまたは免疫調節タンパク質は、エフェクター部分に間接的に連結してよい。例えば、IgSFコンジュゲートのバリアントポリペプチドまたは免疫調節タンパク質は、数種類のうちの1種のエフェクター部分を含有するリポソームに直接連結してよい。エフェクター部分(複数可)及び/またはバリアントポリペプチドまたは免疫調節タンパク質は、固体表面に結合させてもよい。
いくつかの実施形態では、IgSFコンジュゲートのバリアントポリペプチドまたは免疫調節タンパク質とエフェクター部分は共にタンパク質であり、当技術分野において周知の技術を使用してこれらをコンジュゲートすることができる。2つのタンパク質をコンジュゲートできる利用可能な数百のクロスリンカーがある。(例えば、”Chemistry of Protein Conjugation and Crosslinking,”1991,Shans Wong,CRC Press,Ann Arborを参照のこと)。クロスリンカーは、一般的に、バリアントポリペプチドもしくは免疫調節タンパク質及び/またはエフェクター部分上で利用可能であるかまたはそこに挿入される反応性官能基に基づいて選択される。加えて、反応性基がない場合、光活性化可能クロスリンカーを使用することができる。場合によっては、バリアントポリペプチドまたは免疫調節タンパク質とエフェクター部分との間にスペーサーを含むことが望ましい場合がある。当技術分野に公知の架橋剤は、ホモ二官能性物質:グルタルアルデヒド、ジメチルアジピミデート及びビス(ジアゾベンジジン)、ならびにヘテロ二官能性物質:mマレイミドベンゾイル−N−ヒドロキシスクシンイミド及びスルホ−mマレイミドベンゾイル−N−ヒドロキシスクシンイミドを含む。
いくつかの実施形態では、IgSFコンジュゲートのバリアントポリペプチドまたは免疫調節タンパク質は、エフェクター部分の化学的結合のために特定の残基で操作してよい。当技術分野に公知の分子の化学的結合に使用される特定の残基は、リジン及びシステインを含む。クロスリンカーは、バリアントポリペプチドまたは免疫調節タンパク質上に挿入される及びエフェクター部分上で利用可能な反応性官能基に基づいて選択される。
IgSFコンジュゲートをまた、組換えDNA技術を使用して調製してもよい。そのような場合、バリアントポリペプチドまたは免疫調節タンパク質をコードするDNA配列を、エフェクター部分をコードするDNA配列に融合させることで、キメラDNA分子が得られる。キメラDNA配列は、融合タンパク質を発現する宿主細胞にトランスフェクトされる。細胞培養物から融合タンパク質を回収し、当技術分野において公知の技術を使用して精製することができる。
標識であるエフェクター部分をバリアントポリペプチドまたは免疫調節タンパク質に結合させる例は、Hunter,et al.,Nature 144:945(1962);David,et al.,Biochemistry 13:1014(1974);Pain,et al.,J.Immunol.Meth.40:219(1981);Nygren,J.Histochem.and Cytochem.30:407(1982);Wensel and Meares,Radioimmunoimaging And Radioimmunotherapy,Elsevier,N.Y.(1983);及びColcher et al.,“Use Of Monoclonal Antibodies As Radiopharmaceuticals For The Localization Of Human Carcinoma Xenografts In Athymic Mice”,Meth.Enzymol.,121:802−16(1986)に記載されている方法を含む。
放射性標識または他の標識を公知の方法でコンジュゲートに組み込んでよい。例えば、ペプチドを、生合成しても、例えば水素の代わりにフッ素−19を含む好適なアミノ酸前駆体を使用する化学アミノ酸合成によって合成してもよい。99Tcまたは123I、186Re、188Re及び111Inのような標識を、ペプチド内のシステイン残基を介して結合させることができる。イットリウム−90を、リジン残基を介して結合させることができる。IODOGEN法(Fraker et al.,Biochem.Biophys.Res.Commun.80:49−57(1978))を使用してヨウ素−123を組み込むことができる。“Monoclonal Antibodies in Immunoscintigraphy”(Chatal,CRC Press 1989)は、他の方法を詳細に記載している。
バリアントポリペプチドまたは免疫調節タンパク質と細胞傷害性物質のコンジュゲートを、多種多様な二官能性タンパク質カップリング剤、例えばN−スクシンイミジル−3−(2−ピリジルジチオ)プロピオナート(SPDP)、スクシンイミジル−4−(N−マレイミドメチル)シクロヘキサン−1−カルボキラート(SMCC)、イミノチオラン(IT)、イミドエステルの二官能性誘導体(例えば、アジプイミド酸ジメチルHCI)、活性エステル(例えば、スベリン酸ジスクシンイミジル)、アルデヒド(例えば、グルタルアルデヒド)、ビス−アジド化合物(例えば、ビス(p−アジドベンゾイル)ヘキサンジアミン)、ビス−ジアゾニウム誘導体(例えば、ビス−(p−ジアゾニウムベンゾイル)−エチレンジアミン)、ジイソシアナート(例えば、トルエン2,6−ジイソシアナート)、及びビス活性フッ素化合物(例えば、1,5−ジフルオロ−2,4−ジニトロベンゼン)を使用して作製してよい。例えば、Vitetta et al.,Science 238:1098(1987)に記載のとおりリシン免疫毒素を調製することができる。炭素−14で標識された1−p−イソチオシアナトベンジル−3−メチルジエチレントリアミン五酢酸(MX−DTPA)は、放射性ヌクレオチドの抗体へのコンジュゲーションのための例示的なキレート剤である。例えば、WO94/11026を参照のこと。リンカーは、細胞中での細胞傷害性薬物の放出を容易にする「切断可能リンカー」であり得る。例えば、酸に不安定なリンカー、ペプチダーゼ感受性リンカー、光分解性リンカー、ジメチルリンカーまたはジスルフィド含有リンカー(Chari et al.,Cancer Research 52:127−131(1992);米国特許第5,208,020号)を使用してよい。
本発明のIgSFコンジュゲートは、限定されないが、クロスリンカー試薬:市販(例えば、Pierce Biotechnology,Inc.,Rockford,IL,U.S.Aから)のBMPS、EMCS、GMBS、HBVS、LC−SMCC、MBS、MPBH、SBAP、SIA、SIAB、SMCC、SMPB、SMPH、スルホ−EMCS、スルホ−GMBS、スルホ−KMUS、スルホ−MBS、スルホ−SIAB、スルホ−SMCC、及びスルホ−SMPB、及びSVSB(スクシンイミジル−(4−ビニルスルホン)ベンゾアート)によって調製された薬物コンジュゲートを明示的に企図する。2003−2004 Applications Handbook and Catalogの467〜498頁を参照されたい。
D.膜貫通型及び分泌可能な免疫調節タンパク質ならびに操作された細胞
免疫調節バリアントCD80ポリペプチドを発現する操作された細胞(あるいは、「操作された細胞」)が本明細書において提供される。いくつかの実施形態では、発現する免疫調節バリアントCD80ポリペプチドは、膜貫通型タンパク質であり、かつ表面に発現する。いくつかの実施形態では、発現する免疫調節バリアントCD80ポリペプチドは発現して、細胞から分泌される。
1.膜貫通型免疫調節タンパク質
いくつかの実施形態では、バリアントCD80を含む免疫調節ポリペプチドは、膜結合タンパク質であることができる。以下でより詳細に記載のとおり、免疫調節ポリペプチドは、少なくとも1つの親和性改変IgSFドメイン(IgVまたはIgC)を含有するエクトドメイン、膜貫通ドメイン、及び任意で、細胞質ドメインを含有する、バリアントCD80を含む膜貫通型免疫調節ポリペプチドであることができる。いくつかの実施形態では、膜貫通型免疫調節タンパク質は、リンパ球(例えば、T細胞またはNK細胞)または抗原提示細胞の表面を含む、免疫細胞、例えば哺乳動物細胞の表面上に発現され得る。いくつかの実施形態では、膜貫通型免疫調節タンパク質は、ヘルパーT細胞、細胞傷害性T細胞(あるいは、細胞傷害性Tリンパ球またはCTL)、ナチュラルキラーT細胞、制御性T細胞、メモリーT細胞、またはγδT細胞のようなT細胞を含む、哺乳動物T細胞の表面上に発現する。いくつかの実施形態では、哺乳動物細胞は、抗原提示細胞(APC)である。典型的には、しかし限定するものではないが、エクトドメイン(あるいは、「細胞外ドメイン」)は、本発明のバリアントCD80の1つまたは複数のアミノ酸改変(例えば、アミノ酸置換)を含む。したがって、例えば、いくつかの実施形態では、膜貫通型タンパク質は、本発明のバリアントCD80の1つまたは複数のアミノ酸置換を含むエクトドメインを含む。
いくつかの実施形態では、操作された細胞は、膜貫通型タンパク質のような膜タンパク質であることができる膜貫通型免疫調節ポリペプチド(TIP)であるバリアントCD80ポリペプチドを発現する。典型的な実施形態では、膜タンパク質のエクトドメインは、記載される少なくとも1つのIgSFドメインに1つまたは複数のアミノ酸置換を含有する、本明細書において提供されるバリアントCD80の細胞外ドメインまたはそのIgSFドメインを含む。本明細書において提供される膜貫通型免疫調節タンパク質は、エクトドメインに連結された膜貫通ドメインをさらに含有する。いくつかの実施形態では、膜貫通ドメインは、細胞上の細胞表面発現のためにコードされたタンパク質をもたらす。いくつかの実施形態では、膜貫通ドメインは、エクトドメインに直接連結されている。いくつかの実施形態では、膜貫通ドメインは、1つまたは複数のリンカーまたはスペーサーを介して、エクトドメインに間接的に連結されている。いくつかの実施形態では、膜貫通ドメインは、主に疎水性アミノ酸残基、例えばロイシン及びバリンを含有する。
いくつかの実施形態では、完全長膜貫通アンカードメインを使用して、確実にTIPが操作された細胞、例えば操作されたT細胞の表面上に発現するようにすることができる。好都合なことに、これは、親和性が改変されている特定の天然タンパク質(例えば、CD80または他の天然IgSFタンパク質)由来であることもでき、天然IgSFタンパク質(例えば、CD80)と同じ様式で第1の膜近位ドメインの配列に簡単に融合させることもできる。いくつかの実施形態では、膜貫通型免疫調節タンパク質は、対応する野生型または非改変IgSFメンバーの膜貫通ドメイン、例えば、SEQ ID NO:1に記載のアミノ酸配列に含有される膜貫通ドメイン(表3)を含む。いくつかの実施形態では、膜結合形態は、例えばSEQ ID NO:1の残基243〜263に対応する、対応する野生型または非改変ポリペプチドの膜貫通ドメインを含む。
いくつかの実施形態では、膜貫通ドメインは、天然CD80の膜貫通ドメインではない非天然膜貫通ドメインである。いくつかの実施形態では、膜貫通ドメインは、膜結合タンパク質であるかまたは膜貫通型タンパク質である別の非CD80ファミリーメンバーポリペプチド由来の膜貫通ドメインに由来する。いくつかの実施形態では、T細胞上の別のタンパク質由来の膜貫通アンカードメインを使用することができる。いくつかの実施形態では、膜貫通ドメインは、CD8に由来する。いくつかの実施形態では、膜貫通ドメインは、スペーサードメインとして機能するCD8の細胞外部分をさらに含有することができる。例示的なCD8由来膜貫通ドメインは、SEQ ID NO:332、364もしくは1997に記載される、またはCD8膜貫通ドメインを含有するその一部分である。いくつかの実施形態では、膜貫通ドメインは、合成膜貫通ドメインである。
いくつかの実施形態では、膜貫通型免疫調節タンパク質は、膜貫通ドメインに連結されたエンドドメイン、例えば細胞質シグナル伝達ドメインをさらに含有する。いくつかの実施形態では、細胞質シグナル伝達ドメインは、細胞シグナル伝達を誘導する。いくつかの実施形態では、膜貫通型免疫調節タンパク質のエンドドメインは、対応する野生型または非改変ポリペプチドの細胞質ドメイン、例えば、SEQ ID NO:1に記載のアミノ酸配列に含有される細胞質ドメイン(表3を参照のこと)を含む。
いくつかの実施形態では、バリアントCD80であるか、それを含む提供される膜貫通型免疫調節タンパク質は、SEQ ID NO:279に対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%または99%の配列同一性を示すアミノ酸配列を含み、記載される少なくとも1つの親和性改変CD80 IgSFドメインを含むエクトドメイン及び膜貫通ドメインを含有する。いくつかの実施形態では、膜貫通型免疫調節タンパク質は、表1に記載のいずれかを含む、記載されるIgSFドメイン(例えば、IgVドメイン)に任意の1つまたは複数のアミノ酸置換を含有する。いくつかの実施形態では、膜貫通型免疫調節タンパク質は、記載される細胞質ドメインをさらに含むことができる。いくつかの実施形態では、膜貫通型免疫調節タンパク質は、シグナルペプチドをさらに含有することができる。いくつかの実施形態では、シグナルペプチドは、例えばSEQ ID NO:1に記載のアミノ酸配列に含有される、野生型IgSFメンバーの天然シグナルペプチドである(例えば、表3を参照のこと)。
また、膜貫通型免疫調節タンパク質をコードする核酸分子も提供される。いくつかの実施形態では、膜貫通型免疫調節タンパク質をコードする核酸分子は、SEQ ID NO:279に対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%または99%の配列同一性を示すアミノ酸配列をコードするヌクレオチド配列を含み、記載される少なくとも1つの親和性改変IgSFドメインを含むエクトドメイン、膜貫通ドメイン、及び任意で、細胞質ドメインを含有する。いくつかの実施形態では、核酸分子は、シグナルペプチドをコードするヌクレオチドの配列をさらに含むことができる。いくつかの実施形態では、シグナルペプチドは、対応する野生型IgSFメンバーの天然シグナルペプチドである(例えば、表3を参照のこと)。
いくつかの実施形態では、膜貫通型免疫調節タンパク質のエンドドメインが、少なくとも1つのITAM(免疫受容体チロシン活性化モチーフ)含有シグナル伝達ドメインを含む細胞質シグナル伝達ドメインを含む、CAR関連膜貫通型免疫調節タンパク質が提供される。ITAMは、T細胞受容体シグナルトランスダクションに関与するCD3−ζ鎖(「CD3−z」)を含む、免疫細胞のシグナルトランスダクションに関与する多数のタンパク質シグナル伝達ドメインに見いだされる保存モチーフである。いくつかの実施形態では、エンドドメインは、CD3−ζシグナル伝達ドメインを含む。いくつかの実施形態では、CD3−ζシグナル伝達ドメインは、SEQ ID NO:333に記載のアミノ酸配列、またはSEQ ID NO:333に対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%または99%を示すアミノ酸の配列を含み、かつT細胞シグナル伝達の活性を保持する。いくつかの実施形態では、CAR関連膜貫通型免疫調節タンパク質のエンドドメインは、T細胞の免疫調節応答をさらに調節する共刺激シグナル伝達ドメインをさらに含むことができる。いくつかの実施形態では、共刺激シグナル伝達ドメインは、CD28、ICOS、41BBまたはOX40である。いくつかの実施形態では、共刺激シグナル伝達ドメインは、CD28または4−1BBに由来し、かつSEQ ID NO:365〜368のいずれかに記載のアミノ酸配列、またはSEQ ID NO:365〜368に対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%または99%を示すアミノ酸の配列を含み、かつT細胞共刺激シグナル伝達の活性を保持する。いくつかの実施形態では、提供されるCAR関連膜貫通型免疫調節タンパク質は、コグネイト結合パートナーまたはカウンター構造体への親和性改変IgSFドメインの結合によってT細胞シグナル伝達を刺激する、CARの特徴を有する。いくつかの実施形態では、親和性改変IgSFドメインによるそのカウンター構造体への特異的結合によって、細胞傷害性、増殖またはサイトカイン産生の変化によって反映されるとおり、T細胞活性の免疫活性の変化をもたらすことができる。
いくつかの実施形態では、膜貫通型免疫調節タンパク質は、細胞質シグナル伝達を媒介することができるエンドドメインを含有しない。いくつかの実施形態では、膜貫通型免疫調節タンパク質は、野生型または非改変ポリペプチドのシグナルトランスダクション機序を欠いており、したがって、それ自体は細胞シグナル伝達を誘導しない。いくつかの実施形態では、膜貫通型免疫調節タンパク質は、対応する野生型または非改変ポリペプチドの細胞内(細胞質)ドメインまたは該細胞内ドメインの一部分、例えばSEQ ID NO:1に記載のアミノ酸配列に含有される細胞質シグナル伝達ドメインを欠いている(表2を参照のこと)。いくつかの実施形態では、膜貫通型免疫調節タンパク質は、例えばIgSFファミリーの阻害性受容体(例えば、PD−1またはTIGIT)を含む特定の阻害性受容体に含有されるITIM(免疫受容体チロシン阻害性モチーフ)を含有しない。したがって、いくつかの実施形態では、膜貫通型免疫調節タンパク質は、エクトドメイン及び膜貫通ドメイン(例えば、記載のとおりのいずれか)のみを含有する。
2.分泌型免疫調節タンパク質及び操作された細胞
いくつかの実施形態では、本明細書に記載されるアミノ酸変異のいずれか1つまたは複数を含有するCD80バリアント免疫調節ポリペプチドは、例えば細胞に発現する際に分泌可能である。そのようなバリアントCD80免疫調節タンパク質は、膜貫通ドメインを含まない。いくつかの実施形態では、バリアントCD80免疫調節タンパク質は、半減期延長部分(例えば、Fcドメインまたは多量体化ドメイン)にコンジュゲートされない。いくつかの実施形態では、バリアントCD80免疫調節タンパク質は、ドメインを細胞外に出すシグナルペプチド、例えば抗体シグナルペプチドまたは他の有効なシグナル配列を含む。免疫調節タンパク質がシグナルペプチドを含み、操作された細胞によって発現される場合、該シグナルペプチドは、免疫調節タンパク質が操作された細胞によって分泌されるようにする。一般的に、シグナルペプチド、または該シグナルペプチドの一部分は、分泌と共に免疫調節タンパク質から切断される。免疫調節タンパク質は、核酸(発現ベクターの一部分であることができる)によってコードされることができる。いくつかの実施形態では、免疫調節タンパク質は、細胞(例えば免疫細胞、例えば初代免疫細胞)によって発現及び分泌される。
したがって、いくつかの実施形態では、シグナルペプチドをさらに含むバリアントCD80免疫調節タンパク質が提供される。いくつかの実施形態では、シグナルペプチドをコードする分泌配列に機能的に接続されたバリアントCD80免疫調節タンパク質をコードする核酸分子が本明細書において提供される。
シグナルペプチドは、細胞からの免疫調節タンパク質の分泌を合図する免疫調節タンパク質のN末端上の配列である。いくつかの実施形態では、シグナルペプチドは、約5〜約40アミノ酸長(例えば、約5〜約7、約7〜約10、約10〜約15、約15〜約20、約20〜約25、または約25〜約30、約30〜約35、または約35〜約40アミノ酸長)である。
いくつかの実施形態では、シグナルペプチドは、対応する野生型CD80由来の天然シグナルペプチドである(表2を参照のこと)。いくつかの実施形態では、シグナルペプチドは、非天然シグナルペプチドである。例えば、いくつかの実施形態では、非天然シグナルペプチドは、対応する野生型CD80由来の変異した天然シグナルペプチドであり、かつ、1つまたは複数(例えば、2、3、4、5、6、7、8、9、または10以上)の置換、挿入、または欠失を含むことができる。いくつかの実施形態では、非天然シグナルペプチドは、野生型IgSFファミリーメンバーと同じIgSFファミリー由来のファミリーメンバーのシグナルペプチドまたはその変異体である。いくつかの実施形態では、非天然シグナルペプチドは、野生型IgSFファミリーメンバーとは異なるIgSFファミリー由来のIgSFファミリーメンバー由来のシグナルペプチドまたはその変異体である。いくつかの実施形態では、シグナルペプチドは、非IgSFタンパク質ファミリー由来のシグナルペプチドまたはその変異体、例えば免疫グロブリン(例えば、IgG重鎖またはIgGκ軽鎖)、サイトカイン(例えば、インターロイキン−2(IL−2)、またはCD33)、血清アルブミンタンパク質(例えば、HSAまたはアルブミン)、ヒトアズロシジンプレタンパク質シグナル配列、ルシフェラーゼ、トリプシノーゲン(例えば、キモトリプシノーゲンまたはトリプシノーゲン)由来のシグナルペプチド、または細胞からタンパク質を効率的に分泌することができる他のシグナルペプチドである。例示的なシグナルペプチドは、表9に記載のいずれかを含む。
分泌可能なバリアントCD80免疫調節タンパク質のいくつかの実施形態では、免疫調節タンパク質は、発現された際にシグナルペプチドを含み、そしてシグナルペプチド(またはその一部分)は、分泌によって免疫調節タンパク質から切断される。
いくつかの実施形態では、操作された細胞は、細胞から分泌されるバリアントCD80ポリペプチドを発現する。いくつかの実施形態では、そのようなバリアントCD80ポリペプチドは、分泌のためのシグナル配列の操作可能な制御下で、免疫調節タンパク質をコードする核酸分子によってコードされる。いくつかの実施形態では、コードされる免疫調節タンパク質は、細胞から発現された際に分泌される。いくつかの実施形態では、核酸分子によってコードされる免疫調節タンパク質は、膜貫通ドメインを含まない。いくつかの実施形態では、核酸分子によってコードされる免疫調節タンパク質は、半減期延長部分(例えば、Fcドメインまたは多量体化ドメイン)を含まない。いくつかの実施形態では、核酸分子によってコードされる免疫調節タンパク質は、シグナルペプチドを含む。いくつかの実施形態では、本発明の核酸は、免疫調節タンパク質をコードする核酸に作動可能に連結された分泌性またはシグナルペプチドをコードするヌクレオチド配列をさらに含み、それにより免疫調節タンパク質の分泌が可能となる。
3.細胞及び細胞の操作
提供される免疫調節ポリペプチドのいずれかを発現する操作された細胞が本明細書において提供される。いくつかの実施形態では、操作された細胞は、それらの表面上に、提供される膜貫通型免疫調節ポリペプチドのいずれかを発現する。いくつかの実施形態では、操作された細胞は、免疫調節タンパク質を発現して、タンパク質の分泌に好適な条件下で細胞から分泌可能であるか、または分泌することができる。いくつかの実施形態では、免疫調節タンパク質は、リンパ球、例えば腫瘍浸潤リンパ球(TIL)、T細胞もしくはNK細胞上、または骨髄系細胞上に発現する。いくつかの実施形態では、操作された細胞は、抗原提示細胞(APC)である。いくつかの実施形態では、操作された細胞は、改変された哺乳動物T細胞または改変された哺乳動物抗原提示細胞(APC)である。いくつかの実施形態では、操作されたT細胞またはAPCは、ヒトまたはネズミ細胞である。
いくつかの実施形態では、操作されたT細胞は、限定されないが、ヘルパーT細胞、細胞傷害性T細胞(あるいは、細胞傷害性Tリンパ球またはCTL)、ナチュラルキラーT細胞、制御性T細胞、メモリーT細胞、またはγδT細胞を含む。いくつかの実施形態では、操作されたT細胞は、CD4+またはCD8+である。MHCのシグナルに加えて、改変されたT細胞はまた、共刺激シグナルを必要とする。いくつかの実施形態では、操作されたT細胞は、阻害性シグナルによっても調整でき、これは、場合によっては、前述したように膜結合形態で発現したバリアントCD80膜貫通型免疫調節ポリペプチドによって提供される。
いくつかの実施形態では、操作されたAPCは、例えば、MHC IIを発現するAPC、例えばマクロファージ、B細胞、及び樹状細胞、ならびに細胞及び無細胞(例えば、生分解性高分子微粒子)aAPCの両方を含む人工APC(aAPC)を含む。人工APC(aAPC)は、これらが抗原をT細胞に提示し、それらを活性化するという点でAPCと類似の様式で作用することができる、APCの合成バージョンである。抗原提示は、MHC(クラスIまたはクラスII)によって実施される。いくつかの実施形態では、aAPCのような操作されたAPCでは、MHC上に負荷される抗原は、いくつかの実施形態では、腫瘍特異的抗原または腫瘍関連抗原である。MHC上に負荷される抗原は、いくつかの場合ではCTLA−4、CD28、PD−L1または本明細書において提供されるバリアントCD80ポリペプチドによって認識される他の分子を発現することができる、T細胞のT細胞受容体(TCR)によって認識される。aAPCを操作するために使用することができる材料は、ポリグリコール酸、ポリ(乳酸−co−グリコール酸)、酸化鉄、リポソーム、脂質二重層、セファロース、及びポリスチレンが挙げられる。
いくつかの実施形態では、養子細胞療法で使用されるTIP及びTCR作動物質を含有するように操作することができる。いくつかの実施形態では、細胞のaAPCは、例えば患者への再導入のために、投与前などに、ヒトT細胞のex vivo増殖に使用されるTIP及びTCR作動物質を含有するように操作することができる。いくつかの態様では、aAPCは、例えば、OKT3及び/またはUCHT1などの少なくとも1つの抗CD3抗体クローンの発現を含み得る。いくつかの態様では、aAPCは不活性化(例えば、照射)されていてもよい。いくつかの実施形態では、TIPは、T細胞上のコグネイト結合パートナーに対して結合親和性を示す任意のバリアントIgSFドメインを含むことができる。
いくつかの実施形態では、膜貫通型免疫調節タンパク質または分泌可能な免疫調節タンパク質などの本明細書で提供される免疫調節タンパク質は、共発現または操作されて、抗原結合受容体、例えば組換え受容体、例えばキメラ抗原受容体(CAR)またはT細胞受容体(TCR)を発現する細胞になる。いくつかの実施形態では、操作された細胞、例えば操作されたT細胞は、がん、炎症性及び自己免疫性障害、またはウイルス感染に関連する所望の抗原を認識する。特定の実施形態では、抗原結合受容体は、腫瘍特異的抗原または腫瘍関連抗原に特異的に結合する抗原結合部分を含有する。いくつかの実施形態では、操作されたT細胞は、腫瘍特異的抗原または腫瘍関連抗原などの抗原に特異的に結合する抗原結合ドメイン(例えばscFv)を含有するCAR(キメラ抗原受容体)T細胞である。いくつかの実施形態では、TIPタンパク質は、操作されたT細胞受容体細胞または操作されたキメラ抗原受容体細胞で発現する。かかる実施形態では、操作された細胞はTIPとCARまたはTCRを共発現する。いくつかの実施形態では、SIPタンパク質は、操作されたT細胞受容体細胞または操作されたキメラ抗原受容体細胞で発現する。かかる実施形態では、操作された細胞は、SIPとCARまたはTCRを共発現する。
キメラ抗原受容体(CAR)は、抗原結合ドメイン(エクトドメイン)、膜貫通ドメイン、及び抗原の結合後にT細胞への活性化シグナルを誘導または媒介できる細胞内シグナル伝達領域(エンドドメイン)を含む組換え受容体である。いくつかの実施例では、CAR発現細胞は、活性化ドメイン、及び場合によっては共刺激ドメインを含む細胞内シグナル伝達部分に連結された特定の腫瘍抗原に対して特異性を有する細胞外単鎖可変断片(scFv)を発現するように操作される。共刺激ドメインは、例えば、CD28、OX−40、4−1BB/CD137、誘導性T細胞共刺激因子(ICOS)に由来し得る。活性化ドメインは、例えば、CD3、例えばCD3ζ、ε、δ、γなどに由来し得る。ある種の実施形態では、CARは、2つ、3つ、4つ以上の共刺激ドメインを持つように設計される。CAR scFvは、疾患または状態に関連する細胞、例えば腫瘍抗原、例えばCD19などで発現する抗原を標的とするように設計することができ、これはB細胞系の細胞(NHL、CLL、及び非T細胞ALLを含むがこれらに限定されない全ての正常なB細胞及びB細胞悪性腫瘍を含む)によって発現される膜貫通型タンパク質である。例示的なCAR+T細胞療法及び構築物は、米国特許公開第2013/0287748号、第2014/0227237号、第2014/0099309号、及び第2014/0050708号に記載されており、これらの参考文献はその全体が参照により組み込まれる。
いくつかの態様では、抗原結合ドメインは、抗体またはその抗原結合断片、例えば単鎖断片(scFv)である。いくつかの実施形態では、抗原は、腫瘍またはがん細胞で発現する。抗原の例はCD19である。CARの例は、抗CD19 CAR、例えばSEQ ID NO:363に記載の抗CD19 scFvを含有するCARである。いくつかの実施形態では、CARは、スペーサー、膜貫通ドメイン、及びITAMシグナル伝達ドメイン、例えばCD3ζシグナル伝達ドメインを含む細胞内シグナル伝達ドメインまたは領域をさらに含有する。いくつかの実施形態では、CARは、共刺激シグナル伝達ドメインをさらに含む。いくつかの実施形態では、スペーサー及び膜貫通ドメインは、CD8に由来するヒンジ及び膜貫通ドメインであり、例えば、SEQ ID NO:332、364、1997に記載の例示的な配列、またはSEQ ID NO:332、364、1997に対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、またはそれ以上の配列同一性を示すアミノ酸の配列を有する。いくつかの実施形態では、エンドドメインは、CD3−ζシグナル伝達ドメインを含む。いくつかの実施形態では、CD3−ζシグナル伝達ドメインは、SEQ ID NO:333に記載のアミノ酸配列、またはSEQ ID NO:333に対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%または99%、またはそれ以上の配列同一性を示すアミノ酸の配列を含み、かつT細胞シグナル伝達の活性を保持する。いくつかの実施形態では、CARのエンドドメインは、T細胞の免疫調節応答をさらに調節する共刺激シグナル伝達ドメインまたは領域をさらに含むことができる。いくつかの実施形態では、共刺激シグナル伝達ドメインは、共刺激領域であるか、またはそれを含むか、またはCD28、ICOS、41BBまたはOX40の共刺激領域に由来する。いくつかの実施形態では、共刺激シグナル伝達ドメインは、CD28または4−1BBに由来し、かつSEQ ID NO:365〜368のいずれかに記載のアミノ酸配列、またはSEQ ID NO:365〜368に対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%または99%、またはそれ以上の配列同一性を示し、かつT細胞共刺激シグナル伝達の活性を保持するアミノ酸の配列を含む。
いくつかの実施形態では、CARをコードする構築物は、自己切断ペプチド配列によってCARから分離されたマーカー、例えば検出可能なタンパク質などの第2のタンパク質をさらにコードする。いくつかの実施形態では、自己切断ペプチド配列は、F2A、T2A、E2A、またはP2A自己切断ペプチドである。T2A自己切断ペプチドの例示的な配列は、SEQ ID NO:369、2004、2008のいずれか1つ、またはSEQ ID NO:369、2004、2008のいずれかに対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、またはそれ以上の配列同一性を示すアミノ酸の配列に記載される。いくつかの実施形態では、T2Aは、SEQ ID NO:2008に記載のヌクレオチド配列、またはSEQ ID NO:2008のいずれかに対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%または99%、またはそれ以上の配列同一性を示す配列によってコードされる。P2A自己切断ペプチドの例示的な配列は、SEQ ID NO:2038、またはSEQ ID NO:3032に対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、または99%、またはそれ以上の配列同一性を示すアミノ酸の配列において設定される。場合によっては、核酸構築物は2つ以上のP2A自己切断ペプチド(例えばP2A1及びP2A2)をコードし、ヌクレオチド配列P2A1及びP2A2はそれぞれSEQ ID NO:3032に記載のP2Aをコードし、該ヌクレオチド配列は配列間の組換えを避けるため異なっていてもよい。
いくつかの実施形態では、マーカーは、蛍光タンパク質、例えば緑色蛍光タンパク質(GFP)または青色蛍光タンパク質(BFP)などの検出可能なタンパク質である。蛍光タンパク質マーカーの例示的な配列は、SEQ ID NO:370、2003、3033〜3035、またはSEQ ID NO:370、2003、3033〜3035に対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、または99%、またはそれ以上の配列同一性を示すアミノ酸の配列に記載されている。
いくつかの実施形態では、CARは、SEQ ID NO:360、371、372、373、1998、1999、2001、2002のいずれかに記載のアミノ酸配列、またはSEQ ID NO:360、371、372、373、1998、1999、2001、2002のいずれか1つに対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、または99%、またはそれ以上の配列同一性を示すアミノ酸の配列を有する。いくつかの実施形態では、CARは、SEQ ID NO:2000または2006に記載のヌクレオチド配列、またはSEQ ID NO:2000または2006のいずれか1つに対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、または99%、またはそれ以上の配列同一性を示すアミノ酸の配列によってコードされる。
別の実施形態では、操作されたT細胞は、組換えまたは操作されたTCRを含むTCRを有する。いくつかの実施形態では、TCRは、天然TCRであることができる。当業者は、一般的に天然の哺乳動物T細胞受容体が、抗原特異的認識及び結合に関与するα及びβ鎖(またはγ及びδ鎖)を含むことを認識するだろう。いくつかの実施形態では、TCRは、改変されている操作されたTCRである。いくつかの実施形態では、操作されたT細胞のTCRは、APCによって提示された腫瘍関連または腫瘍特異的抗原に特異的に結合する。
いくつかの実施形態では、免疫調節ポリペプチド、例えば膜貫通型免疫調節ポリペプチドまたは分泌可能な免疫調節ポリペプチドを、組換え宿主細胞に採用されるもののような多種多様な方法によって、操作された細胞、例えば操作されたT細胞または操作されたAPCに組み込むことができる。DNA構築物を初代T細胞に導入するための多種多様な方法が当技術分野において公知である。いくつかの実施形態では、ウイルス形質導入またはプラスミドエレクトロポレーションが採用される。典型的な実施形態では、免疫調節タンパク質をコードする核酸分子、または発現ベクターは、発現された膜貫通型免疫調節タンパク質を細胞膜に局在化させるかまたは分泌のためのシグナルペプチドを含む。いくつかの実施形態では、本発明の膜貫通型免疫調節タンパク質をコードする核酸は、ウイルスベクター、例えばレトロウイルスベクターにサブクローニングされ、これにより宿主哺乳動物細胞での発現が可能になる。発現ベクターを哺乳動物宿主細胞に導入することができ、宿主細胞培養条件下で、免疫調節タンパク質が表面上に発現するかまたは分泌される。
例示的な例では、初代T細胞を、ex vivoで精製して(CD4細胞またはCD8細胞または両方)、様々なTCR/CD28作動物質、例えば抗CD3/抗CD28コートビーズからなる活性化プロトコルで刺激することができる。2または3日の活性化プロセス後、免疫調節ポリペプチドを含有する組換え発現ベクターを、当技術分野で標準的なレンチウイルスもしくはレトロウイルス形質導入プロトコルまたはプラスミドエレクトロポレーション法により、初代T細胞に安定的に導入することができる。細胞を、例えば、バリアントCD80を含む天然親分子及びポリペプチドと交差反応する抗エピトープタグまたは抗体を使用するフローサイトメトリーによって、免疫調節ポリペプチド発現についてモニタリングすることができる。免疫調節ポリペプチドを発現するT細胞を、用途に応じて、抗エピトープタグ抗体を用いたソーティングにより濃縮することも、高または低発現のために濃縮することもできる。
免疫調節ポリペプチドが発現されると、操作されたT細胞を多種多様な手段によって、適切な機能についてアッセイすることができる。操作されたCARまたはTCR共発現を検証して、操作されたT細胞のこの部分が免疫調節タンパク質の発現による影響をほとんど受けなかったことを示すことができる。検証すると、標準的なin vitro細胞傷害性、増殖、またはサイトカインアッセイ(例えば、IFN−γ発現)を使用して、操作されたT細胞の機能を評価することができる。例示的な標準エンドポイントは、腫瘍株の溶解率、操作されたT細胞の増殖率、または培養上清中のIFN−γタンパク質発現率である。対照構築物に対して、統計的に有意な腫瘍株の溶解の増加、操作されたT細胞の増殖の増加、またはIFN−γ発現の増加をもたらす操作された構築物を選択することができる。加えて、操作されていない細胞、例えば天然の初代または内在性T細胞を同じin vitroアッセイに組み込んで、操作された細胞、例えば操作されたT細胞上に発現する免疫調節ポリペプチド構築物の、活性を調節する(いくつかの場合では、バイスタンダー天然T細胞におけるエフェクター機能を活性化及び生成することを含む)能力を測定することもできる。活性化マーカー、例えばCD69、CD44、またはCD62Lの増加した発現を内在性T細胞上でモニタリングすることもでき、増加した増殖及び/またはサイトカイン産生は、改変されたT細胞上に発現する免疫調節タンパク質の所望の活性を示すこともできる。
いくつかの実施形態では、類似のアッセイを使用して、CARまたはTCR単独を含有する操作されたT細胞の機能を、CARまたはTCR及びTIP構築物を含有するものと比較することができる。典型的には、これらのin vitroアッセイは、様々な比率の操作されたT細胞及びコグネイトCARまたはTCR抗原を含有する「腫瘍」細胞株を一緒に培養下でプレーティングすることによって実施される。標準エンドポイントは、腫瘍株の溶解率、操作されたT細胞の増殖率、または培養上清中のIFN−γ産生率である。同じTCRまたはCAR構築物単独に対して、統計的に有意な腫瘍株の溶解の増加、操作されたT細胞の増殖の増加、またはIFN−γ産生の増加をもたらした操作された免疫調節タンパク質を選択することができる。操作されたヒトT細胞を、マウスのT細胞、NK細胞及びB細胞を欠いているNSG系統のような免疫不全マウスで分析することができる。CARまたはTCRが異種移植片上の標的カウンター構造体に結合しかつTIPの親和性改変IgSFドメインと共発現する操作されたヒトT細胞を、異種移植片と比較して異なる細胞数及び比率にてin vivoで養子移入することができる。例えば、ルシフェラーゼ/GFPベクターを含有するCD19+白血病腫瘍株の生着を、生物発光によりまたはex vivoでフローサイトメトリーによってモニタリングすることができる。ある共通の実施形態では、異種移植片がネズミモデルに導入され、続いて数日後に操作されたT細胞が導入される。免疫調節タンパク質を含有する操作されたT細胞を、CARまたはTCR単独を含有する操作されたT細胞と比べて、増加した生存、腫瘍クリアランス、または操作されたT細胞の増殖数についてアッセイすることができる。in vitroアッセイと同様に、内在性の天然(すなわち、操作されていない)ヒトT細胞を共養子移入して、その集団において、より良好な生存または腫瘍クリアランスをもたらすエピトープ拡大の成功を予測することができる。
E.バリアントポリペプチド及び免疫調節タンパク質を発現する感染性物質
また、本明細書に記載の分泌可能な免疫調節タンパク質または膜貫通型免疫調節タンパク質を含むバリアントポリペプチド、例えばCD80 vIgDポリペプチドのいずれかをコードする核酸を含有する感染性物質も提供される。いくつかの実施形態では、そのような感染性物質は、本明細書に記載のバリアント免疫調節ポリペプチド、例えばCD80 vIgDポリペプチドをコードする核酸を、対象の標的細胞、例えば対象の免疫細胞及び/または抗原提示細胞(APC)または腫瘍細胞に送達することができる。また、そのような感染性物質に含有される核酸、及び/または、そのような感染性物質の生成もしくは改変のための核酸、例えばベクター及び/またはプラスミド、ならびにそのような感染性物質を含有する組成物が提供される。
いくつかの実施形態では、感染性物質は、微生物または病原菌である。いくつかの実施形態では、感染性物質は、ウイルスまたは細菌である。いくつかの実施形態では、感染性物質は、ウイルスである。いくつかの実施形態では、感染性物質は、細菌である。いくつかの実施形態では、そのような感染性物質は、本明細書に記載の分泌可能な免疫調節タンパク質または膜貫通型免疫調節タンパク質を含むバリアントポリペプチド、例えばCD80 vIgDポリペプチドのいずれかをコードする核酸配列を送達することができる。したがって、いくつかの実施形態では、感染性物質に感染されるまたは接触される対象の細胞は、バリアント免疫調節ポリペプチドを細胞表面上に発現させるかまたは分泌させることができる。いくつかの実施形態では、感染性物質はまた、1つまたは複数の他の治療薬または他の治療薬をコードする核酸を対象内の細胞及び/または環境に送達することもできる。いくつかの実施形態では、感染性物質によって送達されることができる他の治療薬は、サイトカインまたは他の免疫調節分子を含む。
いくつかの実施形態では、感染性物質、例えば、ウイルスまたは細菌は、本明細書に記載の分泌可能な免疫調節タンパク質または膜貫通型免疫調節タンパク質を含むバリアントポリペプチド、例えばCD80 vIgDポリペプチドのいずれかをコードする核酸配列を含有し、対象の細胞の接触及び/または感染によって、該細胞は、感染性物質に含有される核酸配列によってコードされた分泌可能な免疫調節タンパク質または膜貫通型免疫調節タンパク質を含むバリアントポリペプチド、例えばCD80 vIgDポリペプチドを発現する。いくつかの実施形態では、感染性物質を対象に投与することができる。いくつかの実施形態では、感染性物質を対象由来の細胞とex vivoで接触させることができる。
いくつかの実施形態では、感染性物質によって感染された細胞によって発現する膜貫通型免疫調節タンパク質を含むバリアントポリペプチド、例えばCD80 vIgDポリペプチドは、膜貫通型タンパク質であり、表面に発現する。いくつかの実施形態では、感染性物質によって感染された細胞によって発現される分泌可能な免疫調節タンパク質を含むバリアントポリペプチド、例えばCD80 vIgDポリペプチドは、細胞から発現されかつ分泌される。膜貫通型免疫調節タンパク質または分泌型免疫調節タンパク質は、本明細書に記載のいずれかであることができる。
いくつかの実施形態では、感染性物質によって標的とされる対象の細胞は、腫瘍細胞、免疫細胞、及び/または抗原提示細胞(APC)を含む。いくつかの実施形態では、感染性物質は、腫瘍微小環境(TME)にある細胞を標的とする。いくつかの実施形態では、感染性物質は、分泌可能な免疫調節タンパク質または膜貫通型免疫調節タンパク質を含むバリアントポリペプチド、例えばCD80 vIgDポリペプチドをコードする核酸を、適切な細胞(例えば、APC、例えばペプチド/MHC複合体をその細胞表面上に提示する細胞、例えば樹状細胞)または組織(例えば、リンパ組織)に送達し、それにより、所望の効果、例えば免疫調節及び/または特異的な細胞媒介性免疫応答、例えばCD4及び/またはCD8 T細胞応答を誘導する及び/または増強させ、そのCD8 T細胞応答は、細胞傷害性T細胞(CTL)応答を含み得る。いくつかの実施形態では、感染性物質は、APC、例えば樹状細胞(DC)を標的とする。いくつかの実施形態では、本明細書に記載の感染性物質によって送達される核酸分子は、特定の標的細胞において、バリアント免疫調節ポリペプチドをコードする作動可能に連結されたコード配列の発現に必要な適切な核酸配列、例えば、調節エレメント、例えばプロモーターを含む。
いくつかの実施形態では、免疫調節ポリペプチドをコードする核酸配列を含有する感染性物質はまた、1つまたは複数の追加の遺伝子産物、例えば、サイトカイン、プロドラッグ変換酵素、細胞毒素及び/または検出可能遺伝子産物をコードする核酸配列を含有することもできる。例えば、いくつかの実施形態では、感染性物質は、腫瘍溶解性ウイルスであり、該ウイルスは、追加の治療用遺伝子産物をコードする核酸配列を含むことができる(例えば、Kirn et al.,(2009)Nat Rev Cancer 9:64−71;Garcia−Aragoncillo et al.,(2010)Curr Opin Mol Ther 12:403−411を参照のこと;米国特許第7,588,767号、第7,588,771号、第7,662,398号及び第7,754,221号、ならびに米国特許出願公開第2007/0202572号、第2007/0212727号、第2010/0062016号、第2009/0098529号、第2009/0053244号、第2009/0155287号、第2009/0117034号、第2010/0233078号、第2009/0162288号、第2010/0196325号、第2009/0136917号及び第2011/0064650号を参照のこと。いくつかの実施形態では、追加の遺伝子産物は、標的細胞(例えば、腫瘍細胞)の死をもたらすことができる治療用遺伝子産物、または免疫応答を増強もしくは強化もしくは調節できる遺伝子産物(例えば、サイトカイン)であることができる。例示的な遺伝子産物はまた、抗がん剤、抗転移剤、抗血管新生剤、免疫調節分子、免疫チェックポイント阻害剤、抗体、サイトカイン、成長因子、抗原、細胞傷害性遺伝子産物、プロアポトーシス遺伝子産物、抗アポトーシス遺伝子産物、細胞マトリックス分解性遺伝子、組織再生またはヒト体細胞をリプログラミングして多能性にするための遺伝子ならびに本明細書に記載のまたは当業者に公知の他の遺伝子の中に含まれる。いくつかの実施形態では、追加の遺伝子産物は、顆粒球マクロファージコロニー刺激因子(GM−CSF)である。
1.ウイルス
いくつかの実施形態では、感染性物質は、ウイルスである。いくつかの実施形態では、感染性物質は、腫瘍溶解性ウイルス、または、特定の細胞、例えば免疫細胞を標的とするウイルスである。いくつかの実施形態では、感染性物質は、対象の腫瘍細胞及び/またはがん細胞を標的とする。いくつかの実施形態では、感染性物質は、免疫細胞または抗原提示細胞(APC)を標的とする。
いくつかの実施形態では、感染性物質は、腫瘍溶解性ウイルスである。腫瘍溶解性ウイルスは、腫瘍細胞に蓄積しかつ腫瘍細胞において複製するウイルスである。該細胞における複製、及び本明細書に記載のバリアント免疫調節バリアントCD80ポリペプチドまたは免疫調節タンパク質をコードする核酸の任意の送達によって、腫瘍細胞は溶解され、腫瘍は縮小し、排除されることができる。腫瘍溶解性ウイルスは、広範な宿主及び細胞タイプの範囲を有することができる。例えば、腫瘍溶解性ウイルスは、腫瘍及び/または転移を含み、かつ創傷組織及び細胞も含む、免疫特権を有する細胞または免疫特権を有する組織に蓄積し、これにより本明細書に記載のバリアント免疫調節ポリペプチドをコードする核酸の、広範な細胞タイプにおける送達及び発現が可能となる。腫瘍溶解性ウイルスは腫瘍細胞特異的に複製することもでき、その結果、腫瘍細胞溶解及び効率的な腫瘍退縮をもたらすことができる。
例示的な腫瘍溶解性ウイルスは、アデノウイルス、アデノ随伴ウイルス、ヘルペスウイルス、単純ヘルペスウイルス、レオウイルス、ニューカッスル病ウイルス、パルボウイルス、麻疹ウイルス、水疱性口内炎ウイルス(VSV)、コクサッキーウイルス及びワクシニアウイルスが挙げられる。いくつかの実施形態では、腫瘍溶解性ウイルスは、他の臓器に感染することなく固体腫瘍に特異的に定着することができ、感染性物質として使用して、本明細書に記載のバリアント免疫調節ポリペプチドをコードする核酸をそのような固体腫瘍に送達することができる。
本明細書に記載のバリアントCD80ポリペプチドまたは免疫調節タンパク質をコードする核酸の送達に使用するための腫瘍溶解性ウイルスは、当業者に公知のもののいずれかであることができ、例えば、水疱性口内炎ウイルス(例えば、米国特許第7,731,974号、第7,153,510号、第6,653,103号、及び米国特許出願公開第2010/0178684号、第2010/0172877号、第2010/0113567号、第2007/0098743号、第20050260601号、第20050220818号、及び欧州特許第1385466号、第1606411号及び第1520175号を参照のこと);単純ヘルペスウイルス(例えば、米国特許第7,897,146号、第7,731,952号、第7,550,296号、第7,537,924号、第6,723,316号、第6,428,968号、及び米国特許出願公開第2014/0154216号、第2011/0177032号、第2011/0158948号、第2010/0092515号、第2009/0274728号、第2009/0285860号、第2009/0215147号、第2009/0010889号、第2007/0110720号、第2006/0039894号、第2004/0009604号、第2004/0063094号、国際特許公開WO2007/052029、WO1999/038955を参照のこと);レトロウイルス(例えば、米国特許第6,689,871号、第6,635,472号、第5,851,529号、第5,716,826号、第5,716,613号及び米国特許出願公開第20110212530号を参照のこと);ワクシニアウイルス(例えば、2016/0339066号を参照のこと)、及びアデノ随伴ウイルス(例えば、米国特許第8,007,780号、第7,968,340号、第7,943,374号、第7,906,111号、第7,927,585号、第7,811,814号、第7,662,627号、第7,241,447号、第7,238,526号、第7,172,893号、第7,033,826号、第7,001,765号、第6,897,045号、及び第6,632,670号を参照のこと)が挙げられる。
腫瘍溶解性ウイルスはまた、それらの病原性を減弱し、それらの安全性プロファイルを改善し、それらの腫瘍特異性を増強するように遺伝子が変化されたウイルスを含み、そして、これらはまた、ウイルスの有効性全体を改善する追加の遺伝子、例えば細胞毒素、サイトカイン、プロドラッグ変換酵素を備えている(例えば、Kirn et al.,(2009)Nat Rev Cancer 9:64−71;Garcia−Aragoncillo et al.,(2010)Curr Opin Mol Ther 12:403−411を参照のこと;米国特許第第7,588,767号、第7,588,771号、第7,662,398号及び第7,754,221号、ならびに米国特許出願公開第2007/0202572号、第2007/0212727号、第2010/0062016号、第2009/0098529号、第2009/0053244号、第2009/0155287号、第2009/0117034号、第2010/0233078号、第2009/0162288号、第2010/0196325号、第2009/0136917号及び第2011/0064650号を参照のこと)。いくつかの実施形態では、腫瘍溶解性ウイルスは、がん性細胞において選択的に複製するように改変されているもの、したがって腫瘍溶解性である、ウイルスであることができる。例えば、腫瘍溶解性ウイルスは、腫瘍治療のため、及びまた遺伝子治療ベクターとして、改変された指向性を有するように操作されているアデノウイルスである。その例は、ONYX−015、H101及びAd5ΔCR(Hallden and Portella(2012)Expert Opin Ther Targets,16:945−58)及びTNFerade(McLoughlin et al.(2005)Ann.Surg.Oncol.,12:825−30)、または制限増殖型アデノウイルスOncorine(登録商標)である。
いくつかの実施形態では、感染性物質は、改変された単純ヘルペスウイルスである。いくつかの実施形態では、感染性物質は、本明細書に記載のバリアント免疫調節ポリペプチドのいずれか、例えば本明細書に記載のバリアントCD80ポリペプチドまたは免疫調節タンパク質のいずれかをコードする核酸を含有するように改変された、タリモジーン・ラハーパレプベック(T−Vec、ImlygicまたはOncoVex GM−CSFとしても公知)の改変されたバージョンである。いくつかの実施形態では、感染性物質は、例えば、WO2007/052029、WO1999/038955、US2004/0063094、US2014/0154216に記載されている改変された単純ヘルペスウイルス、またはそのバリアントである。
いくつかの実施形態では、感染性物質は、ウイルスが投与される対象において特定タイプの細胞を標的とするウイルス、例えば免疫細胞または抗原提示細胞(APC)を標的とするウイルスである。樹状細胞(DC)は、免疫応答の開始及び制御に必須のAPCである。DCは、抗原を捕捉及びプロセシングすることができ、末梢からリンパ系臓器へ遊走し、抗原を静止T細胞に主要組織適合複合体(MHC)拘束様式で提示することができる。いくつかの実施形態では、感染性物質は、DCを特異的に標的としてDCにおける発現のためにバリアントCD80ポリペプチドまたは免疫調節タンパク質をコードする核酸を送達できるウイルスである。いくつかの実施形態では、ウイルスは、レンチウイルスまたはそのバリアントもしくは誘導体、例えば組み込み欠損型レンチウイルスベクターである。いくつかの実施形態では、ウイルスは、細胞表面マーカーである樹状細胞特異的細胞間接着分子−3−捕捉ノンインテグリン(DC−SIGN)を発現する細胞、例えばDCに効率的に結合して生産的に感染するようシュードタイプ化されたレンチウイルスである。いくつかの実施形態では、ウイルスは、シンドビスウイルスE2糖タンパク質またはその改変された形態でシュードタイプ化されたレンチウイルス、例えばWO2013/149167に記載されているものである。いくつかの実施形態では、ウイルスは、関心対象の配列(例えば、本明細書に記載のバリアントCD80ポリペプチドまたは免疫調節タンパク質のいずれかをコードする核酸)のDCへの送達及び発現を可能にする。いくつかの実施形態では、ウイルスは、WO2008/011636またはUS2011/0064763、Tareen et al.(2014)Mol.Ther.,22:575−587に記載されているもの、またはそのバリアントを含む。樹状細胞指向性ベクタープラットフォームの例は、ZVex(商標)である。
2.細菌
いくつかの実施形態では、感染性物質は、細菌である。例えば、いくつかの実施形態では、細菌は、本明細書に記載のバリアント免疫調節ポリペプチドのいずれか、例えば、バリアントCD80ポリペプチドまたは免疫調節タンパク質をコードする核酸を、対象の標的細胞、例えば腫瘍細胞、免疫細胞、抗原提示細胞及び/またはド貪食細胞に送達することができる。いくつかの実施形態では、細菌は、バリアント免疫調節ポリペプチドの発現及び/または分泌のため、及び/または、バリアント免疫調節ポリペプチドの発現のための環境において特定の細胞を標的とするため、対象内の特定の環境、例えば腫瘍微小環境(TME)に優先的に標的とされることができる。
いくつかの実施形態では、細菌は、哺乳動物細胞へのプラスミドDNAの細菌媒介性移送(「バクトフェクション」とも称される)を介して核酸を細胞に送達する。例えば、いくつかの実施形態では、遺伝物質の送達は、細菌全体の標的細胞への侵入により達成される。いくつかの実施形態では、自発的なまたは誘導された溶菌が、その後の真核細胞発現のためのプラスミドの放出をもたらすことができる。いくつかの実施形態では、細菌は、非貪食哺乳動物細胞(例えば、腫瘍細胞)及び/または貪食細胞、例えば、特定の免疫細胞及び/またはAPCに、核酸を送達することができる。いくつかの実施形態では、細菌によって送達される核酸を、発現のために対象の細胞の核に移すことができる。いくつかの実施形態では、核酸はまた、特定の宿主細胞において、バリアント免疫調節ポリペプチドをコードする作動可能に連結された配列の発現に必要な適切な核酸配列、例えば、調節エレメント、例えばプロモーターまたはエンハンサーを含む。いくつかの実施形態では、細菌である感染性物質は、免疫調節タンパク質をコードする核酸を、標的細胞の機構により翻訳のために標的細胞の細胞質に送達されるRNA、例えば予め作製された翻訳能力のあるRNAの形態で送達することができる。
いくつかの実施形態では、細菌は、標的細胞、例えば腫瘍細胞において複製し、該細胞を溶解することができる。いくつかの実施形態では、細菌は、標的細胞の細胞質で核酸配列及び/または遺伝子産物を含有及び/または放出することができ、それにより、標的細胞、例えば腫瘍細胞を殺傷することができる。いくつかの実施形態では、感染性物質は、対象の特定の環境、例えば、腫瘍微小環境(TME)で特異的に複製することができる細菌である。例えば、いくつかの実施形態では、細菌は、嫌気性または低酸素微小環境で特異的に複製することができる。いくつかの実施形態では、特定の環境に存在する条件または因子、例えばTMEにおいて細胞によって産生されるアスパラギン酸、セリン、クエン酸、リボースまたはガラクトースは、細菌を該環境に誘引する化学誘引物質として作用することができる。いくつかの実施形態では、細菌は、本明細書に記載の免疫調節タンパク質を、環境、例えばTMEにおいて、発現及び/または分泌することができる。
いくつかの実施形態では、感染性物質は、Listeria属、Bifidobacterium属、Escherichia属、Closteridium属、Salmonella属、Shigella属、Vibrio属、またはYersinia属である細菌である。いくつかの実施形態では、細菌は、Listeria monocytogenes、Salmonella typhimurium、Salmonella choleraesuis、Escherichia coli、Vibrio cholera、Clostridium perfringens、Clostridium butyricum、Clostridium novyi、Clostridium acetobutylicum、Bifidobacterium infantis、Bifidobacterium longum及びBifidobacterium adolescentisの1つまたは複数の中から選択される。いくつかの実施形態では、細菌は、操作された細菌である。いくつかの実施形態では、細菌は、操作された細菌、例えば、Seow and Wood(2009)Molecular Therapy 17(5):767−777;Baban et al.(2010)Bioengineered Bugs 1:6,385−394;Patyar et al.(2010)J Biomed Sci 17:21;Tangney et al.(2010)Bioengineered Bugs 1:4,284−287;van Pijkeren et al.(2010)Hum Gene Ther.21(4):405−416;WO2012/149364;WO2014/198002;US9103831;US9453227;US2014/0186401;US2004/0146488;US2011/0293705;US2015/0359909及びEP3020816に記載されているものである。細菌は、本明細書において提供されるバリアント免疫調節ポリペプチド、コンジュゲート及び/または融合体のいずれかをコードする核酸配列を送達するように、及び/またはそのようなバリアント免疫調節ポリペプチドを対象において発現するように、改変されることができる。
F.ポリペプチドまたは細胞を産生するための核酸、ベクター及び方法
本明細書において提供されるバリアントCD80ポリペプチドまたは免疫調節ポリペプチドの種々の提供される態様のいずれかをコードする、単離された核酸または組換え核酸(まとめて「核酸」と称される)が本明細書において提供される。いくつかの実施形態では、後述の全てを含む本明細書において提供される核酸は、本明細書において提供されるバリアントCD80ポリペプチドまたは免疫調節ポリペプチドの組換え産生(例えば、発現)に有用である。いくつかの実施形態では、後述の全てを含む本明細書において提供される核酸は、細胞、例えば操作された細胞、例えば免疫細胞、または感染性物質細胞における、本明細書において提供されるバリアントCD80ポリペプチドまたは免疫調節ポリペプチドの発現に有用である。本明細書において提供される核酸は、RNAの形態またはDNAの形態であることができ、mRNA、cRNA、組換えまたは合成RNA及びDNA、ならびにcDNAを含むことができる。本明細書において提供される核酸は、典型的には、DNA分子、通常二本鎖のDNA分子である。しかしながら、本発明のヌクレオチド配列のうちのいずれかを含む、一本鎖DNA、一本鎖RNA、二本鎖RNA、及びハイブリッドDNA/RNA核酸またはその組み合わせも提供される。
また、本明細書において提供されるバリアントCD80ポリペプチドまたは免疫調節ポリペプチドを産生する際に有用な、組換え発現ベクター及び組換え宿主細胞も本明細書において提供される。
また、提供される免疫調節ポリペプチドのいずれか、例えば膜貫通型免疫調節ポリペプチドまたは分泌可能な免疫調節ポリペプチドのいずれかを含有する、操作された細胞、例えば操作された免疫細胞も本明細書において提供される。
また、提供される免疫調節ポリペプチドのいずれか、例えば膜貫通型免疫調節ポリペプチドまたは分泌可能な免疫調節ポリペプチドのいずれかを含有する、感染性物質、例えば細菌細胞またはウイルス細胞も本明細書において提供される。
上に提供される実施形態のいずれかでは、本明細書において提供される免疫調節ポリペプチドをコードする核酸を、組換えDNA及びクローニング技術を使用して細胞に導入することができる。そのようにするために、免疫調節ポリペプチドをコードする組換えDNA分子が調製される。そのようなDNA分子を調製する方法は、当技術分野において周知である。例えば、ペプチドをコードする配列を好適な制限酵素を使用してDNAから切り取ることができる。あるいは、ホスホロアミダイト法のような化学合成技術を使用してDNA分子を合成することができる。また、これらの技術の組み合わせを使用することができる。場合によっては、ポリメラーゼ連鎖反応(PCR)により組換えまたは合成核酸を生成してもよい。いくつかの実施形態では、少なくとも1つの親和性改変IgSFドメインと、いくつかの実施形態では、シグナルペプチド、膜貫通ドメイン、及び/またはエンドドメインを含有する1つまたは複数のバリアントCD80ポリペプチドをコードするDNAインサートを、提供される説明に従って生成することができる。このDNAインサートを、当業者に公知のとおり、適切な形質導入/トランスフェクションベクターにクローニングすることができる。また、該核酸分子を含有する発現ベクターも提供される。
いくつかの実施形態では、発現ベクターは、タンパク質の発現に適する条件下で免疫調節タンパク質を適切な細胞において発現することができる。いくつかの態様では、核酸分子または発現ベクターは、適切な発現制御配列に作動可能に連結された免疫調節タンパク質をコードするDNA分子を含む。DNA分子がベクターに挿入される前または後のいずれかに、この機能的連結を達成する方法は周知である。発現制御配列は、プロモーター、アクチベーター、エンハンサー、オペレーター、リボソーム結合部位、開始シグナル、停止シグナル、キャップシグナル、ポリアデニル化シグナル、及び転写または翻訳の制御に関与する他のシグナルを含む。
いくつかの実施形態では、免疫調節タンパク質の発現は、プロモーターまたはエンハンサーによって制御されて、発現を制御または調節する。プロモーターは、バリアントポリペプチドまたは免疫調節タンパク質をコードする核酸分子の部分に作動可能に連結されている。いくつかの実施形態では、プロモーターは、構成的に活性なプロモーター(例えば、組織特異的な構成的に活性なプロモーターまたは他の構成的プロモーター)である。いくつかの実施形態では、プロモーターは、誘導物質(例えば、T細胞活性化シグナル)に応答性であり得る誘導性プロモーターである。
いくつかの実施形態では、構成的プロモーターは、バリアントポリペプチドまたは免疫調節タンパク質をコードする核酸分子に作動可能に連結されている。例示的な構成的プロモーターは、サル空胞ウイルス40(SV40)プロモーター、サイトメガロウイルス(CMV)プロモーター、ユビキチンC(UbC)プロモーター、及びEF−1α(EF1a)プロモーターを含む。いくつかの実施形態では、構成的プロモーターは、組織特異的である。例えば、いくつかの実施形態では、プロモーターは、特定の組織、例えば免疫細胞、リンパ球、またはT細胞における免疫調節タンパク質の構成的発現を可能にする。例えば、フェトタンパク質、DF3、チロシナーゼ、CEA、界面活性タンパク質、及びErbB2プロモーターを含む、例示的な組織特異的プロモーターが米国特許第5,998,205号に記載されている。
いくつかの実施形態では、誘導性プロモーターは、転写の適切な誘導因子の有無を制御することによって核酸の発現が制御可能であるように、バリアントポリペプチドまたは免疫調節タンパク質をコードする核酸分子に作動可能に連結されている。例えば、プロモーターは、コードされたポリペプチドの調節された発現を可能にする、調節されたプロモーター及び転写因子発現系、例えば公開されているテトラサイクリン調節系または他の調節可能な系(例えば、公開されている国際PCT出願WO01/30843を参照のこと)であることができる。例示的な調節可能なプロモーター系は、例えばClontech(Palo Alto,CA)から入手可能なTet−On(及びTet−Off)系である。このプロモーター系は、テトラサイクリンまたはテトラサイクリン誘導体、例えばドキシサイクリンによって制御される、導入遺伝子の調節された発現を可能にする。他の調節可能なプロモーター系が公知である(例えば、リガンド結合ドメイン及び転写調節ドメイン、例えばホルモン受容体由来のものを含有する遺伝子スイッチを説明している「Regulation of Gene Expression Using Single−Chain,Monomeric,Ligand Dependent Polypeptide Switches」という表題の公開されている米国特許出願第2002−0168714号を参照のこと)。
いくつかの実施形態では、プロモーターは、T細胞活性化シグナル伝達に応答性のエレメントに応答性である。単なる一例として、いくつかの実施形態では、操作されたT細胞は、免疫調節タンパク質、及び免疫調節タンパク質の発現を制御するために作動可能に連結されたプロモーターをコードする発現ベクターを含む。操作されたT細胞を、例えば操作されたT細胞受容体(TCR)またはキメラ抗原受容体(CAR)によるシグナル伝達によって活性化することができ、それにより応答性プロモーターによる免疫調節タンパク質の発現及び分泌を引き起こすことができる。
いくつかの実施形態では、誘導性プロモーターは、免疫調節タンパク質が活性化T細胞の核因子(NFAT)または活性化B細胞の核因子κ軽鎖エンハンサー(NF−κB)に応答して発現するように、免疫調節タンパク質をコードする核酸分子に作動可能に連結されている。例えば、いくつかの実施形態では、誘導性プロモーターは、NFATまたはNF−κBの結合部位を含む。例えば、いくつかの実施形態では、プロモーターは、NFATもしくはNF−κBプロモーター、またはその機能的バリアントである。したがって、いくつかの実施形態では、核酸は、免疫調節タンパク質の毒性を低減または排除もしながら、免疫調節タンパク質の発現を制御することを可能にする。具体的には、本発明の核酸を含む操作された免疫細胞は、細胞(例えば、該細胞によって発現されるT細胞受容体(TCR)またはキメラ抗原受容体(CAR))が抗原によって特異的に刺激される際、及び/または、細胞(例えば、細胞のカルシウムシグナル伝達経路)が、例えばホルボールミリスタートアセタート(PMA)/イオノマイシンによって非特異的に刺激される際にのみ、免疫調節タンパク質を発現及び分泌する。したがって、免疫調節タンパク質の発現、及び場合によっては分泌を、それが必要な時及び場合にのみ(例えば、感染症惹起物質、がんの存在下、または腫瘍部位で)起こるように制御することができ、それにより望ましくない免疫調節タンパク質相互作用を減少または回避することができる。
いくつかの実施形態では、本明細書に記載の免疫調節タンパク質をコードする核酸は、NFATプロモーター、NF−κBプロモーター、またはその機能的バリアントをコードする好適なヌクレオチド配列を含む。「NFATプロモーター」は、本明細書において使用される場合、最小プロモーターに連結された1つまたは複数のNFAT応答性エレメントを意味する。「NF−κBプロモーター」は、最小プロモーターに連結された1つまたは複数のNF−κB応答性エレメントを指す。いくつかの実施形態では、遺伝子の最小プロモーターは、最小ヒトIL−2プロモーターまたはCMVプロモーターである。NFAT応答性エレメントは、例えば、NFAT1、NFAT2、NFAT3、及び/またはNFAT4応答性エレメントを含み得る。NFATプロモーター、NF−κBプロモーター、またはその機能的バリアントは、任意の数の結合モチーフ、例えば、少なくとも2個、少なくとも3個、少なくとも4個、少なくとも5個、または少なくとも6個、少なくとも7個、少なくとも8個、少なくとも9個、少なくとも10個、少なくとも11個、または最大で12個の結合モチーフを含み得る。
DNA分子をその上に有する、得られた組換え発現ベクターを使用して、適切な宿主を形質転換する。当技術分野において周知の方法を使用して、この形質転換を実施することができる。いくつかの実施形態では、本明細書において提供される核酸は、得られる可溶性免疫調節ポリペプチドが培養培地、宿主細胞、または宿主細胞ペリプラズムから回収されるように、免疫調節ポリペプチドをコードする核酸に作動可能に連結された分泌型またはシグナルペプチドをコードするヌクレオチド配列をさらに含む。他の実施形態では、免疫調節ポリペプチドの膜発現が可能となるように適切な発現制御シグナルが選択される。さらに、市販のキット及び委託製造会社を利用して、本明細書において提供される操作された細胞または組換え宿主細胞を作製することもできる。
いくつかの実施形態では、DNA分子をその上に有する得られた発現ベクターを使用して、適切な細胞を形質転換、例えば形質導入する。導入は、当技術分野において周知の方法を使用して実施することができる。例示的な方法は、ウイルス、例えば、レトロウイルスまたはレンチウイルス、形質導入、トランスポゾン、及びエレクトロポレーションを介することを含む、受容体をコードする核酸の移送のためのものを含む。いくつかの実施形態では、発現ベクターは、ウイルスベクターである。いくつかの実施形態では、核酸は、レンチウイルスまたはレトロウイルス形質導入法によって細胞に移送される。
哺乳動物T細胞またはAPCを含む、多数の公的に入手可能かつ周知の哺乳動物宿主細胞のいずれかを、ポリペプチドまたは操作された細胞の調製に使用することができる。細胞の選択は、当技術分野によって認識される多数の要因に依存する。これらには、例えば、選択された発現ベクターとの適合性、DNA分子によってコードされたペプチドの毒性、形質転換率、ペプチドの回収の容易さ、発現特性、生物安全性及びコストが含まれる。全ての細胞が特定のDNA配列の発現に等しく有効であるとは限らないという理解をもって、これらの要因のバランスをとらねばならない。
いくつかの実施形態では、宿主細胞は、酵母細胞のような多種多様な真核細胞、またはチャイニーズハムスター卵巣(CHO)細胞もしくはHEK293細胞のような哺乳動物細胞であることができる。いくつかの実施形態では、宿主細胞は懸濁細胞であり、ポリペプチドは培養浮遊CHO細胞、例えばCHO−S細胞などの培養懸濁液で操作または産生される。いくつかの実施例では、細胞株は、DHFRが欠損している(DHFR−)CHO細胞株、例えばDG44及びDUXB11である。いくつかの実施形態では、細胞は、グルタミンシンターゼ(GS)、例えばCHO−S細胞、CHOK1 SV細胞、及びCHOZN((R))GS−/−細胞を欠損している。いくつかの実施形態では、CHO細胞、例えば浮遊CHO細胞は、CHO−S−2H2細胞、CHO−S−クローン14細胞、またはExpiCHO−S細胞であってもよい。
いくつかの実施形態では、宿主細胞はまた、原核細胞、例えば大腸菌であることもできる。形質転換された組換え宿主は、ポリペプチドを発現する条件下で培養され、次いで精製されて可溶性タンパク質を得る。組換え宿主細胞を、所望のポリペプチドを発現するような従来の発酵条件下で培養することができる。そのような発酵条件は、当技術分野において周知である。最後に、本明細書において提供されるポリペプチドを、硫酸アンモニウムまたはエタノール沈殿、酸抽出、陰イオンまたは陽イオン交換クロマトグラフィー、ホスホセルロースクロマトグラフィー、疎水性相互作用クロマトグラフィー、及び親和性クロマトグラフィーを含む当技術分野において周知の多数の方法のいずれかによって、組換え細胞培養物から回収及び精製することができる。所望の場合、成熟タンパク質の配置を完了する際にタンパク質のリフォールディングステップを使用することができる。最後に、高速液体クロマトグラフィー(HPLC)を最終精製ステップに用いることができる。
いくつかの実施形態では、細胞は、免疫細胞、例えば操作された細胞の調製と関連して上記のいずれかである。いくつかの実施形態では、そのような操作された細胞は、初代細胞である。いくつかの実施形態では、操作された細胞は、対象に対して自家である。操作された細胞は、対象に対して同種である。いくつかの実施形態では、操作された細胞を、対象から、例えば白血球除去療法によって得て、これを免疫調節ポリペプチド、例えば膜貫通型免疫調節ポリペプチドまたは分泌可能な免疫調節ポリペプチドの発現のためにex vivoで形質転換する。
また、本明細書に記載の感染性物質に含有されるバリアント免疫調節ポリペプチドのいずれかをコードする核酸も提供される。いくつかの実施形態では、感染性物質は、核酸を対象の細胞に送達し、及び/または細胞においてコードされたバリアントポリペプチドの発現を可能にする。また、そのような感染性物質を生成する、産生する、または改変するために使用される核酸も提供される。例えば、いくつかの実施形態では、感染性物質の生成、対象の細胞への送達、及び/または対象の細胞におけるバリアント免疫調節ポリペプチドの発現のための、バリアント免疫調節ポリペプチドをコードする核酸を含有するベクター及び/またはプラスミドが提供される。
いくつかの実施形態では、提供される核酸は、バリアント免疫調節ポリペプチドをコードする核酸配列を含有する、組換えウイルスまたは細菌ベクターである。いくつかの実施形態では、組換えベクターを使用して、バリアント免疫調節ポリペプチドをコードする核酸配列を含有する感染性物質を産生することができる、及び/または、標的細胞による発現のために対象の標的細胞に送達することができる。いくつかの実施形態では、組換えベクターは、発現ベクターである。いくつかの実施形態では、組換えベクターは、感染性物質の生成及び/または産生ならびに標的細胞における発現に必要な適切な配列を含む。
いくつかの実施形態では、組換えベクターは、プラスミドまたはコスミドである。本明細書に記載されるバリアント免疫調節ポリペプチドをコードする核酸配列を含有するプラスミドまたはコスミドは、当技術分野において周知の標準的な技術を使用して容易に構築される。感染性物質の生成のために、ベクターまたはゲノムをプラスミド形態で構築することができ、これを次いで、パッケージングもしくは産生細胞株または宿主細菌へトランスフェクトすることができる。組換えベクターは、当技術分野において公知の組換え技術のいずれかを使用して生成することができる。いくつかの実施形態では、ベクターは、原核生物の複製起点、及び/または、発現が検出可能または選択可能マーカー(例えば原核生物系における伝播及び/または選択のための薬剤耐性)を付与する遺伝子を含むことができる。
いくつかの実施形態では、組換えベクターは、ウイルスベクターである。例示的な組換えウイルスベクターは、レンチウイルスベクターゲノム、ポックスウイルスベクターゲノム、ワクシニアウイルスベクターゲノム、アデノウイルスベクターゲノム、アデノウイルス随伴ウイルスベクターゲノム、ヘルペスウイルスベクターゲノム、及びアルファウイルスベクターゲノムを含む。ウイルスベクターは、生ウイルスベクター、弱毒化ウイルスベクター、複製条件付き(replication conditional)もしくは複製欠損ウイルスベクター、非病原性(欠陥)ウイルスベクター、複製能力のあるウイルスベクターであることができ、及び/または、異種の遺伝子産物、例えば、本明細書において提供されるバリアント免疫調節ポリペプチドを発現するように改変される。ウイルスの生成のためのベクターはまた、転写または翻訳負荷を増加または低減する任意の方法を含む、ウイルスの弱毒化を変化させるように改変することもできる。
使用することができる例示的なウイルスベクターは、改変されたワクシニアウイルスベクター(例えば、Guerra et al.,J.Virol.80:985−98(2006);Tartaglia et al.,AIDS Research and Human Retroviruses 8:1445−47(1992);Gheradi et al.,J.Gen.Virol.86:2925−36(2005);Mayr et al.,Infection 3:6−14(1975);Hu et al.,J.Virol.75:10300−308(2001);米国特許第5,698,530号、第6,998,252号、第5,443,964号、第7,247,615号及び第7,368,116号を参照のこと);アデノウイルスベクターまたはアデノウイルス随伴ウイルスベクター(例えば、Molin et al.,J.Virol.72:8358−61(1998);Narumi et al.,Am J.Respir.Cell Mol.Biol.19:936−41(1998);Mercier et al.,Proc.Natl.Acad.Sci.USA 101:6188−93(2004);米国特許第6,143,290号;第6,596,535号;第6,855,317号;第6,936,257号;第7,125,717号;第7,378,087号;第7,550,296号を参照のこと);ネズミ白血病ウイルス(MuLV)、テナガザル白血病ウイルス(GaLV)、エコトロピックレトロウイルス、サル免疫不全ウイルス(SIV)、ヒト免疫不全ウイルス(HIV)、及び組み合わせに基づくものを含むレトロウイルスベクター(例えば、Buchscher et al.,J.Virol.66:2731−39(1992);Johann et al.,J.Virol.66:1635−40(1992);Sommerfelt et al.,Virology 176:58−59(1990);Wilson et al.,J.Virol.63:2374−78(1989);Miller et al.,J.Virol.65:2220−24(1991);Miller et al.,Mol.Cell Biol.10:4239(1990);Kolberg,NIH Res.4:43 1992;Cornetta et al.,Hum.Gene Ther.2:215(1991)を参照のこと);ヒト免疫不全ウイルス(HIV−1)、HIV−2、ネコ免疫不全ウイルス(FIV)、馬伝染性貧血ウイルス、サル免疫不全ウイルス(SIV)、及びマエディ/ビスナウイルスに基づくものを含むレンチウイルスベクター(例えば、Pfeifer et al.,Annu.Rev.Genomics Hum.Genet.2:177−211(2001);Zufferey et al.,J.Virol.72:9873,1998;Miyoshi et al.,J.Virol.72:8150,1998;Philpott and Thrasher,Human Gene Therapy 18:483,2007;Engelman et al.,J.Virol.69:2729,1995;Nightingale et al.,Mol.Therapy,13:1121,2006;Brown et al.,J.Virol.73:9011(1999);WO2009/076524;WO2012/141984;WO2016/011083;McWilliams et al.,J.Virol.77:11150,2003;Powell et al.,J.Virol.70:5288,1996を参照のこと)もしくはその任意のバリアント、及び/または上記のウイルスのいずれかを生成するために使用することができるベクターを含む。いくつかの実施形態では、組換えベクターは、例えばRNAウイルスの場合、パッケージング細胞株において、ウイルスゲノムの発現を調節することができる、調節配列、例えばプロモーターまたはエンハンサー配列を含むことができる(例えば、米国特許第5,385,839号及び第5,168,062号を参照のこと)。
いくつかの実施形態では、組換えベクターは、発現ベクター、例えば、標的細胞、例えば対象の細胞、例えば腫瘍細胞、免疫細胞及び/またはAPCに送達された際にコードされた遺伝子産物の発現を可能にする発現ベクターである。いくつかの実施形態では、感染性物質に含有される組換え発現ベクターは、タンパク質の発現に適する条件下で、対象の標的細胞において免疫調節タンパク質を発現することができる。
いくつかの態様では、核酸または発現ベクターは、適切な発現制御配列に作動可能に連結された免疫調節タンパク質をコードする核酸配列を含む。免疫調節タンパク質をコードする核酸配列がベクターに挿入される前または後のいずれかに、この機能的連結に作用する方法は周知である。発現制御配列は、プロモーター、アクチベーター、エンハンサー、オペレーター、リボソーム結合部位、開始シグナル、停止シグナル、キャップシグナル、ポリアデニル化シグナル、及び転写または翻訳の制御に関与する他のシグナルを含む。プロモーターは、免疫調節タンパク質をコードする核酸配列の部分に作動可能に連結されることができる。いくつかの実施形態では、プロモーターは、標的細胞における構成的に活性なプロモーター(例えば、組織特異的な構成的に活性なプロモーターまたは他の構成的プロモーター)である。例えば、組換え発現ベクターはまた、リンパ組織特異的な転写調節エレメント(TRE)、例えばBリンパ球、Tリンパ球、または樹状細胞特異的なTREも含み得る。リンパ組織特異的TREは、当技術分野において公知である(例えば、Thompson et al.,Mol.Cell.Biol.12:1043−53(1992);Todd et al.,J.Exp.Med.177:1663−74(1993);Penix et al.,J.Exp.Med.178:1483−96(1993)を参照のこと)。いくつかの実施形態では、プロモーターは、誘導物質(例えば、T細胞活性化シグナル)に応答性であり得る誘導性プロモーターである。いくつかの実施形態では、対象の標的細胞、例えば腫瘍細胞、免疫細胞及び/またはAPCに送達される核酸は、上記の調節エレメントのいずれかに作動可能に連結されることができる。
いくつかの実施形態では、ベクターは、細菌ベクター、例えば細菌プラスミドまたはコスミドである。いくつかの実施形態では、細菌ベクターは、哺乳動物細胞へのプラスミドDNAの細菌媒介性移送(「バクトフェクション」とも称される)を介して、標的細胞、例えば腫瘍細胞、免疫細胞及び/またはAPCに送達される。いくつかの実施形態では、送達される細菌ベクターはまた、標的細胞における発現のための適切な発現制御配列、例えばプロモーター配列及び/またはエンハンサー配列、または上記の任意の調節もしくは制御配列のうちのいずれかを含有する。いくつかの実施形態では、細菌ベクターは、感染性物質、例えば、細菌におけるコードされたバリアントポリペプチドの発現及び/または分泌のための適切な発現制御配列を含有する。
いくつかの実施形態では、本明細書において提供されるポリペプチドは、合成法によって作製することもできる。固相合成は、小ペプチドを作製する最も費用効果の高い方法であるので、個々のペプチドを作製する好ましい技術である。例えば、周知の固相合成技術は、保護基、リンカー、及び固相支持体の使用、ならびに特定の保護及び脱保護反応条件、リンカー切断条件、スカベンジャーの使用、及び固相ペプチド合成の他の態様を含む。次いで、ペプチドは本明細書において提供されるとおりポリペプチドへと会合することができる。
IV.バリアントCD80ポリペプチド及び免疫調節タンパク質の免疫調節活性を評価する方法
いくつかの実施形態では、本明細書において提供されるバリアントCD80ポリペプチド(その完全長及び/または特異的結合断片またはコンジュゲート、スタック構築物または誘導体または操作された細胞)は、T細胞活性化を調節する免疫調節活性を示す。いくつかの実施形態では、CD80ポリペプチドは、T細胞アッセイにおいて、野生型または非改変CD80対照と比べてIFN−γ発現を調節する。場合によっては、IFN−γ発現の調節は、対照と比べて、IFN−γ発現を増加または減少させることができる。特異的結合及びIFN−γ発現を決定するアッセイは、当技術分野において周知であり、培養上清中のインターフェロン−γサイトカインレベルを測定するMLR(混合リンパ球反応)アッセイ(Wang et al.,Cancer Immunol Res.2014 Sep:2(9):846−56)、SEB(ブドウ球菌エンテロトキシンB(staphylococcal enterotoxin B))T細胞刺激アッセイ(Wang et al.,Cancer Immunol Res.2014 Sep:2(9):846−56)、及び抗CD3 T細胞刺激アッセイ(Li and Kurlander,J Transl Med.2010:8:104)を含む。
いくつかの実施形態では、バリアントCD80ポリペプチドは、初代T細胞アッセイにおいて、野生型CD80対照と比べてIFN−γ(インターフェロン−γ)発現を、いくつかの実施形態において増加させることができ、またはその他の実施形態において減少させることができる。いくつかの実施形態では、そのような活性は、バリアントCD80ポリペプチドが拮抗活性の形態で提供されるか、または作動活性の形態で提供されるかに依存し得る。いくつかの実施形態では、バリアントCD80ポリペプチドまたは免疫調節タンパク質は、活性化刺激、例えばCD3及び/またはCD28共刺激シグナルまたは分裂促進シグナルに対する応答を低下させるために起こり得る細胞内の阻害性シグナルを遮断するなど、阻害性受容体の拮抗物質である。当業者は、IFN−γ発現の増減を決定するために使用される初代T細胞アッセイの異なるフォーマットを認識するだろう。
初代T細胞アッセイにおいてIFN−γ発現を増減させるバリアントCD80の能力をアッセイする際に、混合リンパ球反応(MLR)アッセイを使用することができる。いくつかの実施形態では、拮抗物質形態、例えば可溶性形態で提供されるバリアントCD80ポリペプチドまたは免疫調節タンパク質、例えばバリアントCD80−Fcまたは分泌可能な免疫調節タンパク質は、CTLA−4阻害性受容体またはPD−L1の活性を遮断し、これによりアッセイにおいてIFN−γの産生の増加によって観察されるようにアッセイにおいてMLR活性アッセイを増加させる。いくつかの実施形態では、作動物質形態で提供されるバリアントCD80ポリペプチドまたは免疫調節タンパク質、例えば腫瘍局在化部分または提供される膜貫通型免疫調節タンパク質を発現する操作された細胞を含有する局在化vIgDスタックまたはコンジュゲートは、CTLA−4阻害性受容体の活性を刺激し得、これによりIFN−γ産生の減少によって明らかであるようにMLR活性を減少させる。いくつかの実施形態では、作動物質形態で提供されるバリアントCD80ポリペプチドまたは免疫調節タンパク質、例えば腫瘍局在化部分または提供される膜貫通型免疫調節タンパク質を発現する操作された細胞を含有する局在化vIgDスタックまたはコンジュゲートは、CTLA−4阻害性受容体の活性を遮断し得、これによりIFN−γ産生の増加など、MLR活性を増加させる。
あるいは、初代T細胞アッセイにおいてIFN−γ発現の増減を調節するバリアントCD80の能力をアッセイする際に、共固定アッセイを使用することができる。共固定アッセイでは、TCRシグナル(いくつかの実施形態では、抗CD3抗体によって提供される)を共固定されたバリアントCD80と併用して、CD80の非改変または野生型対照と比べたIFN−γ発現を増減させる能力を決定する。いくつかの実施形態では、バリアントCD80ポリペプチドまたは免疫調節タンパク質、例えば、共固定されたバリアントCD80(例えば、CD80−Fc)は、共固定アッセイにおいてIFN−γの産生を増加させる。
いくつかの実施形態では、IFN−γ発現の増減を調節するバリアントCD80の能力をアッセイする際に、T細胞レポーターアッセイを使用することができる。いくつかの実施形態では、T細胞は、Jurkat T細胞株であるか、またはJurkat T細胞株に由来する。レポーターアッセイでは、レポーター細胞株(例えば、Jurkatレポーター細胞)も生成され、バリアントIgSFドメインポリペプチドのコグネイト結合パートナーである阻害性受容体を過剰発現する。例えば、バリアントCD80の場合、レポーター細胞株(例えば、Jurkatレポーター細胞)が生成され、CTLA−4を過剰発現する。いくつかの実施形態では、レポーターT細胞はまた、レポーターに作動可能に連結されたT細胞活性化に応答する誘導性プロモーターをレポーター構築物も含有する。いくつかの実施形態では、レポーターは、蛍光または発光レポーターである。いくつかの実施形態では、レポーターは、ルシフェラーゼである。いくつかの実施形態では、プロモーターは、CD3シグナル伝達に応答する。いくつかの実施形態では、プロモーターは、NFATプロモーターである。いくつかの実施形態では、プロモーターは、共刺激シグナル伝達、例えばCD28共刺激シグナル伝達に応答する。いくつかの実施形態では、プロモーターは、IL−2プロモーターである。
レポーターアッセイの態様では、レポーター細胞株は、阻害性受容体の野生型リガンド、例えばCD80を発現する抗原提示細胞(APC)との共インキュベーションなどにより刺激される。いくつかの実施形態では、APCは、人工APCである。人工APCは、当業者に周知である。いくつかの実施形態では、人工APCは、1つまたは複数の哺乳動物細胞株、例えばK562、CHO、293細胞に由来する。いくつかの実施形態では、人工APCは、抗CD3抗体を発現するように操作されており、場合によっては、共刺激リガンドである。いくつかの実施形態では、人工APCは、バリアントIgSFドメインポリペプチドのコグネイト結合パートナーを過剰発現するために生成される。例えば、バリアントCD80の場合、レポーター細胞株(例えば、Jurkatレポーター細胞)は、阻害性リガンドPD−L1を過剰発現するために生成される。
いくつかの実施形態では、Jurkatレポーター細胞は、バリアントIgSFドメイン分子または免疫調節タンパク質、例えばバリアントCD80ポリペプチドまたは免疫調節タンパク質の存在下で阻害性リガンドを過剰発現する人工APCと共インキュベートされる。いくつかの実施形態では、レポーターの発現は、細胞の発光または蛍光を測定するなどして監視される。いくつかの実施形態では、阻害性受容体とリガンド間の正常な相互作用により、対照(例えば、阻害性受容体及びリガンドの相互作用が存在しない対照T細胞とAPC(例えば、CD80を過剰発現しないAPC)の共インキュベーションによるレポーター発現など)と比較してレポーターシグナルの阻害または減少がもたらされる。いくつかの実施形態では、本明細書で提供されるバリアントCD80ポリペプチドまたは免疫調節タンパク質は、例えばバリアントCD80−Fcとして可溶性形態で提供される場合、または分泌可能な免疫調節タンパク質としてAPCから発現される場合、相互作用に拮抗し、これにより、バリアントCD80ポリペプチドまたは免疫調節タンパク質が存在しない場合と比較して、レポーターシグナルが増加する。本明細書で提供される、ある特定の実施形態では、バリアントCD80ポリペプチドまたは免疫調節タンパク質は、例えばバリアントCD80−Fcとして可溶性形態で提供される場合、PD−L1依存性CD28共刺激などのCD28作動作用を媒介し、これにより、バリアントCD80ポリペプチドまたは免疫調節タンパク質が存在しない場合と比較して、レポーターシグナルが増加する。場合によっては、本明細書で提供されるようなバリアントCD80ポリペプチドまたは免疫調節タンパク質の特定のフォーマットは、阻害性受容体の作動活性をもたらし得、これにより、バリアントCD80ポリペプチドまたは免疫調節タンパク質が存在しない場合と比較して、レポーター発現が減少する。
適切な対照の使用は当業者に公知であるが、前述の実施形態では、対照は、典型的には、非改変CD80、例えばバリアントCD80が由来したまたは発生したのと同じ哺乳動物種由来の野生型の天然CD80アイソフォームの使用を伴う。いくつかの実施形態では、野生型または天然CD80は、バリアントと同じ形態または対応する形態のものである。例えば、バリアントCD80がFcタンパク質に融合したバリアントECDを含有する可溶性形態である場合、対照はFcタンパク質に融合したCD80の野生型または天然ECDを含有する可溶性形態である。1つまたは複数のCTLA−4及びCD80のいずれかに対する結合親和性及び/または選択性が増加または減少するかどうかに関係なく、バリアントCD80は、T細胞アッセイにおいて、野生型CD80対照と比べてIFN−γ発現を、いくつかの実施形態において増加させ、そしてその他の実施形態において減少させる。
いくつかの実施形態では、バリアントCD80ポリペプチドまたは免疫調節タンパク質は、野生型または非改変CD80対照と比べて、IFN−γ発現(すなわち、タンパク質発現)を少なくとも5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、またはより多く増加させる。他の実施形態では、バリアントCD80または免疫調節タンパク質は、野生型または非改変CD80対照と比べて、IFN−γ発現(すなわち、タンパク質発現)を少なくとも5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、またはより多く減少させる。いくつかの実施形態では、野生型CD80対照は、野生型ネズミCD80配列の配列から配列が変化したバリアントCD80に典型的に使用されるような、ネズミCD80である。いくつかの実施形態では、野生型CD80対照は、SEQ ID NO:1、SEQ ID NO:2またはSEQ ID NO:76またはSEQ ID NO:150またはSEQ ID NO:3030またはSEQ ID NO:3031のアミノ酸配列を含むCD80配列などの対応する野生型ヒトCD80配列の配列から配列が変化したバリアントCD80に典型的に使用されるような、ヒトCD80である。
V.薬学的製剤
本明細書に記載のバリアントCD80ポリペプチド、免疫調節タンパク質、コンジュゲート、操作された細胞または感染性物質のいずれかを含有する組成物が本明細書において提供される。薬学的組成物は、薬学的に許容し得る賦形剤をさらに含むことができる。例えば、薬学的組成物は、例えば、組成物のpH、モル浸透圧濃度、粘性、透明性、色、等張性、臭気、無菌性、安定性、溶解もしくは放出の速度、吸着または浸透を、修正、維持、または保存するための1つまたは複数の賦形剤を含有することができる。いくつかの態様では、当業者は、細胞を含有する薬学的組成物がタンパク質を含有する薬学的組成物と異なってよいことを理解する。
いくつかの実施形態では、薬学的組成物は、固体、例えば散剤、カプセル剤、または錠剤である。例えば、薬学的組成物の成分は、凍結乾燥することができる。いくつかの実施形態では、固体薬学的組成物は、投与の前に液体中で再構成されるかまたは溶解される。
いくつかの実施形態では、薬学的組成物は、液体、例えば、水溶液(例えば、生理食塩水またはリンゲル液)に溶解されたバリアントCD80ポリペプチドである。いくつかの実施形態では、薬学的組成物のpHは、約4.0〜約8.5(例えば、約4.0〜約5.0、約4.5〜約5.5、約5.0〜約6.0、約5.5〜約6.5、約6.0〜約7.0、約6.5〜約7.5、約7.0〜約8.0、または約7.5〜約8.5)である。
いくつかの実施形態では、薬学的組成物は、薬学的に許容し得る賦形剤、例えば充填剤、結合剤、コーティング剤、保存剤、滑沢剤、着香料、甘味剤、着色剤、溶媒、緩衝剤、キレート剤、または安定剤を含む。薬学的に許容し得る充填剤の例は、セルロース、第二リン酸カルシウム、炭酸カルシウム、微結晶セルロース、スクロース、ラクトース、グルコース、マンニトール、ソルビトール、マルトール、アルファ化デンプン、トウモロコシデンプン、またはジャガイモデンプンを含む。薬学的に許容し得る結合剤の例は、ポリビニルピロリドン、デンプン、ラクトース、キシリトール、ソルビトール、マルチトール、ゼラチン、スクロース、ポリエチレングリコール、メチルセルロース、またはセルロースを含む。薬学的に許容し得るコーティング剤の例は、ヒドロキシプロピルメチルセルロース(HPMC)、シェラック、トウモロコシタンパク質ゼイン、またはゼラチンを含む。薬学的に許容し得る崩壊剤の例は、ポリビニルピロリドン、カルボキシメチルセルロース、またはデンプングリコール酸ナトリウムを含む。薬学的に許容し得る滑沢剤の例は、ポリエチレングリコール、ステアリン酸マグネシウム、またはステアリン酸を含む。薬学的に許容し得る保存剤の例は、メチルパラベン、エチルパラベン、プロピルパラベン、安息香酸、またはソルビン酸を含む。薬学的に許容し得る甘味剤の例は、スクロース、サッカリン、アスパルテーム、またはソルビトールを含む。薬学的に許容し得る緩衝剤の例は、炭酸塩、クエン酸塩、グルコン酸塩、酢酸塩、リン酸塩、または酒石酸塩を含む。
いくつかの実施形態では、薬学的組成物は、産物の制御放出または徐放性のための物質、例えば注射用マイクロスフェア、生体内分解性粒子、高分子化合物(ポリ乳酸、ポリグリコール酸)、ビーズ、またはリポソームをさらに含む。
いくつかの実施形態では、薬学的組成物は、滅菌されている。滅菌は、滅菌濾過膜に通す濾過、または照射によって達成してよい。組成物が凍結乾燥される場合、この方法を使用した滅菌は、凍結乾燥及び再構成の前に実行してもその後に実行してもよい。非経口投与用組成物は、凍結乾燥形態で貯蔵しても溶液で貯蔵してもよい。加えて、非経口組成物は、一般的に滅菌アクセスポートを有する容器、例えば皮下注射針で貫通可能なストッパーを有する静注液バッグまたはバイアルへと入れられる。
いくつかの実施形態では、膜貫通型免疫調節タンパク質であって、そのような膜貫通型免疫調節タンパク質を発現する操作された細胞を含む、膜貫通型免疫調節タンパク質を含有する薬学的組成物が提供される。いくつかの実施形態では、薬学的組成物及び製剤は、1つまたは複数の任意の薬学的に許容し得る担体または賦形剤を含む。そのような組成物は、緩衝剤、例えば中性の緩衝生理食塩水、リン酸緩衝生理食塩水など;糖質、例えばグルコース、マンノース、スクロースまたはデキストラン、マンニトール;タンパク質;ポリペプチドまたはアミノ酸、例えばグリシン;酸化防止剤;キレート剤、例えばEDTAまたはグルタチオン;補助剤(例えば、水酸化アルミニウム);及び保存剤を含み得る。本発明の組成物は、好ましくは、静脈内投与用に製剤化される。
そのような製剤は、例えば、静脈内注射に好適な形態であり得る。薬学的に許容し得る担体は、1つの組織、臓器、または身体の一部から別の組織、臓器、または身体の一部への関心対象の細胞の運搬または輸送に関与する、薬学的に許容し得る材料、組成物、またはビヒクルであり得る。例えば、担体は、液体または固体の充填剤、希釈剤、賦形剤、溶媒、もしくは封入材料、またはいくつかのそれらの組み合わせであり得る。担体の各成分は、製剤のその他の有効成分と適合可能でなければならないという点で「薬学的に許容し得る」でなければならない。それはまた、その治療効果を過度に上回る毒性、刺激、アレルギー応答、免疫原性、または任意の他の合併症のリスクを有するべきではないという意味で、直面し得るあらゆる組織、臓器、または身体の一部との接触に好適でなければならない。
いくつかの実施形態では、薬学的組成物は、対象に投与される。一般的に、薬学的組成物の投与量及び投与経路は、対象のサイズ及び状態に応じて、標準的な薬務に従って決定される。例えば、最初に、細胞培養アッセイまたはマウス、ラット、ウサギ、イヌ、ブタ、もしくはサルのような動物モデルのいずれかで治療的有効用量を推定することができる。適切な濃度範囲及び投与経路を決定するために動物モデルを使用してもよい。次いで、そのような情報を使用して、ヒトにおける有用な用量及び投与経路を決定することができる。正確な投与量は、対象が必要とする治療に関連する要因に照らして決定される。投与量及び投与は、活性化合物の十分なレベルを提供するように、または所望の効果を維持するように調整される。考慮され得る要因は、疾患状態の重症度、対象の通常の健康状態、対象の年齢、体重、及び性別、投与の時間及び頻度、薬物併用、反応感受性、ならびに治療への応答を含む。
長時間作用性薬学的組成物は、特定の製剤の半減期及びクリアランス速度に応じて、3〜4日毎、毎週、または隔週で投与してもよい。投薬頻度は、使用される製剤中の分子の薬物動態パラメータに依存する。典型的には、組成物は、所望の効果を達成する投与量に達するまで投与される。したがって、該組成物を単回用量としてまたは複数回用量として(同じまたは異なる濃度/投与量で)経時的に、または持続注入として投与してよい。適切な投与量のさらなる改良が日常的になされる。適切な投与量は、適切な用量―応答データを使用することによって確認され得る。T細胞活性化もしくは増殖、サイトカイン合成もしくは産生(例えば、TNF−α、IFN−γ、IL−2の産生)、様々な活性化マーカー(例えば、CD25、IL−2受容体)の誘導、炎症、関節の腫脹もしくは圧痛、C−反応性タンパク質の血清レベル、抗コラーゲン抗体産生、及び/またはT細胞依存性抗体応答を含む、治療効果についての多数のバイオマーカーまたは生理学的マーカーをモニタリングすることができる。
いくつかの実施形態では、薬学的組成物は、経口、経皮、吸入による、静脈内、動脈内、筋肉内、創傷部位への直接適用、手術部位への適用、腹腔内、坐剤による、皮下、皮内、経皮、噴霧による、胸膜内、脳室内、関節内、眼内、または髄腔内を含む、任意の経路を通して対象に投与される。
いくつかの実施形態では、薬学的組成物の投与は、単回投与または反復投与である。いくつかの実施形態では、1日1回、1日2回、1日3回、または1日4回以上、対象に投与される。いくつかの実施形態では、1週間に約1用量以上(例えば、約2用量以上、約3用量以上、約4用量以上、約5用量以上、約6用量以上、または約7用量以上)が与えられる。いくつかの実施形態では、複数回用量が、数日、数週間、数ヶ月間、または数年間にわたって与えられる。いくつかの実施形態では、一連の処置は、約1用量以上(例えば、約2用量以上、約3用量以上、約4用量以上、約5用量以上、約7用量以上、約10用量以上、約15用量以上、約25用量以上、約40用量以上、約50用量以上、または約100用量以上)である。
いくつかの実施形態では、投与される薬学的組成物の用量は、対象の体重1kg当たりタンパク質約1μg以上(例えば、対象の体重1kg当たりタンパク質約2μg以上、対象の体重1kg当たりタンパク質約5μg以上、対象の体重1kg当たりタンパク質約10μg以上、対象の体重1kg当たりタンパク質約25μg以上、対象の体重1kg当たりタンパク質約50μg以上、対象の体重1kg当たりタンパク質約100μg以上、対象の体重1kg当たりタンパク質約250μg以上、対象の体重1kg当たりタンパク質約500μg以上、対象の体重1kg当たりタンパク質約1mg以上、対象の体重1kg当たりタンパク質約2mg以上、または対象の体重1kg当たりタンパク質約5mg以上)である。
いくつかの実施形態では、細胞組成物の治療量が投与される。典型的には、投与されるべき本発明の組成物の正確な量は、患者(対象)の、年齢、体重、腫瘍サイズ、感染または転移の範囲、及び状態の個々の違いを考慮して医師が決定することができる。一般的に、本明細書に記載される操作された細胞、例えばT細胞を含む薬学的組成物を、104〜109個の細胞/kg体重、例えば105〜106個の細胞/kg体重の投与量(これらの範囲内の全ての整数値を含む)で投与してよいと記載することができる。操作された細胞組成物、例えばT細胞組成物をこれらの投与量で複数回投与してもよい。該細胞を、免疫療法において通常知られている注入技術を使用することによって投与することができる(例えば、Rosenberg et al,New Eng.J.of Med.319:1676,1988を参照のこと)。特定の患者に対する最適な投与量及び処置レジメンは、医薬分野の当業者が、患者の疾患の兆候をモニタリングし、それに応じて処置を調整することによって、容易に決定することができる。
いくつかの実施形態では、薬学的組成物は、免疫調節バリアントポリペプチドをコードする核酸配列を含有する感染性物質を含有する。いくつかの実施形態では、薬学的組成物は、処置に好適である対象への投与に好適な感染性物質の用量を含有する。いくつかの実施形態では、薬学的組成物は、ウイルスである感染性物質を、1×105〜1×1012もしくは約1×105〜約1×1012プラーク形成単位(pfu)、1×106〜1×1010pfuもしくは約1×106〜約1×1010pfu、または1×107〜1×1010pfuもしくは約1×107〜約1×1010pfu各々包含する、例えば、少なくとも、または少なくとも約、または約1×106、1×107、1×108、1×109、2×109、3×109、4×109、5×109pfuまたは約1×1010pfuの単一または複数の投与量で含有する。いくつかの実施形態では、薬学的組成物は、105〜1010もしくは約105〜約1010pfu/mL、例えば、5×106〜5×109もしくは約5×106〜約5×109、または1×107〜1×109もしくは約1×107〜約1×109pfu/mL、例えば、少なくとも、または少なくとも約、または約、106pfu/mL、107pfu/mL、108pfu/mLまたは109pfu/mLのウイルス濃度を含有することができる。いくつかの実施形態では、薬学的組成物は、細菌である感染性物質を、1×103〜1×109もしくは約1×103〜約1×109コロニー形成単位(cfu)、1×104〜1×109cfuもしくは約1×104〜約1×109cfu、または1×105〜1×107cfuもしくは約1×105〜約1×107cfuを各々包含する、例えば、少なくとも、または少なくとも約、または約、1×104、1×105、1×106、1×107、1×108または1×109cfuの単一または複数の投与量で含有する。いくつかの実施形態では、薬学的組成物は、103〜108もしくは約103〜約108cfu/mL、例えば、5×105〜5×107もしくは約5×105〜約5×107、または1×106〜1×107もしくは約1×106〜約1×107cfu/mL、例えば、少なくとも、または少なくとも約、または約、105cfu/mL、106cfu/mL、107cfu/mLまたは108cfu/mLの細菌濃度を含有することができる。
望ましくない免疫応答を媒介するもしくは媒介することができる免疫細胞を排除、隔離、もしくは不活性化すること;防御免疫応答を媒介するもしくは媒介することができる免疫細胞を誘導、生成、もしくは刺激すること;免疫細胞の物理的もしくは機能的特性を変化させること;またはこれらの効果の組み合わせによって、本発明の治療用組成物の投与が免疫活性を十分に調節するかどうかを決定するための多種多様な手段が公知である。免疫活性の調節の測定例は、限定されないが、免疫細胞集団の有無の検査(フローサイトメトリー、免疫組織化学、組織診、電子顕微鏡法、ポリメラーゼ連鎖反応(PCR)を使用する);シグナルに応答して増殖もしくは分化する能力または増殖もしくは分化への抵抗性を含む、免疫細胞の機能的能力の測定(例えば、T細胞増殖アッセイ、及び抗CD3抗体、抗T細胞受容体抗体、抗CD28抗体、カルシウムイオノフォア、PMA(ホルボール12−ミリスタート13−アセタート)、ペプチドまたはタンパク質抗原を負荷した抗原提示細胞で刺激後の3H−チミジン取り込みに基づいたpepscan分析;B細胞増殖アッセイを使用する);他の細胞を殺傷または溶解する能力の測定(例えば、細胞傷害性T細胞アッセイ);サイトカイン、ケモカイン、細胞表面分子、抗体及び細胞の他の産物の測定(例えば、フローサイトメトリー、酵素結合免疫吸着アッセイ、ウェスタンブロット分析、タンパク質マイクロアレイ分析、免疫沈降分析による);免疫細胞または免疫細胞内のシグナル伝達経路の活性化の生化学マーカーの測定(例えば、チロシン、セリンまたはスレオニンのリン酸化、ポリペプチド切断、及びタンパク質複合体の形成または解離のウェスタンブロット及び免疫沈降分析;タンパク質アレイ分析;DNAアレイまたはサブトラクティブハイブリダイザーションを使用するDNA転写プロファイリング);アポトーシス、壊死または他の機序による細胞死の測定(例えば、アネキシンV染色、TUNELアッセイ、DNAラダリングを測定するゲル電気泳動、組織診;蛍光発生カスパーゼアッセイ、カスパーゼ基質のウェスタンブロット分析);免疫細胞によって産生される遺伝子、タンパク質、及び他の分子の測定(例えば、ノーザンブロット分析、ポリメラーゼ連鎖反応、DNAマイクロアレイ、タンパク質マイクロアレイ、2次元ゲル電気泳動、ウェスタンブロット分析、酵素結合免疫吸着アッセイ、フローサイトメトリー);ならびに自己タンパク質または自己ポリペプチドが関与する自己免疫疾患、神経変性性疾患、及び他の疾患の臨床症状または転帰(例えば改善)の、例えば多発性硬化症の場合には再発率または疾患重症度を測定することによる(当業者に公知の臨床スコアを使用する)、I型糖尿病の場合には血糖を、または関節リウマチの場合には関節の炎症を測定することによる測定(臨床スコア、追加の治療法を使用する要件、機能的状態、画像研究)を含む。
VI.製造品及びキット
また、本明細書に記載の薬学的組成物を好適な包装に含む製造物品が本明細書において提供される。本明細書に記載の組成物(例えば、眼科用組成物)用の好適な包装は、当技術分野において公知であり、例えば、バイアル(例えば、密封バイアル)、容器(vessels)、アンプル、ボトル、ジャー、フレキシブル包装(例えば、密封マイラーまたはプラスチック袋)などを含む。これらの製造物品は、さらに滅菌及び/または密封されてよい。
さらに、本明細書に記載の薬学的組成物(または製造物品)を含むキットが提供され、該キットは、本明細書に記載の用途のような組成物の使用方法に関する説明書(複数可)をさらに含んでよい。本明細書に記載のキットはまた、他の緩衝剤、希釈剤、フィルター、針、シリンジ、及び本明細書に記載の任意の方法を実施するための説明書を含む添付文書を含む、商業的及び使用者の観点から望ましい他の材料を含んでもよい。
VII.治療用途
本明細書に記載のバリアントCD80ポリペプチド免疫調節タンパク質、操作された細胞または感染性物質を含有する提供される薬学的組成物を使用して、ヒト患者などの対象の疾患または状態の治療に関連することを含む免疫応答を調節する方法が本明細書において提供される。本明細書に記載の薬学的組成物(本明細書に記載のバリアントCD80ポリペプチド、免疫調節タンパク質、コンジュゲート、及び操作された細胞を含む薬学的組成物を含む)を、多種多様な治療用途、例えば疾患の治療に使用することができる。例えば、いくつかの実施形態では、薬学的組成物を使用して、哺乳動物において炎症性または自己免疫性障害、がん、臓器移植、ウイルス感染、及び/または細菌感染が治療される。薬学的組成物は、免疫応答を調節(例えば増加または減少)して、疾患を治療することができる。いくつかの実施形態では、この方法は、対象の免疫応答を増加させるフォーマットのバリアントCD80ポリペプチドを用いて実施される。いくつかのそのような態様では、免疫応答を増加させることにより、腫瘍またはがんなどの対象の疾患または状態を治療する。いくつかの実施形態では、この方法は、対象の免疫応答を減少させるフォーマットのバリアントCD80ポリペプチドを用いて実施される。いくつかのそのような態様では、免疫応答を低下することにより、炎症性疾患または状態、例えば自己免疫疾患などの対象の疾患または状態を治療する。
いくつかの実施形態では、提供される方法は、本明細書に記載のバリアントCD80ポリペプチド、免疫調節タンパク質、コンジュゲート、操作された細胞、及び感染性物質の治療的投与に適用可能である。提供される開示を考慮して、免疫応答の調節のタイプ(例えば所望により増加または減少)に応じて適応症に対してフォーマットを選択することは、当業者のレベル内である。
いくつかの実施形態では、例えば、がん、ウイルス感染または細菌感染の治療において有用であることができる、免疫応答を刺激するまたは増加させる本明細書において提供される薬学的組成物が投与される。提供される方法の中には、CTLA−4及び/またはPD−L1への親和性が増加した可溶性フォーマットなどのバリアントCD80ポリペプチドの送達を伴う方法があり、これは、活性化刺激、例えばCD3及び/またはCD28共刺激シグナルまたは分裂促進シグナルに対する応答を減少させるために起こり得る細胞内の阻害性シグナルを遮断するなど、阻害性受容体のシグナル伝達に拮抗し得る。場合によっては、この結果、免疫応答が増加する可能性がある。いくつかの実施形態では、CTLA−4またはPD−L1/PD−1の拮抗作用は、腫瘍学、例えば腫瘍またはがんの処置における免疫の促進において有用であり得る。いくつかの実施形態では、PD−L1に共結合するCD80に依存またはこれにより増強されるCD28の作動作用は、腫瘍学、例えば腫瘍またはがんの治療における免疫の促進において有用であり得る。
野生型CD80ポリペプチドと比較して増加した親和性でCTLA−4に結合するなど、CTLA−4に結合するバリアントCD80ポリペプチドの送達により免疫応答を増加させる方法が提供される。いくつかの実施形態では、薬学的組成物は、バリアントCD80ポリペプチドを、そのコグネイト結合パートナーCTLA−4の拮抗活性を示す及び/またはCTLA−4を介したシグナル伝達を阻害するフォーマットで含有する。そのような治療用途に関連して使用するためのCD80ポリペプチドの例示的なフォーマットは、例えば、可溶性のバリアントCD80ポリペプチド(例えば、バリアントCD80−Fc融合タンパク質)、免疫調節タンパク質、またはバリアントCD80ポリペプチド及び別のIgSFドメイン(Fc融合物であるその可溶性形態を含む)の「スタック」、分泌可能な免疫調節タンパク質を発現する操作された細胞、または感染細胞(例えば、腫瘍細胞またはAPC、例えば樹状細胞)における分泌可能な免疫調節タンパク質の発現及び分泌などのための分泌可能な免疫調節タンパク質をコードする核酸分子を含む感染性物質を含む。そのような方法の中には、可溶性フォーマットのバリアントCD80ポリペプチドの送達によって実施される方法があり、これは、CTLA−4阻害性受容体を結合し、APCに発現するCD80またはCD86との相互作用を遮断することにより、CTLA−4阻害性受容体のシグナル伝達に拮抗することができ、それにより、CD80/CD86結合CTLA−4受容体の負の調節シグナル伝達を防ぐ。場合によっては、この結果、免疫応答が増加する可能性があり、いくつかの態様では、これにより、腫瘍またはがんなどの対象の疾患または状態を治療することができる。例示的な可溶性フォーマットには、記載される任意のものが含まれる。そのような治療用物質に含まれるものは、親和性改変IgSFドメイン(例えばIgV)を含有するCD80バリアントポリペプチドの細胞外部分が、直接的または間接的に多量体化ドメイン、例えばFcドメインまたは領域に連結されるフォーマットである。いくつかの実施形態では、そのような治療用物質は、バリアントCD80−Fc融合タンパク質である。
非改変または野生型CD80ポリペプチドと比較して、増加した親和性でPD−L1に結合するなど、PD−L1に結合するバリアントCD80ポリペプチドの送達により免疫応答を増加させる方法が提供される。いくつかの実施形態では、提供されるCD80ポリペプチド、例えば、本明細書で提供されるバリアントCD80ポリペプチドの可溶性形態は、腫瘍細胞またはAPC上のPD−L1に結合することができ、これにより、PD−L1とPD−1阻害性受容体の相互作用を遮断し、さもなければPD−L1/PD−1相互作用から得られたであろう負の調節シグナル伝達を防ぐ。場合によっては、この結果、免疫応答が増加する可能性があり、いくつかの態様では、これにより、腫瘍またはがんなどの対象の疾患または状態を治療することができる。例示的な可溶性フォーマットには、記載される任意のものが含まれる。そのような治療用物質に含まれるものは、親和性改変IgSFドメイン(例えばIgV)を含有するCD80バリアントポリペプチドの細胞外部分が、直接的または間接的に多量体化ドメイン、例えばFcドメインまたは領域に連結されるフォーマットである。いくつかの実施形態では、そのような治療用物質は、バリアントCD80−Fc融合タンパク質である。
また、提供される実施形態の中には、非改変または野生型CD80ポリペプチドと比較して、PD−L1への増加した結合を示すバリアントCD80ポリペプチドを使用するPD−L1依存性CD28共刺激によるCD28の作動作用を媒介する方法がある。いくつかの態様では、そのような方法は、分子を投与された対象の免疫応答を増加させるために使用でき、いくつかの態様では、これにより、腫瘍またはがんなどの対象の疾患または状態を治療することができる。そのような方法の中には、可溶性フォーマットのバリアントCD80ポリペプチドの送達によって実施される方法がある。例示的な可溶性フォーマットは本明細書に記載されており、親和性改変IgSFドメイン(例えばIgV)を含有するCD80バリアントポリペプチドの細胞外部分が、直接的または間接的に多量体化ドメイン、例えばFcドメインまたは領域に連結されるフォーマットを含む。いくつかの実施形態では、そのような治療用物質は、バリアントCD80−Fc融合タンパク質である。このようなPD−L1依存性共刺激は、エフェクター機能を備えたFcを必要とせず、エフェクターなし、または不活性なFc分子を含有するFc融合タンパク質によって媒介され得る。場合によっては、そのようなバリアントCD80ポリペプチド、例えば可溶性形態は、PD−L1/PD−1相互作用を遮断しつつ、局在化T細胞上のCD28受容体を結合及び共刺激することにより、提供される治療法に関連して免疫応答の促進を促すこともできる。
いくつかの実施形態では、エフェクター機能を保持または示すFcに直接的または間接的に連結されたバリアントCD80ポリペプチドは、CD28作動作用を媒介するために対象に投与される。CD28へ結合する本明細書で提供するバリアントCD80ポリペプチドを使用して、受容体依存性CD28共刺激によりCD28の作動作用を媒介する方法が提供される。いくつかの実施形態では、CD28のそのような作動作用は、腫瘍学、例えば腫瘍またはがんの治療における免疫の促進において有用であり得る。場合によっては、バリアントCD80ポリペプチドは、CTLA−4またはPD−L1とも結合し、例えばCTLA−4またはPD−L1への結合の増加を示す。いくつかの態様では、Fc受容体の架橋により抗体依存性細胞傷害(ADCC)媒介性エフェクター機能が開始され得、これにより、CTLA−4発現細胞(例えばCTLA−4発現T制御性細胞)またはPD−L1発現細胞(例えばPD−L1hi腫瘍)などのコグネイト結合パートナーを発現する標的細胞の枯渇をもたらす。免疫応答を調節するために提供される方法は、腫瘍またはがんなどの疾患または状態を治療するために使用することができる。いくつかの実施形態では、薬学的組成物は、哺乳動物がん細胞(ヒトがん細胞など)の成長を阻害するために使用することができる。がんの治療方法は、有効量の本明細書に記載の薬学的組成物のいずれかをがんを有する対象に投与することを含むことができる。有効量の薬学的組成物を投与して、がんの進行を阻害、停止、または回複することができる。ヒトがん細胞は、in vivoまたはex vivoで治療できる。ヒト患者のex vivo治療では、がん細胞を含む組織または体液が体外で処理され、その後、当該組織または体液が患者に再導入される。いくつかの実施形態では、がんは、患者に治療用組成物を投与することにより、in vivoでヒト患者において治療される。したがって、本発明は、対照による処置と比較して、腫瘍の進行を阻害、停止、または回復させるか、そうでなければ無増悪生存期間(すなわち、患者が悪化しないがんを患いながら生存している治療中及び治療後の期間)または全生存期間(「生存率」とも呼ばれる;すなわち、がんと診断後またはこれを治療後、一定期間生存する試験群または処置群の人々の割合))の統計的に優位な延長をもたらすex vivo及びin vivoの方法を提供する。
本明細書に記載の薬学的組成物及び治療法によって治療できるがんは、限定されないが、黒色腫、膀胱癌、血液学的悪性腫瘍(白血病、リンパ腫、骨髄腫)、肝臓癌、脳癌、腎臓癌、乳癌、膵臓癌(腺癌)、大腸癌、肺癌(小細胞肺癌及び非小細胞肺癌)、脾臓癌、胸腺もしくは血液細胞の癌(すなわち、白血病)、前立腺癌、精巣癌、卵巣癌、子宮癌、胃癌、筋骨格癌、頭頸部癌、消化管癌、生殖細胞癌、または内分泌及び神経内分泌癌を含む。いくつかの実施形態では、がんは、ユーイング肉腫である。いくつかの実施形態では、がんは、黒色腫、肺癌、膀胱癌、及び血液学的悪性腫瘍から選択される。いくつかの実施形態では、がんは、リンパ腫、リンパ性白血病、骨髄性白血病、子宮頸癌、神経芽細胞腫、または多発性骨髄腫である。
いくつかの実施形態では、薬学的組成物は、単剤療法として(すなわち、単一の薬剤として)、または併用療法として(すなわち、1つまたは複数の追加の抗がん剤、例えば化学療法剤、がんワクチン、または免疫チェックポイント阻害剤と組み合わせて)投与される。いくつかの実施形態では、薬学的組成物をまた、放射線療法と共に投与することもできる。本開示のいくつかの態様では、免疫チェックポイント阻害剤は、ニボルマブ、トレメリムマブ、ペンブロリズマブ、イピリムマブなどである。
いくつかの実施形態では、薬学的組成物は、免疫応答を抑制し、炎症性または自己免疫性障害の治療、または臓器移植に有用であることができる。いくつかの実施形態では、薬学的組成物は、バリアントCD80ポリペプチドを、そのコグネイト結合パートナーCTLA−4の作動活性を示す及び/またはCTLA−4を介した阻害性シグナル伝達を刺激するフォーマットで含有する。そのような治療用途に関連して使用するためのCD80ポリペプチドの例示的なフォーマットは、例えば、炎症環境の細胞または組織に局在する、免疫調節タンパク質、またはバリアントCD80ポリペプチド及びIgSFドメインもしくはそのバリアントの「スタック」、炎症環境の細胞または組織に局在する部分に連結されたバリアントCD80ポリペプチドを含有するコンジュゲート、膜貫通型免疫調節タンパク質を発現する操作された細胞、または感染細胞における膜貫通型免疫調節タンパク質の発現などのための膜貫通型免疫調節タンパク質をコードする核酸分子を含む感染性物質を含む。
いくつかの実施形態では、炎症性または自己免疫性障害は、抗好中球細胞質抗体(ANCA)関連血管炎、血管炎、自己免疫性皮膚疾患、移植、リウマチ性疾患、炎症性消化管疾患、炎症性眼疾患、炎症性神経疾患、炎症性肺疾患、炎症性内分泌疾患、または自己免疫性血液疾患である。
いくつかの実施形態では、本明細書に記載の薬学的組成物によって治療できる炎症性及び自己免疫性障害は、アジソン病、アレルギー、円形脱毛症、アルツハイマー病、抗好中球細胞質抗体(ANCA)関連血管炎、強直性脊椎炎、抗リン脂質抗体症候群(ヒューズ症候群)、喘息、アテローム性動脈硬化、関節リウマチ、自己免疫性溶血性貧血、自己免疫性肝炎、自己免疫性内耳疾患、自己免疫性リンパ増殖症候群、自己免疫性心筋炎、自己免疫性卵巣炎、自己免疫性精巣炎、無精子症、ベーチェット病、ベルジェ病、水疱性類天疱瘡、心筋症、心血管疾患、セリアックスプルー/シリアック病、慢性疲労免疫不全症侯群(CFIDS)、慢性特発性多発神経炎、慢性炎症性脱髄性多発根ニューロパチー(chronic inflammatory demyelinating,polyradicalneuropathy)(CIPD)、慢性再発性多発ニューロパチー(ギラン・バレー症候群)、チャーグ・ストラウス症候群(CSS)、瘢痕性類天疱瘡、寒冷凝集素症(CAD)、COPD(慢性閉塞性肺疾患)、CREST症候群、クローン病、皮膚炎、疱疹状(herpetiformus)、皮膚筋炎、糖尿病、円板状ループス、湿疹、後天性表皮水疱症、本態性混合型クリオグロブリン血症、エヴァンス症候群、眼球突出、線維筋痛症、グッドパスチャー症候群、グレーブス病、橋本甲状腺炎、特発性肺線維症、特発性血小板減少性紫斑病(ITP)、IgA腎症、免疫増殖性疾患もしくは障害、炎症性腸疾患(IBD)、間質性肺疾患、若年性関節炎、若年性特発性関節炎(JIA)、川崎病、ランバート・イートン筋無力症症候群、扁平苔癬、ループス腎炎、リンパ球性下垂体炎、メニエール病、ミラー・フィッシャー症候群/急性散在性脳脊髄神経根障害(acute disseminated encephalomyeloradiculopathy)、混合性結合組織病、多発性硬化症(MS)、筋肉リウマチ、筋痛性脳脊髄炎(ME)、重症筋無力症、眼炎症、落葉状天疱瘡、尋常性天疱瘡、悪性貧血、結節性多発動脈炎、多発性軟骨炎、多腺性症候群(polyglandular syndromes)(ウィテカー症候群(Whitaker’s syndrome))、リウマチ性多発筋痛症、多発性筋炎、原発性無ガンマグロブリン血症、原発性胆汁性肝硬変/自己免疫性胆管症、乾癬、乾癬性関節炎、レイノー現象、ライター症候群/反応性関節炎、再狭窄、リウマチ熱、リウマチ性疾患、サルコイドーシス、シュミット症候群、強皮症、シェーグレン症候群、スティッフマン症候群、全身性エリテマトーデス(SLE)、全身性強皮症、高安動脈炎、側頭動脈炎/巨細胞性動脈炎、甲状腺炎、1型糖尿病、潰瘍性大腸炎、ブドウ膜炎、血管炎、白斑、間質性腸疾患またはウェゲナー肉芽腫症である。いくつかの実施形態では、炎症性または自己免疫性障害は、間質性腸疾患、移植、クローン病、潰瘍性大腸炎、多発性硬化症、喘息、関節リウマチ、及び乾癬から選択される。
いくつかの実施形態では、薬学的組成物は、自己免疫状態を調節するために投与される。例えば、免疫応答を抑制することは、レシピエントによるドナーからの、組織、細胞、または臓器移植の拒絶反応を阻害するための方法において有益であることができる。したがって、いくつかの実施形態では、本明細書に記載の薬学的組成物は、移植片関連または移植関連疾患または障害、例えば移植片対宿主疾患(GVHD)を制限または予防するために使用される。いくつかの実施形態では、薬学的組成物は、移植されたまたは生着された(grafted)骨髄、臓器、皮膚、筋肉、ニューロン、膵島、または実質細胞の自己免疫拒絶反応を抑制するために使用される。
本明細書に記載の、操作された細胞を含む薬学的組成物及び方法を、養子細胞移入用途において使用することができる。いくつかの実施形態では、操作された細胞を含む細胞組成物を、関連する方法において使用して、例えば免疫活性を、例えば哺乳動物がんの治療、または他の実施形態では自己免疫性障害の治療への免疫療法アプローチにおいて調節することができる。用いられる方法は、一般的に、本発明のTIPと哺乳動物細胞とを、親和性改変IgSFドメインの特異的結合及び哺乳動物細胞の免疫活性の調節に対して許容的な条件下で、接触させる方法を含む。いくつかの実施形態では、免疫細胞(例えば、腫瘍浸潤リンパ球(TIL)、T細胞(CD8+またはCD4+T細胞を含む)、またはAPC)は、本明細書に記載される膜タンパク質として及び/または可溶性バリアントCD80ポリペプチド、免疫調節タンパク質、もしくはコンジュゲートとして発現するように操作される。次いで、操作された細胞を、免疫活性の調節が望まれるAPC、第2のリンパ球または腫瘍細胞のような哺乳動物細胞と、哺乳動物細胞において免疫活性が調節され得るような哺乳動物細胞上のカウンター構造体への親和性改変IgSFドメインの特異的結合を許容する条件下で接触させることができる。細胞は、in vivoまたはex vivoで接触させることができる。
いくつかの実施形態では、操作された細胞は、対象に対して自家である。他の実施形態では、細胞は同種である。いくつかの実施形態では、細胞は、それが単離された哺乳動物に再注入される自家操作された細胞である。いくつかの実施形態では、細胞は、哺乳動物に注入される同種操作された細胞である。いくつかの実施形態では、細胞は、患者の血液または腫瘍から採取し、ポリペプチド(例えば、本明細書に記載されるバリアントCD80ポリペプチド、免疫調節タンパク質、またはコンジュゲート)を発現するように操作し、in vitro培養系で増殖させ(例えば、細胞を刺激することによって)、そして患者に再注入して腫瘍破壊を媒介する。いくつかの実施形態では、該方法は、TIPを発現する細胞(例えば、T細胞)を患者に注入して戻す養子細胞移入によって実施される。いくつかの実施形態では、本発明の治療用組成物及び方法は、リンパ腫、リンパ性白血病、骨髄性白血病、子宮頸癌、神経芽細胞腫、または多発性骨髄腫のようながんの哺乳動物患者の処置において使用される。
治療対象
いくつかの実施形態では、提供される方法は、治療用途が対象とする疾患または状態を有する、または有すると疑われる対象を治療するためのものである。場合によっては、治療対象は、提供される実施形態のいずれかに従って、提供されるバリアントCD80ポリペプチド、免疫調節タンパク質、コンジュゲート、操作された細胞、または感染性物質のいずれかによる治療を含む治療適合性の判断または治療対象の識別または選択などのため1つまたは複数の特徴またはパラメータに基づいて治療前に選択することができる。
いくつかの態様では、記載されるバリアントCD80ポリペプチドを含有する薬学的組成物の投与時またはその直前に、対象がPD−1/PD−L1またはPD−1/PD−L2の拮抗物質による治療後の寛解後に再発したか、治療に抵抗性になったか、または治療に反応しない場合、治療のために対象が選択される。いくつかの実施形態では、拮抗物質は、治療方法において使用される提供されたバリアントCD80ポリペプチドとPD−L1への結合について競合しないものである。いくつかの実施形態では、拮抗物質は抗PD−1抗体である。例示的な抗PD−1抗体は公知であり、これらに限定されないが、ニボルマブまたはペンブロリズマブ、またはその抗原結合断片を含む。
いくつかの実施形態では、提供される方法には、既知であるか、疑われるか、または提供される実施形態による治療の候補となり得る疾患または状態を有する患者の様々な生体試料における結合アッセイを利用する診断方法、予後診断方法またはモニタリング方法が含まれる。いくつかの実施形態では、方法は、CD28、PD−L1及び/またはCTLA−4を検出することができる試薬を用いて実施され、治療方法に利用されるバリアントCD80ポリペプチドの1つまたは複数の結合パートナーを発現する腫瘍または腫瘍細胞浸潤物を有する対象を選択する。そのような試薬は、提供される分子または薬学的組成物による治療の恩恵を受ける可能性が最も高い対象を選択するための、及び/または治療の有効性を予測するためのコンパニオン診断として使用できる。
いくつかの実施形態では、疾患または状態を治療するための、及び/または腫瘍またはがんを治療するための免疫応答を増加させる方法に含まれる、PD−L1/PD−1相互作用に拮抗する作用に基づく、及び/またはPD−L1依存性CD28共刺激などのCD28作動作用に基づく提供された治療法による治療の対象の選択及び/または効果の予測のための方法が提供される。いくつかの実施形態では、試薬は、細胞の表面、例えば腫瘍環境に存在する腫瘍細胞または骨髄細胞の表面上のPD−L1に特異的に結合するPD−L1結合試薬である。いくつかの実施形態では、試薬は、細胞の表面、例えばリンパ球、例えばT細胞などの浸潤免疫細胞の表面上のCD28に特異的に結合するCD28結合試薬である。いくつかの実施形態では、結合試薬は、抗体もしくは抗原結合断片、タンパク質リガンドもしくは結合パートナー、アプタマー、アフィマー、ペプチド、またはハプテンであり得る。いくつかの実施形態では、そのような試薬は、免疫調節タンパク質またはコンジュゲートを含む、非改変または野生型CD80と比較してPD−L1への増加した結合を示すIgSFドメイン(例えばIgV)であるかまたはこれを含有するバリアントCD80ポリペプチドを含有する本明細書で提供される治療用物質または薬学的組成物で治療する対象を選択または識別するためのコンパニオン診断として使用することができる。そのような治療用物質に含まれるものは、親和性改変IgSFドメイン(例えばIgV)を含有するCD80バリアントポリペプチドの細胞外部分が、直接的または間接的に多量体化ドメイン、例えばFcドメインまたは領域に連結されるフォーマットである。いくつかの実施形態では、そのような治療用物質は、バリアントCD80−Fc融合タンパク質である。
いくつかの実施形態では、結合試薬は、PD−L1と特異的に結合する抗体またはその抗原結合断片である。細胞内または細胞外PD−L1を含むPD−L1を検出するための様々なコンパニオン診断試薬が公知である、例えばRoach et al.(2016)Appl.Immunohistochem.,Mol.Morphol.,24:392−397;Cogswell et al.(2017)Mol.Diagn.Ther.21:85−93;国際公開特許出願第WO2015/181343もしくはWO2017/085307、または米国特許出願公開US2016/0009805もしくはUS2017/0285037である。抗PD−L1抗体の非限定的な例には、これらに限定されないが、マウス抗PD−L1クローン22C3(Merck&Co.)、ウサギ抗PD−L1クローン28−8(Bristol−Myers Squibb)、ウサギ抗PD−L1クローンSP263またはSP142(Spring Biosciences)及びウサギ抗PD−L1抗体クローンE1L3Nが挙げられる。このような結合試薬は、Dako PD−L1 IHC 22C3 pharmDxアッセイ、PD−L1 IHC 28−8 pharmDxアッセイ、Ventana PD−L1(SP263)アッセイ、またはVentana PD−L1(SP142)アッセイとして利用可能なものを含む組織化学法で使用することができる。
いくつかの実施形態では、結合試薬は、非改変または野生型CD80ポリペプチドと比較してPD−L1、CD28、及び/またはCTLA−4に対して変化した(例えば、増加した)結合親和性を示すものを含む、本明細書で提供されるバリアントCD80ポリペプチドであるか、またはこれを含有する。したがって、本明細書で提供されるバリアントCD80ポリペプチドのいずれかを含有するコンパニオン診断として使用するための結合試薬もまた提供される。生体試料と本明細書で提供されるバリアントCD80ポリペプチドのいずれかを含む結合試薬とを接触させることにより、生体試料中のPD−L1、CD28及び/またはCTLA−4を検出する方法もまた提供される。いくつかの態様では、本明細書で提供される免疫調節タンパク質またはコンジュゲートを含むバリアントCD80ポリペプチドを含有する結合試薬は、既知であるか、疑われるか、または提供される実施形態による治療の候補となり得る疾患または状態を有する患者の様々な生体試料における結合アッセイを利用する診断方法、予後診断方法またはモニタリング方法で、個別にまたは組み合わせて使用することができる。いくつかの実施形態では、バリアントCD80結合試薬及びバリアントCD80結合試薬を使用する方法は、提供されるバリアントCD80ポリペプチド、免疫調節タンパク質、コンジュゲート、操作された細胞または感染性物質のいずれかによる治療対象を選択するために使用することができる。いくつかの実施形態では、結合試薬のバリアントCD80ポリペプチドは、治療に使用されるバリアントCD80ポリペプチドと同じであるか、または同じ親和性改変IgSFドメイン(例えばIgVドメイン)を含有する。他の実施形態では、結合試薬のバリアントCD80ポリペプチドは、治療のためのバリアントcD80ポリペプチドとは異なるか、または異なる親和性改変IgSFドメイン(例えばIgVドメイン)を含有する。
バリアントCD80ポリペプチドであるか、またはそれを含有する結合試薬は、セクションIIに記載されているものを含む、本明細書に記載されているアミノ酸改変(例えば、アミノ酸置換、欠失または挿入)のいずれか1つまたは複数を含有することができる。いくつかの実施形態では、バリアントCD80結合試薬は、任意の所望の結合活性に基づいて選択することができ、場合によっては、生体試料中の細胞の表面上のPD−L1、CD28、CTLA−4のエクトドメインの1つ、2つ、または場合によってはそれぞれを特異的に結合または検出する能力に基づくことを含む。
いくつかの実施形態では、バリアントCD80ポリペプチドであるか、またはそれを含有する結合試薬は、Treg細胞の表面などの細胞の表面上のCTLA−4のエクトドメインに特異的に結合する。いくつかの実施形態では、バリアントCD80ポリペプチドは、本明細書で提供されるものなどの非改変または野生型CD80と比較してCTLA−4に対して増加した結合親和性を示す親和性改変IgSFドメイン(例えばIgV)であるか、またはそれを含有する。そのようなバリアントCD80ポリペプチドの例には、セクションII.A.1に記載されるIgSFドメイン(例えばIgV)にアミノ酸改変(複数可)を含有するものが含まれる。
いくつかの実施形態では、バリアントCD80ポリペプチドであるか、またはそれを含有する結合試薬は、腫瘍浸潤細胞の表面などの細胞の表面上のCD28のエクトドメインに特異的に結合する。いくつかの実施形態では、バリアントCD80ポリペプチドは、本明細書で提供されるものなどの非改変または野生型CD80と比較してCD28に対して増加した結合親和性を示す親和性改変IgSFドメイン(例えばIgV)であるか、またはそれを含有する。そのようなバリアントCD80ポリペプチドの例には、セクションII.A.2に記載されるIgSFドメイン(例えばIgV)にアミノ酸改変(複数可)を含有するものが含まれる。
いくつかの実施形態では、バリアントCD80ポリペプチドであるか、またはそれを含有する結合試薬は、腫瘍環境に存在する腫瘍細胞またはメロイド細胞(meloid cell)の表面などの細胞の表面上のPD−L1のエクトドメインに特異的に結合する。いくつかの実施形態では、バリアントCD80ポリペプチドは、本明細書で提供されるものなどの非改変または野生型CD80と比較してPD−L1に対して増加した結合親和性を示す親和性改変IgSFドメイン(例えばIgV)であるか、またはそれを含有する。そのようなバリアントCD80ポリペプチドの例には、セクションII.A.3に記載されるIgSFドメイン(例えばIgV)にアミノ酸改変(複数可)を含有するものが含まれる。
バリアントCD80結合試薬は、結合アッセイ及び検出方法での使用に適した本明細書に記載されるいずれかのフォーマットを含む任意のフォーマットで提供することができる。いくつかの実施形態では、結合試薬は、免疫調節タンパク質またはコンジュゲートを含むIgSFドメイン(例えばIgV)であるか、またはそれを含有するバリアントCD80ポリペプチドを含む。そのような治療用物質に含まれるものは、親和性改変IgSFドメイン(例えばIgV)を含有するCD80バリアントポリペプチドの細胞外部分が、直接的または間接的に多量体化ドメイン、例えばFcドメインまたは領域に連結されるフォーマットである。いくつかの実施形態では、そのような結合試薬は、バリアントCD80−Fc融合タンパク質である。いくつかの実施形態では、Fcドメインは非ヒトFcである。いくつかの実施形態では、Fcは、マウスFc、例えばマウスIgG、例えばマウスIgG1、マウスIgG2aまたはマウスIgG2bまたは他のマウスアイソタイプのものである。いくつかの実施形態では、マウスFcは、SEQ ID NO:3040に記載の配列、またはSEQ ID NO:3040に対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%または99%の配列同一性を示すアミノ酸の配列であるか、またはそれを含む。いくつかの実施形態では、マウスFcは、抗マウスIgG二次抗体(例えば、ヤギ抗マウスIgG)によって検出可能である。いくつかの実施形態では、Fcは、ウサギFc、例えばウサギIgGのものである。いくつかの実施形態では、ウサギFcは、SEQ ID NO:3039に記載の配列、またはSEQ ID NO:3039に対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%または99%の配列同一性を示すアミノ酸の配列であるか、またはそれを含む。いくつかの実施形態では、ウサギFcは、抗ウサギIgG二次抗体(例えば、ヤギ抗ウサギIgG)によって検出可能である。提供される結合試薬のバリアントCD80ポリペプチドは、Fcドメインなどの多量体化ドメインに直接的または間接的に連結することができる。いくつかの態様では、提供される結合試薬のバリアントCD80ポリペプチドは、セクションIIに記載されているものを含むリンカーを介するなどして、Fc配列に間接的に連結される。
結合試薬は、検出のために検出可能な標識に直接的または間接的に融合するなど、コンジュゲートさせることができる。場合によっては、結合試薬は、直接検出、または試薬もしくは試薬の一部に結合するかつ検出可能な標識に連結する抗体を介するなどの二次物質による検出のいずれかを可能にする部分に連結または結合する。例示的な検出可能な標識には、例えば、化学発光部分、生物発光部分、蛍光部分、放射性核種、及び金属が含まれる。標識を検出する方法は、当技術分野において周知である。そのような標識は、例えば、目視検査、蛍光分光法、反射率測定、フローサイトメトリー、X線、磁気共鳴画像法(MRI)及び磁気共鳴分光法(MRS)などの多種多様な磁気共鳴法によって検出することができる。検出方法には、コンピューター断層撮影(CT)、コンピューター体軸断層撮影(CAT)、電子ビームコンピューター断層撮影(EBCT)、高解像度コンピューター断層撮影(HRCT)、ハイポサイクロイド断層撮影、陽電子放出断層撮影(PET)、単一光子放射型コンピューター断層撮影(SPECT)、スパイラルコンピューター断層撮影、及び超音波断層撮影を含む多種多様な断層撮影法のいずれかが含まれる。例示的な検出可能な標識には、例えば、化学発光部分、生物発光部分、蛍光部分、放射性核種、及び金属が含まれる。検出可能な標識には、蛍光プローブまたは検出可能な酵素、例えば西洋ワサビペルオキシダーゼがある。
結合試薬は、in vitroまたはin vivoアッセイを含む当業者に既知の任意の結合アッセイを使用して、結合パートナー、例えばPD−L1、CD28またはCTLA−4を検出することができる。試料中で結合パートナー、例えばPD−L1、CD28またはCTLA−4の発現またはレベルを、評価、決定、定量及び/またはそうでなければ特異的に検出するために使用することができる例示的な結合アッセイには、これらに限定されないが、固相結合アッセイ(例えば、酵素結合免疫吸着アッセイ(ELISA))、放射免疫アッセイ(RIA)、免疫放射定量法、蛍光アッセイ、化学発光アッセイ、生物発光アッセイ、ウェスタンブロット、及び免疫組織化学(IHC)または非抗体結合物質を使用した偽免疫組織化学などの組織化学法が含まれる。例えば、ELISA法などの固相結合アッセイ法では、アッセイは、サンドイッチフォーマットまたは競合阻害フォーマットであることができる。他の実施例では、in vivoイメージング法を使用することができる。結合アッセイは、血漿、尿、腫瘍、または疑わしい腫瘍組織(新鮮な、凍結した、かつ固定またはパラフィン包埋した組織を含む)、リンパ節または骨髄を含むあらゆる種類の患者の体液、細胞、または組織試料から得られた試料で実施することができる。本明細書で提供される治療方法に従って治療する対象を選択する例示的な方法では、試料、例えば腫瘍組織の採取は、対象の治療の前に実施される。
いくつかの実施形態では、結合アッセイは、組織または細胞試料中の結合パートナーの発現またはレベルを検出する組織染色アッセイである。組織染色法には、限定されないが、免疫組織化学(IHC)または非抗体結合物質を使用した組織化学(例、偽免疫組織化学)などの細胞化学的または組織化学的方法が含まれる。そのような組織化学的方法は、腫瘍組織試料などの試料中の結合パートナーの量の定量的または半定量的検出を可能にする。かかる方法では、組織試料を結合試薬、例えばPD−L1結合試薬、特に、組織または細胞関連結合パートナーへの結合を可能にする条件下で、検出可能に標識された、または検出可能なものと接触させることができる。
組織化学によって決定される本明細書で提供される方法で使用するための試料は、組織または細胞試料など、疾患または状態に関連する任意の生体試料であり得る。例えば、組織試料は、新鮮、凍結及び/または保存された臓器または組織試料または生検材料または吸引液または細胞を含む固形組織であり得る。いくつかの実施例では、組織試料は、限定されないが、乳房、結腸、直腸、肺、胃、卵巣、頸部、子宮頸部、精巣、膀胱、前立腺、甲状腺、及び肺癌腫瘍を含む固形腫瘍、例えば原発性腫瘍及び転移性腫瘍から得られた組織または細胞である。特定の実施例では、試料は、後期癌、転移性癌、未分化癌、卵巣癌、上皮内癌(ISC)、扁平上皮癌(SCC)、前立腺癌、膵臓癌、非小細胞肺癌、乳癌、結腸癌である癌からの組織試料である。
いくつかの態様では、腫瘍が固形腫瘍の場合、腫瘍細胞の単離は、外科的生検によって達成することができる。対象から腫瘍細胞を採取するために使用することができる生検技術には、これらに限定されないが、針生検、CTガイド下針生検、吸引生検、内視鏡生検、気管支鏡生検、気管支洗浄、切開生検、切除生検、パンチ生検、シェーブ生検、皮膚生検、骨髄生検、及びループ電気外科切除法(LEEP)が含まれる。典型的には、100mgより大きな非壊死性の滅菌生検または試験片が得られるが、これは例えば100mg未満、50mg以下、10mg以下もしくは5mg以下などより小さくてもよく、または例えば100mgを超える、200mg以上、もしくは500mg以上、1gm以上、2gm以上、3gm以上、4gm以上、もしくは5gm以上などより大きくてもよい。アッセイのために摘出される試料サイズは、限定されないが、実行するアッセイ数、組織試料の健康状態、がんの種類、及び対象の状態を含む多くの要因に依存し得る。腫瘍組織は、滅菌容器、例えば滅菌チューブまたは培養皿に入れられ、任意で適切な培地に浸漬することができる。
いくつかの実施形態では、生検が固定された後、患者から得られた組織は、ホルマリン(ホルムアルデヒド)またはグルタルアルデヒドなどによって、または例えばアルコール浸漬によって固定される。組織化学的方法では、腫瘍試料は、脱水、及び腫瘍組織をパラフィンワックスまたは当業者に既知の他の固体支持体に包埋し(Plenat et ah,(2001)Ann Pathol.January 21(l):29−47)を参照のこと)、該組織を染色に適した切片にスライスし、そして選択された組織化学染色法に従って染色するために切片を処理する(例えば有機溶媒による包埋のための固体支持体の除去、及び保存された組織の再水和を含む)などの既知の技術を使用して処理することができる。
いくつかの実施形態では、組織化学法が用いられる。場合によっては、結合試薬は、直接的または間接的な検出のために、検出可能な標識または他の部分に直接結合または連結される。例示的な検出可能試薬には、限定されないが、ビオチン、蛍光タンパク質、生物発光タンパク質、または酵素が含まれる。他の実施例では、結合試薬は、標識された結合パートナーまたは抗体を介して検出することができるペプチドまたはタンパク質にコンジュゲート、例えば融合する。いくつかの実施例では、結合パートナーは、結合試薬の1つまたは複数の領域、例えばエピトープを認識する標識抗体などの標識二次試薬を使用するHC法によって検出することができる。
いくつかの実施形態では、得られた染色試験片(例えば組織化学法によって得られた)は、検出可能なシグナルを表示し、染色のデジタル画像などの画像を取得するシステムを使用してそれぞれ画像化する。画像取得の方法は、当業者に周知である。例えば、試料を染色すると、例えば、正立または倒立光学顕微鏡、走査型共焦点顕微鏡、カメラ、走査型またはトンネル電子顕微鏡、キャニングプローブ顕微鏡(canning probe microscopes)、及びイメージング赤外線検出器などの光学または非光学イメージング装置を使用して、染色またはバイオマーカー標識を検出することができる。いくつかの実施例では、画像はデジタルでキャプチャできる。得られた画像は、結合パートナー、例えば試料中のPD−L1の量を定量的または半定量的に決定するために使用することができる。免疫組織化学での使用に適した様々な自動化された試料の処理、走査及び分析システムが当技術分野で利用可能である。このようなシステムには、試料(組織切片が置かれたスライドなど)の、自動染色及び顕微鏡走査、コンピューター制御された画像分析、連続切片比較(試料の向き及びサイズの変動を制御する)、デジタルレポート生成、ならびにアーカイブ及び追跡が含まれる。従来の光学顕微鏡とデジタル画像処理システムを組み合わせて、免疫染色試料を含む細胞及び組織の定量分析を実施する細胞イメージングシステムが市販されている。例えば、CAS−200システム(Becton,Dickinson&Co.)を参照のこと。具体的には、検出は、手動で、またはコンピュータープロセッサ及びソフトウェアを含む画像処理技術によってなされることができる。そのようなソフトウェアを使用して、例えば、画像は、当業者に既知の手順を使用して、例えば染色品質または染色強度を含む要因に基づいて、構成、較正、正規化、及び/または検証することができる(例えば、公開米国特許出願US20100136549を参照のこと)。
いくつかの実施形態では、生体試料は、細胞の少なくとも、または少なくとも約、または約1%、細胞の少なくともまたは少なくとも約または約5%、細胞の少なくとも、または少なくとも約、または約10%、細胞の少なくとも、または少なくとも約、または約20%、細胞の少なくとも、または少なくとも約、または約40%以上において結合パートナーの検出可能な発現レベルがある場合(例えば、結合試薬との接触及び結合した結合試薬の検出後)、結合パートナー、例えばPD−L1、CD28またはCTLA−4に対して表面陽性の細胞について検出される。
いくつかの実施形態では、生体試料は、間質細胞、腫瘍細胞、または腫瘍浸潤免疫細胞、例えば腫瘍浸潤リンパ球などの腫瘍浸潤細胞を含む腫瘍組織試料である。いくつかの実施形態では、腫瘍組織試料は、細胞の少なくとも、または少なくとも約、または約1%、細胞の少なくともまたは少なくとも約または約5%、細胞の少なくとも、または少なくとも約、または約10%、細胞の少なくとも、または少なくとも約、または約20%、細胞の少なくとも、または少なくとも約、または約40%以上において結合パートナーの検出可能な発現レベルがある場合(例えば、結合試薬との接触及び結合した結合試薬の検出後)、PD−L1に対して表面陽性の細胞について検出される。いくつかの実施形態では、細胞は、腫瘍細胞または腫瘍浸潤免疫細胞である。いくつかの実施形態では、腫瘍組織試料は、細胞の少なくとも、または少なくとも約、または約1%、細胞の少なくともまたは少なくとも約または約5%、細胞の少なくとも、または少なくとも約、または約10%、細胞の少なくとも、または少なくとも約、または約20%、細胞の少なくとも、または少なくとも約、または約40%以上において結合パートナーの検出可能な発現レベルがある場合(例えば、結合試薬との接触及び結合した結合試薬の検出後)、CD28に対して表面陽性の細胞について検出される。いくつかの実施形態では、細胞は、腫瘍浸潤免疫リンパ球である。
VIII.例示的な実施形態
提供される実施形態としては、以下の実施形態が挙げられる。
1.IgVドメインもしくはその特異的結合断片、IgCドメインもしくはその特異的結合断片、またはその両方を含むバリアントCD80ポリペプチドであって、SEQ ID NO:2の番号付けに基づいた7、23、26、30、34、35、46、51、55、57、58、65、71、73、78、79、82または84位に対応する、非改変CD80またはその特異的結合断片の1つまたは複数の位置に1つまたは複数のアミノ酸改変を含む、バリアントCD80ポリペプチド。
2.CD80ポリペプチドが、非改変CD80またはその特異的結合断片に、SEQ ID NO:2の番号付けに基づいた26、35、46、57、または71位に対応する1つまたは複数のアミノ酸改変を含む、実施形態1に記載のバリアントCD80ポリペプチド。
3.1つまたは複数のアミノ酸改変が、アミノ酸の置換、挿入、または欠失である、実施形態1または実施形態2に記載のバリアントCD80ポリペプチド。
4.非改変CD80またはその特異的結合断片に、E7D、E23D、E23G、A26D、A26E、A26G、A26H、A26K、A26N、A26P、A26Q、A26R、A26S、A26T、I30F、I30T、I30V、K34E、E35D、E35G、D46E、D46N、D46V、P51A、N55D、N55I、T57A、T57I、I58V、L65P、A71D、A71G、R73H、R73S、G78A、T79A、T79I、T79L、T79M、T79P、C82R、V84A、及びV84Iの中から選択される、1つまたは複数のアミノ酸改変を含み、該アミノ酸改変の位置(複数可)が、SEQ ID NO:2に記載のCD80の位置の番号付けに対応する、実施形態1〜3のいずれかに記載のバリアントCD80ポリペプチド。
5.1つまたは複数のアミノ酸改変が、
の中から選択され、該アミノ酸置換の位置(複数可)がSEQ ID NO:2に記載のCD80の位置に対応する、実施形態1〜4のいずれかに記載のバリアントCD80ポリペプチド。
6.IgVドメインもしくはその特異的結合断片、IgCドメインもしくはその特異的結合断片、またはその両方を含むバリアントCD80ポリペプチドであって、該バリアントCD80ポリペプチドが、非改変CD80またはその特異的結合断片に、
の中から選択される1つまたは複数のアミノ酸改変を含み、該アミノ酸置換の位置(複数可)がSEQ ID NO:2に記載のCD80の位置の番号付けに対応する、バリアントCD80ポリペプチド。
7.1つまたは複数のアミノ酸改変が、
の中から選択され、該アミノ酸置換の位置(複数可)がSEQ ID NO:2に記載のCD80の位置に対応する、実施形態6に記載のバリアントCD80ポリペプチド。
8.1つまたは複数のアミノ酸改変が、V20I、V22I、V22L、A26E、Q27H、Q33L、Q33R、E35D、E35G、T41S、M43L、D46E、D46V、M47I、M47L、M47V、N55D、T57I、I61V、L70M、A71D、A71G、L72V、L85M、L85Q、R94W、及びL97Qの中から選択され、
任意で1つまたは複数のアミノ酸改変が、V20I、V22L、A26E、Q27H、Q33L、Q33R、E35D、E35G、M47I、D46E、D46V、M47L、M47V、T57I、L70M、A71D、A71G、L72V、L85M、L85Q、及びL97Qの中から選択され、
任意で1つまたは複数のアミノ酸改変が、A26E、Q33L、E35D、M47I、M47L、M47V、T57I、L70M、A71D、A71G、及びL85Qの中から選択され、任意で1つまたは複数のアミノ酸改変が、A26E、E35D、D46V、M47L、M47V、L70M、A71G、及びL85Qの中から選択され、
該アミノ酸置換の位置(複数可)がSEQ ID NO:2に記載のCD80の位置に対応する、
実施形態6または実施形態7に記載のバリアントCD80ポリペプチド。
9.1つまたは複数のアミノ酸改変が、A26Eを含む、
1つまたは複数のアミノ酸改変が、E35Dを含む、
1つまたは複数のアミノ酸改変が、D46Vを含む、
1つまたは複数のアミノ酸改変が、M47Lを含む、
1つまたは複数のアミノ酸改変が、M47Vを含む、及び/または
1つまたは複数のアミノ酸改変が、A71Gを含み、
該アミノ酸改変の位置(複数可)がSEQ ID NO:2に記載のCD80の位置の番号付けに対応する、
実施形態6〜8のいずれかに記載のバリアントCD80ポリペプチド。
10.アミノ酸改変が、E35D/D46E、E35D/D46V、E35D/M47I、E35D/M47L、E35D/M47V、E35D/V68M、E35D/A71G、E35D/D90G;D46E/M47I、D46E/M47L、D46E/M47V、D46E/V68M、D46E/A71GorD46E/D90G;M47I/V68M、M47I/A71G、M48I/D90G;M47L/V68M、M47L/A71G、M47L/D90G;M47V/V68M、M47V/A71G、M47V/D90G;V68M/A71GまたはV68M/D90G、A71G/D90Gから選択され、任意で該アミノ酸改変が、E35D/M47I/V68M、E35D/M47L/V68M、E35D/M47V/V68Mであり、
該アミノ酸改変の位置(複数可)がSEQ ID NO:2に記載のCD80の位置の番号付けに対応する、実施形態6〜9のいずれかに記載のバリアントCD80ポリペプチド。
11.IgVドメインもしくはその特異的結合断片、IgCドメインもしくはその特異的結合断片、またはその両方を含むバリアントCD80ポリペプチドであって、該バリアントCD80ポリペプチドが、1つまたは複数のアミノ酸置換を含み、該1つまたは複数のアミノ酸置換は少なくともアミノ酸置換L70Pを含むが、アミノ酸置換V68M、L72P及び/またはK86Eを含まず、該アミノ酸改変の位置(複数可)がSEQ ID NO:2に記載のCD80の位置に対応する、バリアントCD80ポリペプチド。
12.1つまたは複数のアミノ酸改変が、L70P、I30F/L70P、I30V/T57I/L70P/A71D/A91T、N55D/L70P/E77G、及びL70P/F92Sの中から選択される、実施形態11に記載のバリアントCD80ポリペプチド。
13.非改変CD80が、哺乳動物CD80である、実施形態1〜12のいずれかに記載のバリアントCD80ポリペプチド。
14.CD80が、ヒトCD80である、実施形態1〜13のいずれかに記載のバリアントCD80ポリペプチド。
15.IgVドメインもしくはその特異的結合断片、ならびに
IgCドメインもしくはその特異的結合断片を含む、
実施形態1〜14のいずれかに記載のバリアントCD80ポリペプチド。
16.非改変CD80が、(i)SEQ ID NO:2に記載のアミノ酸の配列、(ii)SEQ ID NO:2に対して少なくとも95%の配列同一性を有するアミノ酸の配列、または(iii)IgVドメインもしくはIgCドメインもしくはその特異的結合断片を含むそれらの一部分である、実施形態1〜15のいずれかに記載のバリアントCD80ポリペプチド。
17.IgVドメインまたはIgCドメインの特異的結合断片が少なくとも50、60、70、80、90、100、110以上のアミノ酸長を有するか、
IgVドメインの特異的結合断片がSEQ ID NO:1のアミノ酸35〜135、35〜138、37〜138または35〜141として記載されるIgVドメインの長さの少なくとも80%である長さを含むか、または、
IgCドメインの特異的結合断片がSEQ ID NO:1のアミノ酸145〜230、154〜232または142〜232として記載されるIgCドメインの長さの少なくとも80%である長さを含む、
実施形態1〜15のいずれかに記載のバリアントCD80ポリペプチド。
18.最大1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19または20個のアミノ酸改変、任意でアミノ酸置換、挿入及び/または欠失を含む、実施形態1〜17のいずれかに記載のバリアントCD80ポリペプチド。
19.SEQ ID NO:2に対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%または99%の配列同一性を示すアミノ酸の配列またはその特異的結合断片を含む、実施形態1〜18のいずれかに記載のバリアントCD80ポリペプチド。
20.IgVドメインもしくはその特異的断片、及びIgCドメインもしくはその特異的断片を含む、実施形態1〜19のいずれかに記載のバリアントCD80ポリペプチド。
21.SEQ ID NO:3〜75、2009〜2104、2297〜2507、及び2930〜2960のいずれかに記載のアミノ酸配列もしくはその特異的結合断片、またはSEQ ID NO:3〜75、2009〜2104、2297〜2507、及び2930〜2960のいずれかに対して少なくとも95%の配列同一性を示し、かつ1つまたは複数のそれらのアミノ酸改変を含有する、アミノ酸配列もしくはその特異的結合断片、を含むかまたはそれからなる、実施形態1〜20のいずれかに記載のバリアントCD80ポリペプチド。
22.IgVドメインまたはその特異的結合断片を含む、実施形態1〜19のいずれかに記載のバリアントCD80ポリペプチド。
23.IgVドメインまたはその特異的結合断片が、バリアントCD80ポリペプチドの唯一のCD80部分である、実施形態1〜19及び22のいずれかに記載のバリアントCD80ポリペプチド。
24.SEQ ID NO:77〜149、151〜223、2105〜2296、2508〜2929、及び2961〜3022のいずれかに記載のアミノ酸配列もしくはその特異的結合断片、またはSEQ ID NO:77〜149、151〜223、2105〜2296、2508〜2929、及び2961〜3022のいずれかに対して少なくとも95%の配列同一性を示し、かつ1つまたは複数のそれらのアミノ酸改変を含有する、アミノ酸の配列もしくはその特異的結合断片、を含むまたはそれからなる、実施形態1〜19、22及び23のいずれかに記載のバリアントCD80ポリペプチド。
25.IgCドメインまたはその特異的結合断片が、バリアントCD80ポリペプチドの唯一のCD80部分である、実施形態1〜19のいずれかに記載のバリアントCD80ポリペプチド。
26.エクトドメインへの非改変CD80の結合と比較して、CTLA−4、PD−L1、及び/またはCD28のエクトドメインに対して変化した結合を示す、実施形態1〜25のいずれかに記載のバリアントCD80ポリペプチド。
27.変化した結合が、変化した結合親和性及び/または変化した結合選択性である、実施形態26に記載のバリアントCD80ポリペプチド。
28.CTLA−4が、ヒトCTLA−4である、実施形態26または実施形態27に記載のバリアントCD80ポリペプチド。
29.CD28が、ヒトCD28である、実施形態26〜28のいずれかに記載のバリアントCD80ポリペプチド。
30.PD−L1が、ヒトPD−L1である、実施形態26〜29のいずれかに記載のバリアントCD80ポリペプチド。
31.CTLA4のエクトドメインへの非改変CD80の結合親和性と比較して、CTLA4のエクトドメインに対して増加した結合親和性を示す、実施形態1〜30のいずれかに記載のバリアントCD80ポリペプチド。
32.非改変CD80またはその特異的結合断片に、SEQ ID NO:2の番号付けに基づいた7、23、26、30、35、46、57、58、71、73、79及び/または84位に対応する1つまたは複数のアミノ酸改変を含む、実施形態1〜31のいずれかに記載のバリアントCD80ポリペプチド。
33.非改変CD80またはその特異的結合断片に、
の中から選択される、1つまたは複数のアミノ酸改変を含み、該アミノ酸改変の位置(複数可)が、SEQ ID NO:2に記載のCD80の位置に対応する、実施形態1〜31のいずれかに記載のバリアントCD80ポリペプチド。
34.1つまたは複数のアミノ酸改変が、
の中から選択され、該アミノ酸置換の位置(複数可)がSEQ ID NO:2に記載のCD80の位置に対応する、実施形態1〜33のいずれかに記載のバリアントCD80ポリペプチド。
35.CTLA−4のエクトドメインに対する増加した親和性が、CTLA−4のエクトドメインへの非改変CD80の結合親和性と比較して1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、または60倍より大きく増加する、実施形態31〜34のいずれかに記載のバリアントCD80ポリペプチド。
36.CTLA−4のエクトドメインへの非改変CD80と比較して、増加した選択性を伴ってCTLA−4のエクトドメインに特異的に結合する、実施形態1〜35のいずれかに記載のバリアントCD80ポリペプチド。
37.選択性の増加が、非改変CD80ポリペプチドのCTLA−4への結合対CD28への結合比と比較してCTLA−4対CD28へのバリアントポリペプチドのより大きな結合比を含む、実施形態36に記載のバリアントCD80ポリペプチド。
38.該比率が、少なくとも1.5倍、2.0倍、3.0倍、4.0倍、5倍、10倍、15倍、20倍、30倍、40倍、50倍もしくはそれ以上、または少なくとも約1.5倍、約2.0倍、約3.0倍、約4.0倍、約5倍、約10倍、約15倍、約20倍、約30倍、約40倍、約50倍もしくはそれ以上より大きい、実施形態37に記載のバリアントCD80ポリペプチド。
39.CD28のエクトドメインへの非改変CD80の結合親和性と比較して、CD28のエクトドメインに対して増加した結合親和性を示す、実施形態1〜31のいずれかに記載のバリアントCD80ポリペプチド。
40.非改変CD80またはその特異的結合断片に、SEQ ID NO:2の番号付けに基づいた23、26、35、46、55、57、58、71、79及び/または84位に対応する、1つまたは複数のアミノ酸改変を含む実施形態1〜31及び39のいずれかに記載のバリアントCD80ポリペプチド。
41.非改変CD80またはその特異的結合断片に、
の中から選択される、1つまたは複数のアミノ酸改変を含み、該アミノ酸置換の位置(複数可)がSEQ ID NO:2に記載のCD80の位置に対応する、実施形態1〜31、39及び40のいずれかに記載のバリアントCD80ポリペプチド。
42.1つまたは複数のアミノ酸改変が、
の中から選択され、該アミノ酸置換の位置(複数可)がSEQ ID NO:2に記載のCD80の位置に対応する、実施形態1〜31及び39〜41のいずれかに記載のバリアントCD80ポリペプチド。
43.CD28のエクトドメインに対する増加した親和性が、CD28のエクトドメインへの非改変CD80の結合親和性と比較して、1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、150倍、または200倍より大きく増加する、実施形態39〜42のいずれかに記載のバリアントCD80ポリペプチド。
44.PD−L1のエクトドメインへの非改変CD80の結合親和性と比較して、PD−L1のエクトドメインに対して増加した結合親和性を示す、実施形態1〜31のいずれかに記載のバリアントCD80ポリペプチド。
45.非改変CD80またはその特異的結合断片に、SEQ ID NO:2の番号付けに基づいた7、23、26、30、34、35、46、51、55、57、58、65、71、73、78、79、82、及び/または84位に対応する、1つまたは複数のアミノ酸改変を含む実施形態1〜31、及び44のいずれかに記載のバリアントCD80ポリペプチド。
46.非改変CD80またはその特異的結合断片に、
の中から選択される、1つまたは複数のアミノ酸改変を含み、該アミノ酸置換の位置(複数可)がSEQ ID NO:2に記載のCD80の位置に対応する、実施形態1〜31、及び44のいずれかに記載のバリアントCD80ポリペプチド。
47.1つまたは複数のアミノ酸改変が、
の中から選択され、該アミノ酸置換の位置(複数可)がSEQ ID NO:2に記載のCD80の位置に対応する、実施形態1〜31及び44〜46のいずれかに記載のバリアントCD80ポリペプチド。
48.PD−L1のエクトドメインに対する増加した親和性が、PD−L1のエクトドメインへの非改変CD80の結合親和性と比較して、1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、150倍、200倍、250倍、300倍、350倍、400倍、または450倍より大きく増加する、実施形態44〜47のいずれかに記載のバリアントCD80ポリペプチド。
49.CD28のエクトドメインへの非改変CD80の結合親和性と比較して、CD28のエクトドメインに対して減少した結合親和性を示す、実施形態1〜38及び44〜48のいずれかに記載のバリアントCD80ポリペプチド。
50.CD28のエクトドメインに対する減少した親和性が、CD28のエクトドメインへの非改変CD80の結合親和性と比較して、1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、または60倍より大きく増加する、実施形態1〜38及び44〜49のいずれかに記載のバリアントCD80ポリペプチド。
51.バリアントポリペプチドが、PD−L1のエクトドメインの非改変CD80と比較して、増加した選択性を伴ってPD−L1のエクトドメインに特異的に結合する、実施形態1〜50のいずれかに記載のバリアントCD80ポリペプチド。
52.非改変CD80ポリペプチドのPD−L1への結合対CD28への結合比と比較して、PD−L1対CD28へのバリアントポリペプチドのより大きな結合比を含む、実施形態51に記載のバリアントCD80ポリペプチド。
53.該比率が、少なくとも1.5倍、2.0倍、3.0倍、4.0倍、5倍、10倍、15倍、20倍、30倍、40倍、50倍もしくはそれ以上、または少なくとも約1.5倍、約2.0倍、約3.0倍、約4.0倍、約5倍、約10倍、約15倍、約20倍、約30倍、約40倍、約50倍もしくはそれ以上より大きい、実施形態52に記載のバリアントCD80ポリペプチド。
54.可溶性タンパク質である、実施形態1〜53のいずれかに記載のバリアントCD80ポリペプチド。
55.CD80膜貫通ドメイン及び細胞内シグナル伝達ドメインを欠き;及び/または
細胞表面に発現することができない、
実施形態1〜54のいずれかに記載のバリアントCD80ポリペプチド。
56.ポリペプチドの生物学的半減期を延長する部分に連結された、実施形態1〜55のいずれかに記載のバリアントCD80ポリペプチド。
57.多量体化ドメインに連結された、実施形態1〜56のいずれかに記載のバリアントCD80ポリペプチド。
58.多量体化ドメインがFcドメインであるか、または低下したエフェクター機能を有するバリアントFcドメインである、実施形態57に記載のバリアントCD80ポリペプチド。
59.Fcドメインが哺乳動物、任意でヒト、マウスまたはウサギであるか、
またはバリアントFcドメインが、哺乳動物、任意でヒトである非改変Fcドメインと比較して1つまたは複数のアミノ酸改変を含む、
実施形態58に記載のバリアントCD80ポリペプチド。
60.Fcドメインもしくはそのバリアントが、SEQ ID NO:277、SEQ ID NO:359、もしくはSEQ ID NO:1712に記載のアミノ酸配列、またはSEQ ID NO:277、SEQ ID NO:359、もしくはSEQ ID NO:1712に対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%もしくは99%の配列同一性を示すアミノ酸配列を含む、または
該Fcドメインが、SEQ ID NO:3039もしくは3040に記載のアミノ酸配列、またはSEQ ID NO:3039もしくは3040に対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%または99%の配列同一性を示すアミノ酸配列を含む、
実施形態58または実施形態59に記載のバリアントCD80ポリペプチド。
61.Fcドメインが、E233P、L234A、L234V、L235A、L235E、G236del、G237A、S267K、N297G,V302C、及びK447del(それぞれEU番号付けによる)の中から選択される1つまたは複数のアミノ酸改変を含み、任意で該1つまたは複数のアミノ酸改変がヒトIgG1にある、実施形態58〜60のいずれかに記載のバリアントCD80ポリペプチド。
62.Fcドメインが、アミノ酸改変C220S(EU番号付けによる)を含む、実施形態58〜60のいずれかに記載のバリアントCD80ポリペプチド。
63.Fcドメインが、SEQ ID NO:356〜358、376、及び1712〜1715のいずれかに記載のアミノ酸配列、またはSEQ ID NO:356〜358、376、及び1712〜1715のいずれかに対して少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、もしくは99%の配列同一性を示し、かつ低下したエフェクター機能を示すアミノ酸配列を含む、実施形態58〜62のいずれかに記載のバリアントCD80ポリペプチド。
64.リンカー、任意でG4Sリンカーを介して間接的に多量体化ドメインまたはFcに連結する、実施形態57〜63のいずれかに記載のバリアントCD80ポリペプチド。
65.膜貫通ドメインをさらに含む膜貫通型免疫調節タンパク質であり、任意で該膜貫通ドメインが、バリアントCD80ポリペプチドの細胞外ドメイン(ECD)またはその特異的結合断片に直接的または間接的に連結されている、実施形態1〜53のいずれかに記載のバリアントCD80ポリペプチド。
66.膜貫通ドメインが、SEQ ID NO:1の残基243〜263として記載されるアミノ酸配列、またはSEQ ID NO:1の残基243〜263に対して少なくとも85%の配列同一性を示すその機能的バリアントを含む、実施形態65に記載のバリアントCD80ポリペプチド。
67.細胞質シグナル伝達ドメインをさらに含み、任意で該細胞質シグナル伝達ドメインが膜貫通ドメインに直接的または間接的に連結される、実施形態65または実施形態66に記載のバリアントCD80ポリペプチド。
68.細胞質シグナル伝達ドメインが、SEQ ID NO:1の残基264〜288として記載されるアミノ酸配列、またはSEQ ID NO:1の残基254〜288に対して少なくとも85%の配列同一性を示すその機能的バリアントを含む、実施形態67に記載のバリアントCD80ポリペプチド。
69.バリアントCD80が、in vitro初代T細胞アッセイにおいて非改変CD80に対してIFN−γ(インターフェロン−ガンマ)発現を増加させる、実施形態1〜68のいずれかに記載のバリアントCD80ポリペプチド。
70.in vitro初代T細胞アッセイにおいて非改変CD80に対してIFN−γ(インターフェロン−ガンマ)発現を減少させる、実施形態1〜68のいずれかに記載のバリアントCD80ポリペプチド。
71.脱グリコシル化した、実施形態1〜70のいずれかに記載のバリアントCD80ポリペプチド。
72.実施形態1〜71のいずれかに記載のバリアントCD80ポリペプチド及び半減期延長部分を含む免疫調節タンパク質。
73.半減期延長部分が、多量体化ドメイン、アルブミン、アルブミン結合ポリペプチド、Pro/Ala/Ser(PAS)、ヒト絨毛性ゴナドトロピンのベータサブユニットのC末端ペプチド(CTP)、ポリエチレングリコール(PEG)、アミノ酸の長い非構造化親水性配列(XTEN)、ヒドロキシエチルデンプン(HES)、アルブミン結合小分子、またはこれらの組み合わせを含む、実施形態72に記載の免疫調節タンパク質。
74.半減期延長部分がPro/Ala/Ser(PAS)であるか、またはそれを含み、該バリアントCD80ポリペプチドがPAS化される、実施形態72または実施形態73に記載の免疫調節タンパク質。
75.半減期延長部分が多量体化ドメインであるか、またはそれを含む、実施形態72または実施形態73に記載の免疫調節タンパク質。
76.多量体化ドメインが、免疫グロブリンのFc領域、ロイシンジッパー、イソロイシンジッパーまたはジンクフィンガーから選択される、実施形態75に記載の免疫調節タンパク質。
77.第1の多量体化ドメインに連結された第1のバリアントCD80ポリペプチド及び第2の多量体化ドメインに連結された第2のバリアントCD80ポリペプチドを含む多量体であり、該第1及び第2の多量体化ドメインが相互作用して第1及び第2のバリアントCD80ポリペプチドを含む多量体を形成する、実施形態75または実施形態76に記載の免疫調節タンパク質。
78.多量体が二量体である、実施形態77に記載の免疫調節タンパク質。
79.第1のバリアントCD80ポリペプチド及び第2のバリアントCD80ポリペプチドが同一である、実施形態77または実施形態78に記載の免疫調節タンパク質。
80.二量体がホモ二量体である、実施形態78または実施形態79に記載の免疫調節タンパク質。
81.二量体がヘテロ二量体である、実施形態78に記載の免疫調節タンパク質。
82.多量体化ドメインが免疫グロブリンのFc領域であるか、またはそれを含む、実施形態75〜81のいずれかに記載の免疫調節タンパク質。
83.Fc領域が、免疫グロブリンG1(IgG1)または免疫グロブリンG2(IgG2)タンパク質のものである、実施形態82に記載の免疫調節タンパク質。
84. 免疫調節タンパク質がヒトである及び/またはFc領域がヒトである、実施形態82または実施形態83に記載の免疫調節タンパク質。
85.Fc領域が、SEQ ID NO:278に記載のアミノ酸配列、またはSEQ ID NO:278に対して少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%または99%の配列同一性を示すそのバリアントを含む、実施形態82〜84のいずれかに記載の免疫調節タンパク質。
86.Fc領域が、SEQ ID NO:277に記載のアミノ酸配列、またはSEQ ID NO:277に対して少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%または99%の配列同一性を示すそのバリアントを含む、実施形態82〜85のいずれかに記載の免疫調節タンパク質。
87.Fc領域が、1つまたは複数のエフェクター機能を示す、実施形態82〜86のいずれかに記載の免疫調節タンパク質。
88.Fc依存性CD28共刺激を、任意で抗原提示細胞の存在下でのT細胞刺激アッセイにおいて示し、任意で該T細胞がIL−2レポーターを発現するJurkat細胞またはIL−2などの炎症性サイトカインを産生する初代ヒトT細胞を含む、実施形態82〜87のいずれかに記載の免疫調節タンパク質。
89.Fc領域が、野生型Fc領域と比較して低下した1つまたは複数のエフェクター機能を示し、任意で野生型Fc領域が、ヒトIgG1のヒトFcである、実施形態82〜86のいずれかに記載の免疫調節タンパク質。
90.1つまたは複数のエフェクター機能が、抗体依存性細胞傷害(ADCC)、補体依存性細胞傷害、プログラム細胞死及び細胞食作用の中から選択される、実施形態87〜89のいずれかに記載の免疫調節タンパク質。
91.Fc領域が、野生型Fc領域と比較して1つまたは複数のアミノ酸置換を含むバリアントFc領域である、実施形態89または実施形態90に記載の免疫調節タンパク質。
92.バリアントFc領域の1つまたは複数のアミノ酸置換が、N297G、R292C/N297G/V302C、E233P/L234V/L235A/G236del/S267KまたはL234A/L235E/G237Aから選択され、該残基が、KabatのEUインデックスに従って番号付けされる、実施形態91に記載の免疫調節タンパク質。
93.バリアントFc領域が、アミノ酸置換C220Sをさらに含み、該残基が、KabatのEUインデックスに従って番号付けされる、実施形態92に記載の免疫調節タンパク質。
94.Fc領域が、SEQ ID NO:356〜358のいずれかに記載のアミノ酸配列の配列、またはSEQ ID NO:356〜358のいずれかに対して少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、またはそれ以上の配列同一性を示し、かつアミノ酸置換を含有するアミノ酸配列を含む、実施形態89〜93のいずれかに記載の免疫調節タンパク質。
95.Fc領域が、K447delを含み、該残基が、KabatのEUインデックスに従って番号付けされる、実施形態89〜94のいずれかに記載の免疫調節タンパク質。
96.Fc領域が、SEQ ID NO:1713〜1715のいずれかに記載のアミノ酸配列の配列、またはSEQ ID NO:1713〜1715のいずれかに対して少なくとも90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、またはそれ以上の配列同一性を示し、かつアミノ酸置換を含有するアミノ酸配列を含む、実施形態89〜93及び95のいずれかに記載の免疫調節タンパク質。
97.バリアントCD80ポリペプチドが、実施形態44〜48のいずれかに記載のバリアントCD80ポリペプチドである、実施形態82〜96のいずれかに記載の免疫調節タンパク質。
98.PD−L1依存性CD28共刺激を、任意で、PD−L1を発現する抗原提示細胞の存在下でのT細胞刺激アッセイにおいて示し、任意で該T細胞がIL−2レポーターを発現するJurkat細胞またはIL−2などの炎症性サイトカインを産生する初代ヒトT細胞を含む、実施形態72〜97のいずれかに記載の免疫調節タンパク質。
99.バリアントCD80ポリペプチドが、直接的またはリンカーを介して間接的に、半減期延長部分に、任意で多量体化ドメインに連結される、実施形態72〜98のいずれかに記載の免疫調節タンパク質。
100.リンカーが1〜10アミノ酸を含む、実施形態99に記載の免疫調節タンパク質。
101.リンカーが、AAA、G4S(SEQ ID NO:1717)または(G4S)2(SEQ ID NO:330)から選択される、実施形態100に記載の免疫調節タンパク質。
102.直接的またはリンカーを介して間接的にIgSFファミリーメンバーの免疫グロブリンスーパーファミリー(IgSF)ドメインを含む第2のポリペプチドに連結された実施形態1〜71のいずれかに記載のバリアントCD80ポリペプチドを含む、免疫調節タンパク質。
103.IgSFドメインが、親和性改変IgSFドメインであり、該親和性改変IgSFドメインが、該IgSFファミリーメンバーの非改変または野生型IgSFドメインと比較して1つまたは複数のアミノ酸置換を含む、実施形態102に記載の免疫調節タンパク質。
104.IgSFドメインが、IgSFファミリーメンバーの非改変または野生型IgSFドメインの同一の1つまたは複数のコグネイト結合パートナー(複数可)への結合と比較して、1つまたは複数のそのコグネイト結合パートナー(複数可)への変化した結合を示す親和性改変IgSFドメインである、実施形態103に記載の免疫調節タンパク質。
105.IgSFドメインが、IgSFファミリーメンバーの非改変または野生型IgSFドメインの同一の1つまたは複数のコグネイト結合パートナー(複数可)への結合と比較して、1つまたは複数のそのコグネイト結合パートナー(複数可)への増加した結合を示す、実施形態104に記載の免疫調節タンパク質。
106.バリアントCD80ポリペプチドが第1のCD80バリアントポリペプチドであり、第2のポリペプチドのIgSFドメインが実施形態1〜71のいずれかに記載の第2のバリアントCD80ポリペプチドに由来するIgSFドメインであり、該第1及び第2のCD80バリアントポリペプチドが同一または異なる、実施形態102〜105のいずれかに記載の免疫調節タンパク質。
107.バリアントCD80ポリペプチドがCTLA−4に特異的に結合することができ、第2のポリペプチドのIgSFドメインがCD80バリアントポリペプチドによって特異的に結合されるもの以外のコグネイト結合パートナーに結合することができる、実施形態102〜106のいずれかに記載の免疫調節タンパク質。
108.第2のポリペプチドのIgSFドメインが、腫瘍に発現するリガンドに結合する、または腫瘍に発現するリガンドに結合する腫瘍局在化部分であるか、または炎症環境に関連する細胞もしくは組織に結合する炎症局在化部分である、実施形態102〜107のいずれかに記載の免疫調節タンパク質。
109.リガンドがB7H6である、実施形態108に記載の免疫調節ポリペプチド。
110.IgSFドメインがNKp30由来である、実施形態108または実施形態109に記載の免疫調節ポリペプチド。
111.第2のポリペプチドのIgSFドメインが、阻害性受容体に結合するリガンドのIgSFドメイン、またはその親和性改変IgSFドメインである、実施形態102〜107のいずれかに記載の免疫調節タンパク質。
112.親和性改変IgSFドメインが、同じ阻害性受容体への非改変IgSFドメインの結合と比較して、阻害性受容体に対する結合親和性及び/または結合選択性の増加を示す、実施形態111に記載の免疫調節タンパク質。
113.阻害性受容体がTIGITもしくはPD−1;または阻害性受容体のリガンドがCD155、CD112、PD−L1もしくはPD−L2である、実施形態111または112に記載の免疫調節タンパク質。
114.第2のポリペプチドが、
(i)SEQ ID NO:269、734もしくは829のいずれかに記載のIgSFドメインを含む野生型CD112、またはSEQ ID NO:735〜828、830〜999、1430〜1501のいずれかに記載のIgSFドメインを含むバリアントCD112ポリペプチド、
(ii)SEQ ID NO:268、378もしくは421のいずれかに記載のIgSFを含む野生型CD155、またはSEQ ID NO:379〜420、422〜733、1502〜1711のいずれかに記載のIgSFドメインを含むバリアントCD155ポリペプチド、
(iii)SEQ ID NO:251、1000、1721もしくは1196のいずれかに記載のIgSFを含む野生型PD−L1、またはSEQ ID NO:1001〜1195、1718〜1720、1722〜1996のいずれかに記載のIgSFを含むバリアントPD−L1ポリペプチド、
(iv)SEQ ID NO:252、1197もしくは1257のいずれかに記載のIgSFを含む野生型PD−L2、SEQ ID NO:1198〜1248、1250〜1256、1258〜1325、1327〜1401、1403〜1426のいずれかに記載のIgSFドメインを含むバリアントPD−L2ポリペプチド、
(v)(i)〜(iv)のSEQ ID NO:のいずれかに対して少なくとも90%、91%、92%、93%、94%、95%、95%、97%、98%、99%、またはそれ以上の配列同一性を示し、アミノ酸置換を含むアミノ酸配列、または
(vi)(i)〜(v)のいずれかの特異的結合断片
から選択される、実施形態102〜107及び111〜113のいずれかに記載の免疫調節タンパク質。
115.IgSFファミリーメンバーのIgSFドメインまたはその親和性改変IgSFドメインを含む第3のポリペプチドをさらに含み、該親和性改変IgSFドメインが、該IgSFファミリーメンバーの非改変または野生型IgSFドメインと比較して1つまたは複数のアミノ酸置換を含む、実施形態102〜114のいずれかに記載の免疫調節タンパク質。
116.第3のポリペプチドが、
第1及び/または第2のポリペプチドと同一である;または
第3のポリペプチドが第1及び/または第2のポリペプチドとは異なる、
実施形態115に記載の免疫調節タンパク質。
117.第3のポリペプチドが、
(i)SEQ ID NO:269、734もしくは829のいずれかに記載のIgSFドメインを含む野生型CD112、またはSEQ ID NO:735〜828、830〜999、1430〜1501のいずれかに記載のIgSFドメインを含むバリアントCD112ポリペプチド、
(ii)SEQ ID NO:268、378もしくは421のいずれかに記載のIgSFを含む野生型CD155、またはSEQ ID NO:379〜420、422〜733、1502〜1711のいずれかに記載のIgSFドメインを含むバリアントCD155ポリペプチド、
(iii)SEQ ID NO:251、1000、1721もしくは1196のいずれかに記載のIgSFを含む野生型PD−L1、またはSEQ ID NO:1001〜1195、1718〜1720、1722〜1996のいずれかに記載のIgSFを含むバリアントPD−L1ポリペプチド、
(iv)SEQ ID NO:252、1197もしくは1257のいずれかに記載のIgSFを含む野生型PD−L2、SEQ ID NO:1198〜1248、1250〜1256、1258〜1325、1327〜1401、1403〜1426のいずれかに記載のIgSFドメインを含むバリアントPD−L2ポリペプチド、
(v)(i)〜(iv)のSEQ ID NO:のいずれかに対して少なくとも90%、91%、92%、93%、94%、95%、95%、97%、98%、99%、またはそれ以上の配列同一性を示し、アミノ酸置換を含むアミノ酸配列、または
(vi)(i)〜(v)のいずれかの特異的結合断片
から選択される、実施形態115及び実施形態116に記載の免疫調節タンパク質。
118.任意で第2または第3のポリペプチドの、IgSFドメインまたはその親和性改変IgSFドメインが、IgVドメインであるか、またはそれを含む、実施形態102〜117のいずれかに記載の免疫調節タンパク質。
119.バリアントCD80ポリペプチドが、IgVドメインであるか、またはそれを含む、実施形態102〜118のいずれかに記載の免疫調節タンパク質。
120.IgSFファミリーメンバーのIgSFドメインまたはその親和性改変IgSFドメインを含む少なくとも1つの追加のポリペプチドをさらに含み、該親和性改変IgSFドメインが、該IgSFファミリーメンバーの非改変または野生型IgSFドメインと比較して1つまたは複数のアミノ酸置換を含む、実施形態115〜119のいずれかに記載の免疫調節タンパク質。
121.バリアントCD80ポリペプチドまたは第2のポリペプチドの少なくとも1つに連結された多量体化ドメインをさらに含む、実施形態102〜120のいずれかに記載の免疫調節タンパク質。
122.バリアントCD80ポリペプチド、第2のポリペプチド、及び/または第3のポリペプチドの少なくとも1つに連結された多量体化ドメインをさらに含む、実施形態115〜120のいずれかに記載の免疫調節タンパク質。
123.多量体化ドメインがFcドメインであるか、または低下したエフェクター機能を有するそのバリアントである、実施形態121または122に記載の免疫調節タンパク質。
124.多量体化ドメインがヘテロ二量体の形成を促進する、実施形態121〜123のいずれかに記載の免疫調節タンパク質。
125.多量体化ドメインが第1の多量体化ドメインである実施形態57〜64のいずれかに記載の第1のバリアントCD80ポリペプチド、ならびに多量体化ドメインが第2の多量体化ドメインである実施形態57〜64のいずれかに記載の第2のバリアントCD80ポリペプチドを含み、該第1及び第2の多量体化ドメインが相互作用して第1及び第2のバリアントCD80ポリペプチドを含有する多量体を形成する、免疫調節タンパク質。
126.多量体化ドメインが第1の多量体化ドメインであり、第2の多量体化ドメインと相互作用して免疫調節タンパク質を含む多量体を形成する、実施形態77〜81のいずれかに記載の免疫調節タンパク質を含む免疫調節タンパク質。
127.免疫調節タンパク質が第1の免疫調節タンパク質であり、第2の免疫調節タンパク質が第2の多量体化ドメインに直接的またはリンカーを介して間接的に連結され、該多量体が第1及び第2の免疫調節タンパク質を含む、実施形態126に記載の免疫調節タンパク質。
128.第2の免疫調節タンパク質が実施形態77〜81のいずれかに記載の免疫調節タンパク質であり、該多量体化ドメインが第2の多量体化ドメインである、実施形態127に記載の免疫調節タンパク質。
129.多量体が二量体である、実施形態125〜128のいずれかに記載の免疫調節タンパク質。
130.ホモ二量体である、実施形態125〜129のいずれかに記載の免疫調節タンパク質。
131.ヘテロ二量体である、実施形態125〜129のいずれかに記載の免疫調節タンパク質。
132.第1及び/または第2の多量体化ドメインがFcドメインであるか、または低下したエフェクター機能を有するそのバリアントである、実施形態125〜131のいずれかに記載の免疫調節タンパク質。
133.第1及び第2の多量体化ドメインが同一または異なる、実施形態125〜132のいずれかに記載の免疫調節タンパク質。
134.実施形態1〜71のいずれかに記載のバリアントCD80ポリペプチド、または部分に連結された実施形態72〜133のいずれかに記載の免疫調節タンパク質を含み、任意で融合タンパク質である、コンジュゲート。
135.部分が、細胞表面の分子に特異的に結合するターゲティング部分である、実施形態134に記載のコンジュゲート。
136.ターゲティング部分が、免疫細胞表面の分子に特異的に結合し、任意で該免疫細胞が、抗原提示細胞またはリンパ球である、実施形態135に記載のコンジュゲート。
137.ターゲティング部分が、腫瘍表面の分子に結合する腫瘍局在化部分である、実施形態135に記載のコンジュゲート。
138.部分が、タンパク質、ペプチド、核酸、小分子またはナノ粒子である、実施形態134〜137のいずれかに記載のコンジュゲート。
139.部分が、抗体または抗原結合断片である、実施形態134〜138のいずれかに記載のコンジュゲート。
140.コンジュゲートが、二価、四価、六価、または八価である、実施形態134〜139のいずれかに記載のコンジュゲート。
141.融合タンパク質である、実施形態134〜139のいずれかに記載のコンジュゲート。
142.実施形態1〜71のいずれかに記載のバリアントCD80ポリペプチド、実施形態72〜133のいずれかに記載の免疫調節タンパク質、または実施形態134〜141のいずれかに記載の融合タンパク質であるコンジュゲートをコードする核酸分子(複数可)。
143.合成核酸である、実施形態142に記載の核酸分子。
144.cDNAである、実施形態142または実施形態143に記載の核酸分子。
145.実施形態142〜144のいずれかに記載の核酸分子を含むベクター。
146.発現ベクターである、実施形態145に記載のベクター。
147.哺乳動物発現ベクターまたはウイルスベクターである、実施形態145または実施形態146に記載のベクター。
148.実施形態146または実施形態147に記載のベクターを含む、細胞。
149.哺乳動物細胞である、実施形態148の細胞。
150.ヒト細胞である、実施形態148または実施形態149に記載の細胞。
151.実施形態142〜144のいずれかに記載の核酸分子または実施形態145〜147のいずれかに記載のベクターを宿主細胞に、該細胞内でタンパク質を発現する条件下で導入することを含む、バリアントCD80ポリペプチドまたは免疫調節タンパク質の産生方法。
152.細胞からバリアントCD80ポリペプチドまたは免疫調節タンパク質を単離または精製することをさらに含む、実施形態151に記載の方法。
153.実施形態1〜71のいずれかに記載のバリアントCD80ポリペプチドをコードする核酸分子を宿主細胞に、該ポリペプチドが該細胞内で発現される条件下で導入することを含む、バリアントCD80バリアントポリペプチドを発現する細胞を操作する方法。
154.実施形態1〜71のいずれかに記載のバリアントCD80ポリペプチド、実施形態72〜133のいずれかに記載の免疫調節タンパク質、実施形態134〜141のいずれかに記載の融合タンパク質であるコンジュゲート、実施形態142〜145のいずれかに記載の核酸分子、または実施形態145〜147のいずれかに記載のベクターを発現する、操作された細胞。
155.バリアントCD80ポリペプチドまたは免疫調節タンパク質が、シグナルペプチドをコードするヌクレオチド配列を含む核酸によってコードされる、実施形態154に記載の操作された細胞。
156.バリアントCD80ポリペプチドまたは免疫調節タンパク質が、膜貫通ドメインを含まない、及び/または細胞の表面に発現しない、実施形態154または実施形態155に記載の操作された細胞。
157.バリアントCD80ポリペプチドまたは免疫調節タンパク質が、操作された細胞から分泌される、または分泌されることができる、実施形態154〜156のいずれかに記載の操作された細胞。
158.膜貫通ドメインを含むバリアントCD80ポリペプチドを含む、及び/または実施形態65〜71のいずれかに記載の膜貫通型免疫調節タンパク質である、実施形態154または実施形態155に記載の操作された細胞。
159.バリアントCD80ポリペプチドが、細胞の表面に発現する、実施形態154、実施形態155または実施形態158に記載の操作された細胞。
160.免疫細胞である、実施形態154〜159のいずれかに記載の操作された細胞。
161.免疫細胞が、抗原提示細胞(APC)またはリンパ球である、実施形態160に記載の操作された細胞。
162.初代細胞である、実施形態159〜161のいずれかに記載の操作された細胞。
163.哺乳動物細胞である、実施形態159〜162のいずれかに記載の操作された細胞。
164.ヒト細胞である、実施形態159〜163のいずれかに記載の操作された細胞。
165.リンパ球であり、該リンパ球がT細胞である、実施形態159〜164のいずれかに記載の操作された細胞。
166.APCであり、該APCが人工APCである、実施形態161に記載の操作された細胞。
167.キメラ抗原受容体(CAR)または操作されたT細胞受容体をさらに含む、実施形態154〜166のいずれかに記載の操作された細胞。
168.実施形態1〜71のいずれかに記載のバリアントCD80ポリペプチド、実施形態72〜133のいずれかに記載の免疫調節タンパク質、または実施形態134〜141のいずれかに記載の融合タンパク質であるコンジュゲートをコードする核酸分子を含む、感染性物質。
169.コードされたバリアントCD80ポリペプチド、免疫調節タンパク質、またはコンジュゲートが、膜貫通ドメインを含まない、及び/またはそれが発現される細胞の表面に発現しない、実施形態168に記載の感染性物質。
170.コードされたバリアントCD80ポリペプチド、免疫調節ポリペプチド、またはコンジュゲートが、それが発現される細胞から分泌される、または分泌されることができる、実施形態168または実施形態169に記載の感染性物質。
171.コードされたバリアントCD80ポリペプチドが、膜貫通ドメインを含む、実施形態168に記載の感染性物質。
172.コードされたバリアントCD80ポリペプチドが、それが発現される細胞の表面に発現する、実施形態168または実施形態171に記載の感染性物質。
173.細菌またはウイルスである、実施形態168〜172のいずれかに記載の感染性物質。
174.ウイルスであり、該ウイルスが腫瘍溶解性ウイルスである、実施形態173に記載の感染性物質。
175.腫瘍溶解性ウイルスが、アデノウイルス、アデノ随伴ウイルス、ヘルペスウイルス、単純ヘルペスウイルス、レオウイルス、ニューカッスル病ウイルス、パルボウイルス、麻疹ウイルス、水疱性口内炎ウイルス(VSV)、コクサッキーウイルスまたはワクシニアウイルスである、実施形態174に記載の感染性物質。
176.ウイルスが、樹状細胞(DC)を特異的に標的とするウイルス、及び/または樹状細胞指向性である、実施形態175に記載の感染性物質。
177.ウイルスが、改変されたシンドビスウイルスエンベロープ産物でシュードタイプ化されたレンチウイルスベクターである、実施形態176に記載の感染性物質。
178.標的細胞の死をもたらす、または免疫応答を増強もしくは強化することができるさらなる遺伝子産物をコードする核酸分子をさらに含む、実施形態168〜177のいずれかに記載の感染性物質。
179.さらなる遺伝子産物が、抗がん剤、抗転移剤、抗血管新生剤、免疫調節分子、免疫チェックポイント阻害剤、抗体、サイトカイン、成長因子、抗原、細胞傷害性遺伝子産物、プロアポトーシス遺伝子産物、抗アポトーシス遺伝子産物、細胞マトリックス分解性遺伝子、組織再生またはヒト体細胞をリプログラミングして多能性にするための遺伝子から選択される、実施形態178に記載の感染性物質。
180.実施形態1〜71のいずれかに記載のバリアントCD80ポリペプチド、実施形態72〜133のいずれかに記載の免疫調節タンパク質、実施形態134〜141のいずれかに記載のコンジュゲート、実施形態154〜167のいずれかに記載の操作された細胞、または実施形態168〜179のいずれかに記載の感染性物質を含む、薬学的組成物。
181.薬学的に許容し得る賦形剤を含む、実施形態180に記載の薬学的組成物。
182.薬学的組成物が無菌である、実施形態179または180に記載の薬学的組成物。
183.バイアル内に実施形態179〜182のいずれかに記載の薬学的組成物を含む製造物品。
184.バイアルが密封された、実施形態183に記載の製造物品。
185.実施形態179〜182のいずれかに記載の薬学的組成物及び使用説明書を含むキット。
186.実施形態183及び184に従った製造物品及び使用説明書を含むキット。
187.実施形態180〜182のいずれかに記載の薬学的組成物を対象に投与することを含む、対象において免疫応答を調節する方法。
188.実施形態72〜101のいずれかに記載の免疫調節タンパク質を投与することを含む、対象において免疫応答を調節する方法。
189.免疫応答が増加される、実施形態187または188に記載の方法。
190.免疫調節タンパク質が、Fc依存性CD28共刺激を示す実施形態88に記載の免疫調節タンパク質である、実施形態188または実施形態189に記載の方法。
191.免疫調節タンパク質が、PD−L1依存性CD28共刺激を示す実施形態98に記載の免疫調節タンパク質であり、任意で該免疫調節タンパク質が、請求項のいずれかに記載のバリアントCD80ポリペプチドを含む、実施形態186〜188のいずれかに記載の方法。
192.実施形態154〜167のいずれかに記載の操作された細胞を投与することを含む、対象における免疫応答を調節する方法。
193.操作された細胞が、対象に対して自家である、実施形態192に記載の方法。
194.操作された細胞が、対象に対して同種他家である、実施形態192に記載の方法。
195.免疫応答を調節することにより、対象の疾患または状態を治療する、実施形態187〜194のいずれかに記載の方法。
196.免疫応答が増加される、実施形態187〜195のいずれかに記載の方法。
197.可溶性であり、任意でCD80膜貫通ドメイン及び細胞内シグナル伝達ドメインを欠くバリアントCD80ポリペプチドまたは免疫調節タンパク質が対象に投与される、実施形態187〜191、195、または196のいずれかに記載の方法。
198.バリアントCD80ポリペプチドまたは免疫調節タンパク質がFc融合タンパク質である、実施形態197に記載の方法。
199.実施形態1〜68及び71のいずれかに記載のバリアントCD80ポリペプチド、または実施形態72〜133のいずれかに記載の免疫調節タンパク質が対象に投与される、実施形態187〜198のいずれかに記載の方法。
200.分泌可能なバリアントCD80ポリペプチドを含む操作された細胞が、対象に投与される、実施形態192〜196のいずれかに記載の方法。
201.実施形態154〜167のいずれかに記載の操作された細胞が、対象に投与される、実施形態192〜196及び200のいずれかに記載の方法。
202.分泌可能な免疫調節タンパク質であるバリアントCD80ポリペプチドをコードする感染性物質が、任意で感染性物質が腫瘍細胞または免疫細胞に感染し、分泌可能な免疫調節タンパク質が感染細胞から分泌される条件下で対象に投与される、実施形態187〜191、195、及び196のいずれかに記載の方法。
203.疾患または状態が、腫瘍またはがんである、実施形態187〜202のいずれかに記載の方法。
204.疾患または状態が、黒色腫、肺癌、膀胱癌、血液学的悪性疾患、肝臓癌、脳癌、腎臓癌、乳癌、膵臓癌、大腸癌、脾臓癌、前立腺癌、精巣癌、卵巣癌、子宮癌、胃癌、筋骨格癌、頭頸部癌、消化管癌、生殖細胞癌、または内分泌及び神経内分泌癌から選択される、実施形態187〜203のいずれか1つに記載の方法。
205.免疫応答が減少される、実施形態187、188、及び192〜195のいずれかに記載の方法。
206.炎症環境の細胞または組織に局在化する部分に連結されたバリアントCD80ポリペプチドを含む免疫調節タンパク質またはコンジュゲートが対象に投与される、実施形態187、188、192〜195、及び205のいずれかに記載の方法。
207.部分が、抗体またはその抗原結合断片を含む、または野生型IgSFドメインまたはそのバリアントを含む第2のポリペプチドを含む、実施形態206に記載の方法。
208.実施形態72〜133のいずれかに記載の免疫調節タンパク質または実施形態134〜141のいずれかに記載のコンジュゲートが対象に投与され、任意で該免疫調節タンパク質またはコンジュゲートが、CTLA−4への増加した結合親和性を示すバリアントCD80ポリペプチドを含む、実施形態187〜191、195、及び205〜207のいずれかに記載の方法。
209.膜貫通ドメインを含むバリアントCD80ポリペプチドが、対象に投与される、実施形態187〜195及び205のいずれかに記載の方法。
210.実施形態158〜167のいずれかに記載される膜貫通型免疫調節タンパク質であるバリアントCD80ポリペプチドを含む操作された細胞が、対象に投与される、実施形態192〜195、205、及び209のいずれかに記載の方法。
211.膜貫通型免疫調節タンパク質であるバリアントCD80ポリペプチドをコードする感染性物質が、任意で該感染性物質が腫瘍細胞または免疫細胞に感染し、該膜貫通型免疫調節タンパク質が感染細胞の表面に発現する条件下で対象に投与される、実施形態187、195及び205のいずれかに記載の方法。
212.疾患または状態が、炎症性または自己免疫性疾患または状態である、実施形態195、及び205〜211のいずれかに記載の方法。
213.疾患または状態が、抗好中球細胞質抗体(ANCA)関連血管炎、血管炎、自己免疫性皮膚疾患、移植、リウマチ性疾患、炎症性消化管疾患、炎症性眼疾患、炎症性神経疾患、炎症性肺疾患、炎症性内分泌疾患、または自己免疫性血液疾患である、実施形態195、及び205〜212のいずれかに記載の方法。
214.疾患または状態が、炎症性腸疾患、移植、クローン病、潰瘍性大腸炎、多発性硬化症、喘息、関節リウマチ、または乾癬から選択される、実施形態195、及び205〜213のいずれかに記載の方法。
215.バリアントCD80ポリペプチドを含む免疫調節タンパク質を投与することを含む、対象において免疫応答を増加させる方法であって、該バリアントCD80ポリペプチドが、非改変CD80またはその特異的結合断片のIgVドメインまたはIgCドメインまたはその特異的結合断片の1つまたは複数の位置に1つまたは複数のアミノ酸改変を含み、該免疫調節タンパク質が、PD−L1依存性CD28共刺激を示す、方法。
216.該バリアントCD80ポリペプチドが、PD−L1のエクトドメインへの非改変CD80の結合親和性と比較して、PD−L1のエクトドメインに対して増加した結合親和性を示す、実施形態215に記載の方法。
217.バリアントCD80ポリペプチドを含む免疫調節タンパク質を投与することを含む、対象においてPD−L1依存性CD28共刺激によりCD28作動作用を媒介する方法であって、該バリアントCD80ポリペプチドが、非改変CD80またはその特異的結合断片のIgVドメインまたはIgCドメインまたはその特異的結合断片の1つまたは複数の位置に1つまたは複数のアミノ酸改変を含み、該バリアントCD80ポリペプチドが、PD−L1のエクトドメインへの非改変CD80の結合親和性と比較して、PD−L1のエクトドメインに対して増加した結合親和性を示す、方法。
218.PD−L1のエクトドメインに対する増加した親和性が、PD−L1のエクトドメインへの非改変CD80の結合親和性と比較して1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、150倍、200倍、250倍、300倍、350倍、400倍、または450倍より大きく増加する、実施形態216または実施形態217に記載の方法。
219.疾患または状態の治療に使用するための、実施形態215〜219のいずれかに記載の方法。
220.PD−L1依存性CD28共刺激が、PD−L1を発現する抗原提示細胞の存在下でのT細胞刺激アッセイにおいて評価され、任意で該T細胞刺激アッセイがin vitroアッセイであり、任意で該T細胞がIL−2レポーターを発現するJurkat細胞を含む、実施形態217〜219のいずれかに記載の方法。
221.投与の前に表面PD−L1に陽性の細胞を含む腫瘍を有する治療対象を選択し、任意で該細胞が腫瘍細胞または腫瘍浸潤免疫細胞であるか、または
PD−L1に陽性の細胞表面を含む腫瘍を有するものとして対象が選択されており、任意で該細胞が腫瘍細胞または腫瘍浸潤免疫細胞である、
実施形態187〜220のいずれかに記載の方法。
222.対象の選択が、
(a)対象の腫瘍組織試料をPD−L1のエクトドメインに特異的に結合することができる結合試薬と接触させることと、
(b)該腫瘍組織試料の細胞内または細胞上に結合した結合試薬の存在を検出することであって、任意で該細胞が腫瘍細胞または腫瘍浸潤免疫細胞である、検出することと、
(c)腫瘍組織試料が検出可能レベルのPD−L1に陽性の細胞表面を含む場合に、治療のために対象を選択することと、
を含む、実施形態221に記載の方法。
223.投与の前に、CD28に陽性の細胞表面を含む腫瘍を有する治療対象を選択し、任意で該細胞が腫瘍浸潤リンパ球であり、任意で該リンパ球がT細胞、任意でCD8+T細胞であるか、または
CD28に陽性の細胞表面を含む腫瘍を有するものとして対象が選択されており、任意で該細胞が腫瘍浸潤リンパ球であり、任意で該リンパ球がT細胞、任意でCD8+T細胞である、
実施形態187〜222のいずれかに記載の方法。
224.対象の選択が、
(a)対象の腫瘍組織試料をCD28のエクトドメインに特異的に結合することができる結合試薬と接触させることと、
(b)該腫瘍組織試料の細胞内または細胞上に結合した結合試薬の存在を検出することであって、任意で該細胞が腫瘍浸潤リンパ球であり、任意で該リンパ球がT細胞、任意でCD8+T細胞である、検出することと、
(c)腫瘍組織試料が検出可能レベルのCD28に陽性の細胞表面を含む場合に、治療のために対象を選択することと、
を含む、実施形態223に記載の方法。
225.(a)対象の腫瘍組織試料をPD−L1に特異的に結合することができる結合試薬と接触させることと、
(b)該腫瘍組織試料の細胞内または細胞上に結合した結合試薬の存在を検出することであって、任意で該細胞が腫瘍細胞または腫瘍浸潤免疫細胞である、検出することと、
(c)腫瘍試料が検出可能レベルのPD−L1に陽性の細胞表面を含む場合に、バリアントCD80ポリペプチドを含む免疫調節タンパク質による治療のために対象を選択することであって、該バリアントCD80ポリペプチドが、非改変CD80またはその特異的結合断片のIgVドメインまたはIgCドメインまたはその特異的結合断片の1つまたは複数の位置に1つまたは複数のアミノ酸改変を含み、該バリアントCD80ポリペプチドが、PD−L1のエクトドメインへの非改変CD80の結合親和性と比較して、PD−L1のエクトドメインに対して増加した結合親和性を示す、選択することと
を含む、治療対象を選択する方法。
226.該腫瘍組織試料をCD28と特異的に結合することができる結合試薬と接触させることを含み、該対象は、該腫瘍組織試料が検出可能レベルのCD28に陽性の腫瘍浸潤リンパ球をさらに含む場合に選択され、任意で該リンパ球がT細胞、任意でCD8+T細胞である、実施形態225に記載の方法。
227.該腫瘍組織試料が、腫瘍浸潤免疫細胞、腫瘍細胞、間質細胞、またはそれらの任意の組み合わせを含む、実施形態222及び224〜226のいずれかに記載の方法。
228.該結合試薬が、抗体もしくは抗原結合断片、タンパク質リガンドもしくは結合パートナー、アプタマー、アフィマー、ペプチド、またはハプテンである、実施形態222及び224〜227のいずれかに記載の方法。
229.該結合試薬が、抗PD−L1抗体または抗原結合断片である、実施形態222、224、227または228に記載の方法。
230.該結合試薬が、実施形態1〜71のいずれかに記載のバリアントCD80ポリペプチドを含む、実施形態222〜229のいずれかに記載の方法。
231.該バリアントCD80ポリペプチドが、該IgVドメインまたはその特異的結合断片を含む、実施形態230に記載の方法。
232.該IgVドメインまたはその特異的結合断片が、該結合試薬の唯一のCD80部分である、実施形態230または実施形態231に記載の方法。
233.該バリアントCD80ポリペプチドが、該野生型または非改変CD80ポリペプチドと比較してPD−L1への結合に対する増加した親和性を示す、実施形態230〜232のいずれかに記載の方法。
234.該結合試薬が、検出可能部分または検出することのできる部分である部分に直接的または間接的に連結される、実施形態222及び224〜233のいずれかに記載の方法。
235.該部分がFc領域である、実施形態234に記載の方法。
236.該Fc領域が非ヒト、任意でマウスまたはウサギである、実施形態235に記載の方法。
237.結合した結合試薬の存在の検出が、免疫組織化学、偽免疫組織化学、免疫蛍光、フローサイトメトリー、ELISA、または免疫ブロッティングによる、実施形態222及び224〜236のいずれかに記載の方法。
238.免疫調節タンパク質を対象に投与することをさらに含む、実施形態225〜237のいずれかに記載の方法。
239.対象がヒト対象である、実施形態187〜238のいずれかに記載の方法。
240.免疫調節タンパク質が、第1の多量体化ドメインに連結された第1のバリアントCD80ポリペプチド及び第2の多量体化ドメインに連結された第2のバリアントCD80ポリペプチドを含む多量体であり、該第1及び第2の多量体化ドメインが、相互作用して第1及び第2のバリアントCD80ポリペプチドを含む多量体を形成する、実施形態215〜239のいずれかに記載の方法。
241.多量体が二量体である、実施形態240に記載の方法。
242.第1のバリアントCD80ポリペプチド及び第2のバリアントCD80ポリペプチドが同一である、実施形態240または実施形態241に記載の方法。
243.多量体化ドメインが、Fc領域であるか、またはそれを含む、実施形態240〜242のいずれかに記載の方法。
244.Fc領域が、野生型Fc領域と比較して1つまたは複数のアミノ酸置換を含むバリアントFc領域であり、該Fc領域が、野生型Fc領域と比較して低下した1つまたは複数のエフェクター機能を示し、任意で該野生型FcがヒトIgG1である、実施形態243に記載の方法。
245.CD80ポリペプチドが、非改変CD80またはその特異的結合断片に、SEQ ID NO:2の番号付けに基づいた7、12、13、15、16、18、20、21、22、23、24、25、26、27、28、29、30、31、33、34、35、36、37、38、41、42、43、44、46、47、48、51、53、54、55、57、58、61、62、63、64、65、67、68、69、70、71、72、73、74、76、77、78、79、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95,及び/または97位に対応する1つまたは複数のアミノ酸改変を含む、実施形態215〜244のいずれかに記載の方法。
246.CD80ポリペプチドが、非改変CD80またはその特異的結合断片に、
の中から選択される、1つまたは複数のアミノ酸改変を含み、該アミノ酸置換の位置(複数可)がSEQ ID NO:2に記載のCD80の位置に対応する、実施形態215〜245のいずれかに記載の方法。
247.1つまたは複数のアミノ酸改変が、
の中から選択される、実施形態215〜245のいずれかに記載の方法。
248.バリアントCD80ポリペプチドが、CD28への結合を保持する、実施形態215〜247のいずれかに記載の方法。
249.バリアントCD80ポリペプチドが、CD28のエクトドメインに対する非改変CD80ポリペプチドの結合親和性と比較して、CD28のエクトドメインに対する親和性の、少なくとも2%、3%、4%、5%、6%、7%、8%、9%、10%、12%、15%、20%、25%、30%、35%、40%、50%、55%、60%、65%、70%、75%、80%、85%、90%もしくは95%、または少なくとも約2%、約3%、約4%、約5%、約6%、約7%、約8%、約9%、約10%、約12%、約15%、約20%、約25%、約30%、約35%、約40%、約50%、約55%、約60%、約65%、約70%、約75%、約80%、約85%、約90%もしくは約95%を保持する、実施形態248に記載の方法。
250.バリアントCD80ポリペプチドが、CD28のエクトドメインへの非改変CD80の結合親和性と比較してCD28のエクトドメインに対して増加した結合親和性を示す、実施形態215〜249のいずれかに記載の方法。
251.CD28のエクトドメインに対する増加した親和性が、CD28のエクトドメインへの非改変CD80の結合親和性と比較して1.2倍、1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、150倍、または200倍より大きく増加する、実施形態250に記載の方法。
252.免疫応答を増加させることにより、対象の疾患または状態を治療する、実施形態219〜251のいずれかに記載の方法。
253.疾患または状態が、腫瘍またはがんである、実施形態219〜252のいずれかに記載の方法。
254.疾患または状態が、黒色腫、肺癌、膀胱癌、血液学的悪性疾患、肝臓癌、脳癌、腎臓癌、乳癌、膵臓癌、大腸癌、脾臓癌、前立腺癌、精巣癌、卵巣癌、子宮癌、胃癌、筋骨格癌、頭頸部癌、消化管癌、生殖細胞癌、または内分泌及び神経内分泌癌から選択される、実施形態219〜253のいずれかに記載の方法。
255.(a)生体試料を請求項1〜71のいずれか1項に記載のバリアントCD80ポリペプチドを含む結合試薬と接触させることと、
(b)生体試料の細胞内または細胞上に結合した結合試薬の存在を検出することと、
を含む、生体試料中のCD80結合パートナーを検出する方法。
256.結合パートナーが、PD−L1、CD28、CTLA−4またはこれらの組み合わせである、実施形態255に記載の方法。
257.バリアントCD80ポリペプチドが、非改変CD80またはその特異的結合断片のIgVドメインまたはIgCドメインまたはその特異的結合断片の1つまたは複数の位置に1つまたは複数のアミノ酸改変を含み、該バリアントCD80ポリペプチドが、PD−L1のエクトドメインへの非改変CD80の結合親和性と比較してPD−L1のエクトドメインに対して増加した結合親和性を示す、実施形態255または実施形態256に記載の方法。
258.生体試料が、体液、細胞、もしくは組織試料であるか、またはそれを含む、実施形態255〜257のいずれかに記載の方法。
259.体液が、血清、血漿、または尿である、実施形態258に記載の方法。
260.組織試料が、腫瘍組織試料である、実施形態258に記載の方法。
261.腫瘍組織試料が、腫瘍浸潤免疫細胞、腫瘍細胞、間質細胞、またはそれらの任意の組み合わせを含む、実施形態260に記載の方法。
262.バリアントCD80ポリペプチドが、IgVドメインまたはその特異的結合断片を含む、実施形態255〜261のいずれかに記載の方法。
263.IgVドメインまたはその特異的結合断片が、結合試薬の唯一のCD80部分である、実施形態262に記載の方法。
264.結合試薬が、検出可能部分である標識または検出することのできる部分に直接または間接的に連結される、実施形態255〜263のいずれかに記載の方法。
265.該部分がFc領域である、実施形態264に記載の方法。
266.該Fc領域が非ヒト、任意でマウスまたはウサギである、実施形態265に記載の方法。
267.結合した結合試薬の存在の検出が、免疫組織化学、偽免疫組織化学、免疫蛍光、フローサイトメトリー、ELISA、または免疫ブロッティングによる、実施形態255〜266のいずれかに記載の方法。
IX.実施例
以下の実施例は、単に例示を目的に含まれるものであり、本発明の範囲を限定することを意図するものではない。
実施例1
IgSFドメインの変異体DNA構築物の生成
実施例1は、酵母ディスプレイライブラリーとしての酵母の表面上での翻訳及び発現のための、ヒトCD80 IgSFドメインの変異体DNA構築物の生成について記載する。
A.縮重ライブラリー
以下の免疫グロブリン様V型(IgV)ドメインを含有する、SEQ ID NO:3031に記載の野生型ヒトCD80配列:
に基づいて構築物を生成した。
縮重コドンによる完全または部分的ランダム化の特定の残基を標的とするライブラリーのために、様々なアミノ酸置換をコードする特定の混合塩基セットなどの縮重コドンを、URL:rosettadesign.med.unc.edu/SwiftLib/におけるアルゴリズムを使用して生成した。一般的に、変異させる位置はURL:rcsb.org/pdb/explore/explore.do?structureId=1I8Lにおける、CTLA4に結合されたCD80の結晶構造情報から選択し、ターゲットライブラリーを、CTLA4への改善された結合物質を選択するために、CD80::CTLA4界面に基づいて設計した。例えば、構造情報を使用して、縮重コドンを用いた変異誘発の、接触または非接触界面残基を特定した。この分析は、URL:spdbv.vital-it.chで利用可能な構造ビューアを使用して実施した。
ライブラリー設計の次のステップは、変異誘発のために選択した残基のどれが保存された残基であったかを特定するためのヒト、マウス、ラット、及びサルのCD80配列のアラインメントであった。この分析をふまえると、保存された標的残基は、保存的アミノ酸変化と野生型残基のみを指定した縮重コドンによって変異した。保存されていない残基はより積極的に変異したが、野生型残基も含まれた。標的タンパク質の過剰な変異誘発を避けるために、野生型残基もコードする縮重コドンを配置した。同じ理由で、最大20位置のみを各ライブラリーの変異誘発の標的とした。変異分析は、リガンド/カウンター構造に向かう側鎖との結合表面の6Å以内にある接触及び非接触界面残基に焦点を当てた。
ターゲットライブラリーをコードするDNAを生成するために、長さが最大80ヌクレオチドであり、変異誘発の標的となる残基位置に縮重コドンを含有する重複オリゴを、Integrated DNA Technologies(Coralville,USA)から注文した。オリゴヌクレオチドを滅菌水に溶解し、等モル比で混合し、95℃で5分間加熱し、アニーリングのために室温までゆっくりと冷却した。次にIgVドメイン遺伝子配列の開始及び末端にアニールするIgVドメイン特異的オリゴヌクレオチドプライマーを使用して、PCR産物を生成した。次に、pBYDS03クローニングベクター(Life Technologies,USA)と、BamHI及びKpnIクローニングサイト以外及び以内で40bp重複するIgVドメイン特異的オリゴヌクレオチドを使用して、前ステップの100ngのPCR産物を増幅し、エレクトロポレーション毎に少なくとも合計12μgのDNAを産生した。両方のポリメラーゼ連鎖反応(PCR)は、OneTaq 2x PCRマスターミックス(New England Biolabs,USA)を使用した。第2のPCRの産物は、PCR精製キット(Qiagen,Germany)を使用して精製し、滅菌脱イオン水に再懸濁した。あるいは、最大200bpの長さのUltramers(登録商標)(Integrated DNA Technologies)をメガプライマーPCRと併用し(URL:http://www.ncbi.nlm.nih.gov/pmc/articles/PMC146891/pdf/253371.pdf)、複数の小さな重複プライマーを使用して容易に組み込むことができなかった縮重コドンの大きなストレッチを生成した。メガプライマーPCRを使用した完全長産物の生成後、酵母への相同組換えのためのpBYDS03クローニングバリアントとの40bp重複領域を含有するDNAプライマーを使用して、変異体IgVドメインライブラリーを再度PCR増幅した。
ライブラリー挿入を準備するために、pBYDS03ベクターをBamH1及びKpn1制限酵素(New England Biolabs,USA)で消化し、大きなベクター断片をゲル精製して、滅菌脱イオン水に溶解させた。総量50μLの脱イオン水及び滅菌水中で12μgのライブラリーDNAインサートと4μgの線状ベクターを混合することで次ステップのためのエレクトロポレーション可能DNAを生成した。標的ライブラリーを生成するための別の方法は、縮重コドンを含有するオリゴヌクレオチドを用いて標的IgVドメインの部位特異的突然変異誘発(Multisite kit,Agilent,USA)を行うことであった。このアプローチを使用して、変異誘発のためにDNAのいくつかの特定のストレッチのみを標的とするサブライブラリーを生成した。これらの場合、選択ステップに進む前にサブライブラリーを混合した。一般に、ライブラリーサイズは10E7〜10E8個のクローンの範囲であったが、ただし、サブライブラリーは10E4〜10E5の範囲でしかなかった。
B.ランダムライブラリー
ランダムライブラリーもまた構築して、SEQ ID NO:3031(IgVドメインを含有する)に記載のCD80のIgVドメインのバリアントを特定した。野生型CD80 IgVドメインをコードするDNAを、酵母ディスプレイベクターpBYDS03のBamH1とKpn1部位との間にクローニングし、次いで、同じ制限酵素を使用して切り離した。次に、切り離したDNAをGenemorph II Kit(Agilent Genomics、USA)で変異誘発させて、ライブラリーバリアント当たり平均3〜5個のアミノ酸変化を生成した。次いで、変異誘発させたDNAを2ステップPCRによって増幅し、ターゲティングライブラリーについて上記のとおりさらに処理した。
ビーズ及び反復FACSを使用して数回の選択を完了後、クローンのプールを、エラープローンPCRによってさらに変異した。したがって、第2世代の変異体ライブラリーは、テンプレートとして野生型IgVプラスミド配列ではなくテンプレートとして選択出力DNAを使用しているが、上記の手順に従って作成した。
実施例2
酵母へのDNAライブラリーの導入
縮重及びランダムCD80ライブラリーDNAを酵母に導入するために、酵母BJ5464株(ATCC.org;ATCC number 208288)のエレクトロポレーションコンピテント細胞を調製し、基本的に記載されるように上記ステップのエレクトロポレーション可能DNAを用いてGene Pulser II(Biorad,USA)でエレクトロポレーションした(Colby,D.W.et al.2004 Methods Enzymology 388,348−358)。唯一の例外は、改変プラスミドpBYDS03によって担持されるLEU2選択マーカーに対応するために形質転換細胞を非誘導最小選択SCD−Leu培地中で成長させたことであった。1リットルのSCD−Leu培地は、14.7グラムのクエン酸ナトリウム、4.29グラムのクエン酸一水和物、20グラムのデキストロース、6.7グラムの酵母窒素ベース、及び1.6グラムのロイシン不含酵母用合成ドロップアウト培地サプリメントからなる。0.22μMの真空濾過装置を使用して、使用前に培地を滅菌濾過した。
ライブラリーサイズは、新たに回収した細胞の希釈物をSCD−Leu寒天プレート上にプレーティングし、次いで、1プレート当たり少なくとも50個のコロニーを生成したプレーティング由来の単一コロニーの数からライブラリーサイズを推定することによって決定した。エレクトロポレーションした培養物の残りを飽和まで増殖させ、この培養物に由来する細胞をもう一度同じ培地中で1/100で継代培養して、非形質転換細胞の割合を最小限に抑え、2つ以上のライブラリーバリアントを含有し得る細胞からプラスミドの分離を可能にした。ライブラリーの多様性を維持するために、計算したライブラリーサイズよりも少なくとも10×以上の細胞を含有する接種源を使用してこの継代培養ステップを行った。第2の飽和培養物に由来する細胞を、滅菌25%(重量/体積)グリセロールを含有する新鮮培地に10E10個/mlの密度に再懸濁して、−80℃で凍結及び保存した(凍結ライブラリーストック)。
実施例3
酵母の選択
実施例3は、CD80の親和性改変バリアントを発現する酵母細胞の選択を記載する。CD80へのCTLA4の結合がCD80へのCD28の結合に拮抗することは確立している(Schwartz J.C.et al.Nature 410,604−08,2001)。CD28よりもCTLA4に選択的に結合するCD80変異体を特定するため、CD80変異体ライブラリーの細胞に、反復回の正及び負のFACSソーティングならびに変異誘発を実施した。
推定したライブラリーサイズの少なくとも10倍に等しい数の細胞を、個々のライブラリーストックから解凍し、非誘導SCD−Leu培地中1.0×10E6個の細胞/mlに懸濁し、一晩増殖させた。翌日、ライブラリーサイズの10倍に等しい数の細胞を2000RPMで2分間遠心分離し、誘導SCDG−Leu培地中0.5×10E6個の細胞/mlに再懸濁した。1リットルのSCDG−Leu誘導培地は、水に溶解させて0.22μmの膜濾過装置に通して滅菌した、Na2HPO4 5.4グラム、NaH2PO4・H20 8.56グラム、ガラクトース20グラム、デキストロース2.0グラム、酵母窒素ベース6.7グラム、及びロイシン不含酵母用合成ドロップアウト培地サプリメント1.6グラムからなる。培養物を室温で1日誘導培地中で増殖させて、酵母細胞表面でライブラリータンパク質の発現を誘導した。
細胞は、コグネイトリガンドを負荷したプロテインA磁気ビーズ(New England Biolabs,USA)を使用して2回選別し、非結合物質を減らし、その外因性組換えカウンター構造体タンパク質に結合する能力を有する全てのCD80バリアントを濃縮した。これに続いて、外因性カウンター構造体タンパク質染色を使用した複数回の蛍光活性化細胞ソーティング(FACS)を行って、CTLA4−Fc(R&D Systems,USA)への改善された結合を示す酵母細胞の画分を濃縮した。これらの正の選択を負のFACS選択と交互に行い、CD28−Fcに結合したCD80クローンを除去した。磁気ビーズの濃縮及びフローサイトメトリーによる選択は、基本的にMiller K.D.,et al.,Current Protocols in Cytometry 4.7.1−4.7.30,July 2008に記載されるように実施した。
CD80ライブラリーと共に、標的リガンドタンパク質は、以下のとおり使用した:内部産生ヒトrCTLA4−Fc、ヒトrCD28−Fc、及びヒトrPD−L1(R&D Systems,Minneapolis,USA)。磁気プロテインAビーズは、New England Biolabs,USAから得た。2色フローサイトメトリーソーティングのために、Bio−Rad S3e sorterを使用した。CD80提示レベルを、Alexafluor 488(Life Technologies,USA)で標識した抗ヘマグルチニン(HA)抗体でモニタリングした。Fc融合タンパク質rCTLA4Fc、rPD−L1またはrCD28Fcのリガンド結合を、PEコンジュゲートヒトIg特異的ヤギFab(Jackson ImmunoResearch,USA)で検出した。ダブレット酵母を前方散乱(FSC)/側方散乱(SSC)パラメータを使用して除去し、そしてソートゲートは、FL1でより限定されたタグ発現結合を保持するFL2で検出されたより高いリガンド結合に基づいた。
フローサイトメトリーソートからの酵母アウトプットを、より高い特異的結合親和性についてアッセイした。ソートアウトプット酵母を増殖及び再誘導して、これらがコードする特定のIgSF親和性改変ドメインバリアントを発現させた。次いで、この集団を、フローサイトメトリーによって、親の野生型酵母株、またはビーズアウトプット酵母集団のような任意の他の選択されたアウトプットと比較することができる。
CD80について、各集団を抗HA(ヘマグルチニン)タグ発現及び抗ヒトFc二次で二重染色してリガンド結合を検出することによって、rCTLA4Fc、rPD−L1、またはrCD28Fcの結合について第2のFACSアウトプット(F2)を親CD80酵母と比較した。
選択したバリアントCD80 IgVドメインをさらに融合タンパク質としてフォーマット化し、以下に記載されるように結合活性及び機能活性について試験した。
実施例4
Fc融合物として及び様々な免疫調節タンパク質タイプにおける選択アウトプットの再フォーマット化
実施例4は、Fc分子に融合したCD80の親和性改変(バリアント)免疫グロブリン様Vタイプ(IgV)ドメイン(バリアントIgVドメイン−Fc融合分子)を含有する免疫調節タンパク質として実施例3で同定された選択アウトプットの再フォーマット化を記載する。
最終フローサイトメトリーCD80ソートからのアウトプット細胞プールをSCD−Leu培地中末端密度まで増殖させた。各アウトプットからのプラスミドDNAを、酵母プラスミドDNA単離キット(Zymoresearch,USA)を使用して単離した。Fc融合物について、最適なFc融合ベクターへのクローニングに好適な制限部位を付加したPCRプライマーを使用して、プラスミドDNAプレップから変異体標的IgVドメインのコーディングDNAをバッチ増幅させた。制限消化後、PCR産物を、Fc融合ベクターにライゲーションし、続いて大腸菌株のXL1 Blue(Agilent,USA)またはNEB5alpha(New England Biolabs)に、供給者の指示どおりヒートショック形質転換した。あるいは、アウトプットは、Gibson Assembly Mastermix(New England Biolabs)を使用してin vitro組換えを実施するためにFc融合ベクターといずれかの端に40塩基対のオーバーラップ領域を含有するプライマーによってPCR増幅し、その後、大腸菌系統NEB5alphaへのヒートショック形質転換に使用した。Fc融合ベクターの例は、pFUSE−hIgG1−Fc2(InvivoGen,USA)である。
形質転換反応の希釈物を、100μg/mlカルベニシリン(Teknova,USA)を含有するLB−寒天上にプレーティングして、選択のために単一コロニーを単離した。次いで、各形質転換からの最大96個のコロニーを、96ウェルプレート内、LB−カルベニシリンブロス(Teknova cat # L8112)中37℃で一晩飽和まで増殖させ、そして、全てのクローン中の変異(複数可)を特定するために各ウェルからの小アリコートをIgVドメインインサートのDNA配列決定に供した。サービス提供会社(Genewiz;South Plainfield,NJ)によって提供されるプロトコルを使用して、DNA配列決定用の試料調製を実施した。DNA配列決定用の試料を取り出した後、次いで残りの培養物にグリセロールを最終グリセロール含量25%まで加え、そして、後で使用するためプレートをマスタープレート(以下参照)として−20℃で保存した。あるいは、DNA配列決定用の試料を、ディスポーザブル96ウェルレプリケーター(VWR,USA)を使用して、増殖させた液体培養物から固体寒天プレートへのレプリカプレーティングによって生成した。これらのプレートを一晩インキュベートして成長パッチを生成し、そして、プレートをGenewizの指示どおりGenewizに送った。
Genewizで生成されたDNA配列決定データの分析からの関心対象のクローンの特定後、関心対象のクローンをマスタープレートから回収し、100μg/mlカルベニシリン(Teknova,USA)を含有する液体LB−ブロス中で密度まで個々に増殖させ、次いで、PureYield Plasmid Miniprep System(Promega)またはMidiPlus kit(Qiagen)のような標準キットを使用して、各クローンの約10μgのプラスミドDNAの調製に培養物を使用した。Genewiz配列決定データからの関心対象のクローンの同定は、一般に以下のステップを包含する。最初に、DNA配列データファイルをGenewizウェブサイトからダウンロードした。次いで、IgVドメインコード領域の開始点で始まるように全ての配列を手動でキュレーションした。次いで、URL:www.ebi.ac.uk/Tools/st/emboss_transeq/で利用可能な好適なプログラムを使用して、キュレーションした配列をバッチ翻訳した。次いで、翻訳した配列を、URL:multalin.toulouse.inra.fr/multalin/multalin.htmlで利用可能な好適なプログラムを使用してアライメントした。あるいは、Genewizで配列決定されたものを、Ugeneソフトウェア(http://ugene.net)を使用してアライメントを生成するために処理した。
次いで、関心対象のクローンを以下の基準を使用してアラインメントから特定した:1)同一のクローンがアライメント中に少なくとも2回生じる、及び2)変異がアライメント中に少なくとも2回、好ましくは別個のクローンで生じる。これらの基準のうちの少なくとも1つを満たしたクローンは、改善された結合に起因してソーティングプロセスによって濃縮されたクローンとみなした。
少なくとも1つの親和性改変ドメインを有するCD80のIgVドメインを含有するFc融合タンパク質である組換え免疫調節タンパク質(例えば、バリアントCD80 IgV−Fc)を生成するために、バリアントをコードするDNAは、以下のタンパク質をコードするために生成した:バリアント(変異体)CD80 IgVドメイン、続いて3つのアラニン(AAA)のリンカー、続いてEU番号付けによる変異C220S、R292C、N297G及びV302C(SEQ ID NO:277に記載の野生型ヒトIgG1 Fcを基準としたC5S、R77C、N82G及びV87Cに対応)を含有するSEQ ID NO:1713、またはEU番号付けによる変異C220S、L234A、L235E及びG237Aを含有するSEQ ID NO:1714に記載のエフェクター機能を欠く不活性Fc。あるいは、CD80 IgVドメインは類似の様式で融合されたが、アミノ酸(GSGGGGS;SEQ ID NO:1716)を含有するリンカー、続いてSEQ ID NO:1714に記載のエフェクター機能を欠く不活性Fcと融合した。場合によっては、CD80 IgVドメインは類似の様式で融合されたが、エフェクター活性が可能なヒトIgG1 Fc(エフェクター)と融合した。該構築物はシステインと共有結合を形成できる抗体軽鎖を含まないため、そのような例示的なヒトIgG1 Fc(SEQ ID NO:1429に記載)は、EU番号付けによる220位のシステイン残基のセリン残基への置換(C220S)(SEQ ID NO:277に記載の野生型または非改変Fcを基準とした5位(C5S)に対応)を含有した。
実施例5
Fc融合物の発現及び精製
実施例5は、上記実施例に記載されるようなバリアントIgV CD80を含有するFc融合タンパク質のハイスループット発現及び精製を記載する。
組換えバリアントFc融合タンパク質をExpi293発現系(Invitrogen,USA)を使用して浮遊適応化(suspension−adapted)ヒト胎児腎(HEK)293細胞から産生した。先のステップからの各プラスミドDNA 4μgをOpti−MEM(Invitrogen,USA)200μlに加え、同時にExpiFectamine 10.8μlを別のOpti−MEM 200μlに別々に加えた。5分後、プラスミドDNA 200μlをExpiFectamine 200μlと混合し、この混合物を細胞に加える前に追加で20分間さらにインキュベートした。1000万個のExpi293細胞を、10mlの滅菌円錐底ディープ24ウェル増殖プレート(Thomson Instrument Company,USA)の別々のウェルのExpi293培地(Invitrogen,USA)容量4ml中に分注した。プレートを、湿度95%及び8%CO2に設定された哺乳動物細胞培養インキュベーター内で120RPMで5日間振盪した。5日間のインキュベーション後、細胞はペレット化し、培養上清は保持した。
ハイスループット96ウェルフィルタープレート(Thomson Catalog number 931919)を使用して(各ウェルには60μLのMab SelectSure沈降ビーズ(GE Healthcare cat. no.17543801)を負荷した)上清からタンパク質を精製した。タンパク質は4つの連続した200μl画分の50mMの酢酸pH 3.3で溶出した。各画分のpHは、4μLの2μM Tris pH 8.0でpH 5.0を上回るように調節した。画分をプールし、Nanodrop機器(Thermo Fisher Scientific,USA)によって測定した280nmの吸光度を使用して定量し、Mini−Protean TGX Stain−Freeゲルに5μgの非還元タンパク質を負荷することによりタンパク質純度を評価した。次いで、タンパク質をBio Rad Chemi Doc XRSゲルイメージャーで視覚化した。
実施例6
親和性成熟IgSFドメイン含有分子の結合の評価
この実施例は、細胞発現CTLA4、PD−L1、及びCD28カウンター構造体への上記の実施例の精製タンパク質のFc融合結合試験を記載し、CD80ドメインバリアント免疫調節タンパク質の特異性及び親和性を評価する。ヒトCTLA4、PD−L1、及びCD28のそれぞれの完全長哺乳動物表面発現構築物は、pcDNA3.1発現ベクター(Life Technologies)で設計され、これはGenscript,USAから供給された。結合試験は、Expi293F一過性トランスフェクションシステム(Life Technologies,USA)を使用して、完全長哺乳動物表面リガンドを発現するために生成されたトランスフェクトHEK293細胞で実施した。対照として、モック(非トランスフェクト)細胞への結合も評価した。実験に必要な細胞数を決定し、そして製造業者の推奨プロトコルを使用して、適切な30mlスケールのトランスフェクションを実施した。CTLA4、PD−L1、CD28またはモックの30mlトランスフェクション毎に、7500万個のExpi293F細胞を発現構築物DNA 30μg及び希釈したExpiFectamine 293試薬1.5mlと48時間インキュベートし、その時点で染色用に細胞を採取した。
染色及びフローサイトメトリーによる分析のために、適切な一過性トランスフェクションまたは陰性対照(モック)の100,000個の細胞を96ウェル丸底プレート中にプレーティングした。細胞をスピンダウンし、染色緩衝液(PBS(リン酸緩衝生理食塩水)、1%BSA(ウシ血清アルブミン)、及び0.1%アジ化ナトリウム)中に20分間再懸濁して非特異的結合を遮断した。その後、細胞を遠心分離し、これを50μlの各候補バリアントCD80Fcタンパク質の実験に応じて、200nM〜91pMの各候補バリアントCD80Fcを含有する染色緩衝液に再懸濁した。対照として、野生型CD80−ECD−Fc(R&D Systems)、野生型CD80−ECD−Fc(不活性)、野生型IgV−Fc(不活性)及び/またはヒトIgG(Sigma)の結合活性も評価した。一次染色を氷上で45分間実施した後、染色緩衝液中で細胞を2回洗浄した。PEコンジュゲート抗ヒトFc(Jackson ImmunoResearch,USA)を染色緩衝液50μl中1:150に希釈し、細胞に加えて氷上でさらに30分間インキュベートした。二次抗体を2回洗い流し、細胞を4%ホルムアルデヒド/PBS中で固定し、そして、Intellicytフローサイトメーター(Intellicyt Corp,USA)で試料を分析した。トランスフェクタント及びモックトランスフェクトHEK293毎に、FlowJo Version 10ソフトウェア(FlowJo LLC,USA)で平均蛍光強度(MFI)を計算した。
例示的なCD80バリアントの2つの結合試験の結果を表10及び11に示す。当該表において、例示的なアミノ酸置換は、それぞれの参照非改変ECD配列の番号付けに対応するアミノ酸位置番号によって指定される。例えば、参照非改変ECD配列は、SEQ ID NO:2に記載の非改変CD80 ECD配列である。アミノ酸位置が中央に示され、対応する非改変(例えば、野生型)アミノ酸が番号の前に列挙され、特定されたバリアントのアミノ酸置換が番号の後に列挙される。2列目は、各バリアントIgV−Fc融合分子のバリアントIgVの配列番号識別子を記載する。
また、明記したコグネイトカウンター構造体リガンド(すなわち、CTLA−4、PD−L1またはCD28)を発現するように操作された細胞への各バリアントCD80 Fc融合分子の結合の平均蛍光強度(MFI)値によって測定した結合活性、及び同じ細胞発現カウンター構造体リガンドへのアミノ酸置換を含有しない対応する非改変CD80 IgV−Fc融合分子の結合と比較したバリアントCD80 IgV−FcのMFI比も示した。バリアントCD80IgV−FcのCD28カウンター構造体リガンドへの結合と比較したバリアントCD80IgV−FcのCTLA−4カウンター構造体リガンドへの結合との比率もまた、表の最後の列に示されている。
表10及び11に示すように、選択によりCTLA−4及び/またはPD−L1カウンター構造体リガンドに対して結合の増加を示すように親和性改変された多くのCD80 IgVドメインバリアントを特定した。加えて、この結果は、CD28カウンター構造体リガンドと比較してCTLA−4カウンター構造体リガンドへの結合(CTLA4:CD28の比率)の増加を示すいくつかのCD80 IgVドメインバリアントを含むCD28への結合の低下を示す多くのバリアントが選択されたことを示す。
(表10)CTLA4、CD28またはPD−L1でトランスフェクトしたHEK293細胞へのバリアントCD80の結合
(表11)CTLA4、CD28またはPD−L1でトランスフェクトしたHEK293細胞へのバリアントCD80の結合
実施例7
追加のバリアントCD80 IgVドメインの選択と結合活性の評価
カウンター構造体CTLA4、CD28、及びPDL1とのCD80 IgVバリアント相互作用の親和性及び機能的効力を改善するため、第2及び第3世代(Gen)のランダム変異誘発及び選択を実施例1〜3に実質的に記載された手順を使用して実行した。簡潔に述べると、酵母プラスミドDNAをFACS選択後の成長した酵母から単離し、変異誘発性PCRのテンプレートとして使用した。多様性を最大化するために、特性決定された個々のバリアント及びFACS選択されたバリアントのプールの両方をテンプレートとして使用した。得られたライブラリーは、反復回のFACS選択及び成長に供した。CD28親和性を維持しながらPDL1の親和性を増加させるため、複数のFASCソート進行経路を取った。アウトプットを生成するCD28−及びCTLA4+の選択を交互にする4つのFACS選択を行った第2世代の変異誘発性ライブラリーは、カウンター構造体に対して滴定すると、Fcベクターに再フォーマット化するように選択した。次のFACS選択経路を使用して酵母アウトプットをもたらした第3世代の変異誘発性ライブラリーは、カウンター構造体に対して滴定すると、Fcベクターに再フォーマット化するように選択した:1. 50nM PDL1+、2a. 1nM CTLA4+、2b. 20nM CTLA4−、2a3. 10nM PDL1+、2b3. 10nM PDL1+、2b34. 25nM CD28+。CD80の親和性改変バリアントを発現する酵母の選択後、選択したバリアントをIgV CD80バリアントを含有する追加のFc融合タンパク質を生成するためのFc融合として再フォーマット化した。配列分析後、タンパク質の産生、結合、及び機能的アッセイのために、個々のバリアントを選択した。第1世代の変異誘発のバリアントを表10に示し、第2世代を表11に示し、第3世代を表12及び13に示す。
選択した免疫調節融合タンパク質の、コグネイト結合パートナーへの結合を評価した。CD80コグネイト結合パートナーを発現する細胞の産生のため、huCTLA4及びhuPD−L1、完全長哺乳動物表面発現構築物を生成し、レンチウイルスに組み込み、CHO細胞に形質導入した。Bio−Rad S3細胞ソーター(Bio−Rad Corp.,USA)で、98%超の純度まで細胞を選別した。CD28を内因的に発現するJurkat/IL2レポーター細胞を使用してCD28への結合を検出した。
フローサイトメトリーによる染色及び分析のため、適切なトランスフェクト細胞の100,000個の細胞を96ウェル丸底プレート中にプレーティングした。細胞をスピンダウンし、染色緩衝液(リン酸緩衝生理食塩水(PBS)、1%ウシ血清アルブミン(BSA)、及び0.1%アジ化ナトリウム)中に20分間再懸濁して非特異的結合を遮断した。その後、細胞を遠心分離し、50μlの各候補バリアントCD80−Fcタンパク質の6点連続希釈物(100nM〜41pMの範囲の濃度)を含有する染色緩衝液に再懸濁した。一次染色を氷上で45分間実施した後、染色緩衝液中で細胞を2回洗浄した。フィコエリトリン(PE)コンジュゲート抗ヒトFc(Jackson ImmunoResearch,USA)を1:150に希釈し、細胞に加えて氷上でさらに30分間インキュベートした。次に、細胞を150μL/ウェルの染色緩衝液で2回洗浄し、2%ホルムアルデヒド/PBSで固定し、そしてIntellicytフローサイトメーター(Intellicyt Corp.,USA)で分析した。PE平均蛍光強度(MFI)をFlowJo Version 10ソフトウェア(FlowJo LLC,USA)で各細胞タイプについて計算した。
例示的なCD80バリアントの2つの結合研究の結果を表12及び13に示す。当該表において、例示的なアミノ酸置換が、それぞれの参照非改変IgV配列の番号付けに対応するアミノ酸位置番号によって指定される。例えば、参照非改変ECD配列は、SEQ ID NO:2に記載の非改変CD80 ECD配列である。アミノ酸位置が中央に示され、対応する非改変(例えば、野生型)アミノ酸が番号の前に列挙され、特定されたバリアントのアミノ酸置換が番号の後に列挙される。2列目は、各バリアントIgV−Fc融合分子のバリアントIgVの配列番号識別子を示す。
また、明記したコグネイトカウンター構造体リガンド(すなわち、CTLA−4、PD−L1またはCD28)を発現するように操作された細胞への33nMの各バリアントCD80 Fc融合分子の結合の平均蛍光強度(MFI)値によって測定した結合活性、及び同じ細胞発現カウンター構造体リガンドへのアミノ酸置換を含有しない非改変CD80−ECD−Fc融合分子(R&D Systems,USA)の結合と比較したバリアントCD80 IgV−FcのMFI比も示した。バリアントCD80 IgV−FcのCD28カウンター構造体リガンドへの結合と比較したバリアントCD80 IgV−FcのPD−L1カウンター構造体リガンドへの結合との比率もまた、表の最後の列に示されている。
示すように、選択によりPD−L1及び/またはCD28カウンター構造体に対して結合の増加を示すように親和性改変されたいくつかのCD80 IgVドメインバリアントを特定した。いくつかのバリアントがまたCTLA−4への結合を維持または増加させる一方で、他のものはCTLA−4への減少した結合を示した。加えて、この結果は、CD28カウンター構造体リガンドと比較してPD−L1カウンター構造体リガンドへの結合(PD−L1:CD28の比率)の増加を示すいくつかのCD80 IgVドメインバリアントを含むCD28への結合の低下を示す多くのバリアントが選択されたことを示す。したがって、バリアントは、フローサイトメトリーにより測定された細胞表面CTLA4、CD28、及びPD−L1の結合に固有のプロファイルを有する。
(表12)CTLA4またはPD−L1を安定的に発現するJurkat細胞(CD28)及びCHO細胞へのバリアントCD80フロー結合
(表13)CTLA4またはPD−L1を安定的に発現するJurkat細胞(CD28)及びCHO細胞へのバリアントCD80フロー結合
結合をさらに比較するため、様々な濃度の例示的なバリアントCD80 IgV−Fc分子を評価し、細胞表面発現PD−L1、CD28及びCTLA−4に対する結合について野生型CD80 IgV−Fcと比較した。例示的な試験したバリアントCD80 IgV−Fcには以下が含まれた:
上記のように、CD28への結合はCD28を発現するJurkat/IL2レポーター細胞を使用して評価し、CTLA−4及びPD−L1への結合はhuCTLA−4またはhuPD−L1を発現するように安定的にトランスフェクトされたCHO細胞を使用して評価した。明記したトランスフェクタントまたは細胞株がプレーティングされ、滴定量のCD80 vIgD−Fcまたは野生型CD80 IgV−Fcで染色した。結合タンパク質は、蛍光色素コンジュゲート抗huFc、及びフローサイトメトリーにより測定された平均蛍光強度(MFI)で検出した。図9Aにて示すように、いくつかの試験したCD80 vIgD−Fcは、野生型CD80よりも高い親和性でヒトPD−L1、ヒトCTLA−4、及びヒトCD28に結合した。
実施例8
Jurkat/IL2レポーターアッセイを用いた親和性成熟CD80 IgSFドメイン含有分子の生理活性の評価
この実施例は、CD28共刺激の遮断に対するCD80ドメインバリアント免疫調節タンパク質の生理活性を評価するためのJurkat/IL2レポーターアッセイを記載する。
アッセイの前日、アッセイプレートを調製した。アッセイプレートを調製するため、PBS中の、10nMの抗CD3抗体(クローンOKT3;BioLegend,カタログ番号317315)及び20nMのCD86−Fc(R&D Systems,カタログ番号141−B2)を100μL/ウェルで白い平底96ウェルプレート(Costar)に分取した。プレートを4℃で一晩インキュベートして、抗体及びCD86−Fcタンパク質をプレートの表面に付着させた。翌日、アッセイプレートのウェルを、アッセイの前に150μLのPBSで2回洗浄した。
アッセイの日、60μLの例示的なバリアントCD80 IgV−Fc融合分子及び対照、野生型CD80 IgV−Fcまたは野生型CD80(ECD)−Fc、分子、または陰性対照Fc単独は、アッセイ緩衝液(RPMI1640+5%ウシ胎児血清(FBS))または緩衝液のみで40nMの濃度に希釈し、新鮮な96ウェルポリプロピレンプレートのウェルに加えた。IL−2−ルシフェラーゼレポーターを発現するJurkatエフェクター細胞をカウントし、アッセイ緩衝液に再懸濁して、2x106細胞/mLの濃度にした。次に、Jurkat細胞懸濁液60μLをCD80−Fc融合分子または対照を含有するウェルに加えた。該細胞及びCD80タンパク質を室温で15分間インキュベートし、次いで、調製した抗CD3/CD86−Fcアッセイプレートのウェル毎に細胞/CD80タンパク質混合物100μLを移した。
アッセイプレートを短時間スピンダウンし(1200RPMで10秒)、37℃で5時間インキュベートした。5時間のインキュベーション後、プレートを取り外し、室温で15分間平衡化した。100μLのBio−Glo(Promega)をアッセイプレートのウェル毎に追加し、次いで、10分間オービタルシェーカーに置いた。BioTek Cytation 3ルミノメーターを使用して、積分時間1秒/ウェルで発光を測定した。
各バリアントCD80 IgV Fcについて平均相対発光値を決定し、野生型CD80 IgV−Fcタンパク質と比較して各バリアントについてIL−2レポーターシグナルの倍率増加を計算した。結果は以下の表14に提供する。
表14に示すように、例示的なバリアントCD80 IgV−Fc分子のほとんどは、IL−2−ルシフェラーゼレポーターを発現するJurkatエフェクター細胞と共培養すると、緩衝液のみまたはFcのみの陰性対照と比較してCD28共刺激が減少した(すなわち、遮断)。対照的に、バリアントCD80 IgV−Fc分子のいくつかは、野生型CD80 IgV−Fc分子と比較してCD28共刺激シグナルを増加させるようであり、作動活性の可能性を示唆した。
(表14)Jurkat/IL2レポーターアッセイ:CD28共刺激の遮断
実施例9
Jurkat/IL2レポーターアッセイを用いた、PD−L1の存在下及び非存在下での親和性成熟CD80 IgSFドメイン含有分子の生理活性の評価
この実施例は、不活性Fc分子(例えば、SEQ ID NO:1714)またはエフェクター活性を媒介することができるFc分子(SEQ ID NO:1429)のいずれかに融合し、PD−L1発現抗原提示細胞の存在下または非存在下でCD28共刺激シグナルを調節するCD80ドメインバリアント免疫調節タンパク質の能力を評価するJurkat/IL2レポーターアッセイを記載する。
A.PD−L1依存性CD28共刺激
IL−2−ルシフェラーゼレポーターを発現するJurkatエフェクター細胞(Promega Corp.,USAから購入)をJurkatアッセイ緩衝液(RPMI1640+5%FBS)に2x106細胞/mLで懸濁した。次にJurkat細胞を50μL/ウェルで、ウェル当たり合計100,000細胞をプレーティングした。
各ウェルに、25μLの試験タンパク質をJurkat細胞に加えた。試験タンパク質には、バリアントCD80 IgV−Fc(不活性)融合分子または完全CD80−ECD−Fc(R&D Systems,USA)または野生型CD80−IgV−Fc(不活性)が含まれた。全てのタンパク質を、200nM、66.7nM、及び22.2nM(PD−L1なし)または200nM、66.7nM、22.2nM、7.4nM、及び2.5nM(+PD−L1)で加えた。試験タンパク質または対照タンパク質とJurkat細胞を室温で15分間インキュベートした。形質導入細胞表面抗CD3単鎖Fv(OKT3)(すなわちPD−L1なし)またはOKT3及びPD−L1(すなわち+PD−L1)を提示するCHO由来人工抗原提示細胞(aAPC)を0.8x106細胞/mLにし、25μLの細胞を各ウェルに加え、各ウェルの最終容量を100μLにした。各ウェルの最終比は5:1 Jurkat:CHO細胞であり、試験タンパク質濃度は50、16.7または5.6nM(PD−L1なし)、または50、16.7、5.6、1.9、及び0.6nM(+PD−L1)であった。Jurkat細胞及びCHO細胞を、加湿した5%CO2インキュベーションチャンバーで、摂氏37度で5時間インキュベートした。次に、プレートをインキュベーターから取り出し、15分間室温に順応させた。100μLの細胞溶解及びルシフェラーゼ基質溶液(BioGloルシフェラーゼ試薬,Promega)を各ウェルに加え、プレートをオービタルシェーカーで10分間インキュベートした。BioTek Cytationルミノメーターを使用して、積分時間1秒/ウェルで発光を測定し、各試験試料について相対発光値(RLU)を決定した。結果を表15に提供する。
aAPCにPD−L1が存在しない場合、不活性Fcに融合したバリアントCD80分子はCD28を介して共刺激シグナルを誘導できないという観察と一致して、共刺激シグナルはほとんどまたは全く観察されなかった。しかしながら、PD−L1の存在下では、試験したいくつかのバリアントCD80−IgV−Fc(不活性)分子は、バリアント分子のCD28及び/またはPD−L1結合親和性と相関した濃度依存性のCD28共刺激を示した。この結果は、PD−L1に対する親和性が増加したバリアントCD80分子がCD28のPD−L1依存性共刺激を媒介できることを示している。
さらなる実験において、他のバリアントCD80 IgV−Fc(不活性)融合タンパク質を、各試験タンパク質の最終濃度が50nM及び5nMであるのを除いて上記のようにaAPC+/−PD−L1の非存在下でCD28刺激について試験した。各試験試料について相対発光値(RLU)を決定し、各バリアントCD80−IgV分子についてIL−2レポーターシグナルの倍率増加(または減少)を計算し、野生型CD80−ECD−Fc(不活性)及びCD80−IgV−Fc(不活性)タンパク質と比較した。
表16及び17に示すように、K562/OKT3/PD−L1 aAPC及び50nMのCD80−IgV−Fc(不活性)分子と共培養したJurkatエフェクター細胞のルシフェラーゼ活性は、試験したいくつかの分子で変化(増加または減少)した。aAPC上のPD−L1及びJurkat細胞上のCD28の同時結合により、CD28共刺激及び下流のIL−2シグナル伝達が増加した。野生型CD80−IgV−Fc(不活性)と比べて発光の倍率増加(または減少)も示されている。当該表において、最初の列は変異(複数可)を記載し、第2の列は、試験したCD80−IgV Fc(不活性)バリアントの各CD80−IgVの配列番号識別子を記載する。
(表16)Jurkat/IL2+K562/OKT3/PD−L1レポーターアッセイ:相対ルシフェラーゼ単位(RLU)
(表17)Jurkat/IL2+K562/OKT3/PD−L1レポーターアッセイ:相対ルシフェラーゼ単位(RLU)
活性をさらに比較するため、上記のK562/OKT3/PDL1 aAPC細胞株を使用して様々な濃度の例示的なバリアントCD80 IgV−Fc(不活性)をJurkat/IL2レポーター細胞におけるルシフェラーゼ活性の誘導について評価し、活性を野生型CD80 IgV−Fc(不活性)と比較した。試験した例示的なバリアントCD80 IgV分子は、
を含有した。図9Bにて示すように、例示的な試験したバリアントCD80 IgVドメイン含有分子は、用量依存的にPD−L1依存性CD28共刺激を誘導した。評価した濃度のいずれかにおいても、野生型CD80 IgV−FcによるPD−L1依存性CD28共刺激は観察されなかった。
B.PD−L1依存性共刺激後のサイトカイン産生
上記のK562/OKT3/PDL1 aAPC細胞をマイトマイシンcで処置し、滴定した漸増濃度のCD80 IgV−Fc(不活性)または野生型CD80 IgV−Fc(不活性)の存在下で初代ヒトpan T細胞と共培養した。試験した例示的なバリアントCD80−Fcは、
を含有した。さらなる対照として、初代ヒトpan T細胞もまた、例示的な抗PD−L1デュルバルマブまたはFc(不活性)のみ対照とともに培養した。図9Cに記載の結果は、試験したバリアントCD80−IgV−Fc分子が、培養上清中にIL−2分泌をもたらしたことを示し、これは試験した例示的なバリアントCD80−IgV−Fc分子によってPD−L1依存性共刺激が誘導されたという観察と一致する。野生型CD80−IgV Fcまたは他の試験対照とインキュベートした場合、T細胞培養物ではIL−2産生は観察されなかった。
C.Fc依存性CD28共刺激+/−PD−L1
さらなる実験において、バリアントCD80−IgV−Fc融合タンパク質(そのFcはFc受容体(FcR)への結合を介してエフェクター活性を媒介できるIgG1 Fc(例えばSEQ ID NO:1429)であった)についてCD28共刺激を評価した。実験は上記のパートAで説明したように実施したが、ただしCHO/OKT3及びCHO/OKT3/PD−L1細胞の代わりにOKT3(K562/OKT3)またはOKT3及びPD−L1(K562/OKT3/PD−L1)で安定的に形質導入したCD32発現K562細胞を使用した。その結果を表18に示す。
(表18)Fc受容体またはPD−L1依存性架橋を介したCD28共刺激
E35D、E35D/M43L/L70M、及びA26E/E35D/M47L/L85Qを含む、例示的な評価したバリアントCD80−IgV Fc(エフェクター)免疫調節タンパク質のいくつかは、FcRへの結合により架橋された場合、CD28共刺激をもたらさなかった。しかしながら、結果は、FcR(エフェクター)に結合可能なFcを有するいくつかの例示的な評価したバリアントは、FcR架橋によってトランスでのCD28共刺激を提供できることを示した。これらのうち、E35D/M47Iなどの例示的な評価したCD80−IgV Fc(エフェクター)免疫調節タンパク質のいくつかは、PD−L1とFcRの両方の架橋を介してCD28共刺激を増強した。場合によっては、この結果は、FcRとPD−L1の架橋によるCD28共刺激の増強が、PD−L1単独の架橋よりも強力であることを示した。
実施例10
T細胞刺激アッセイを用いた親和性成熟CD80 IgSFドメイン含有分子の生理活性の評価
不活性FcまたはエフェクターFcのいずれかを含有するCD80−IgV−Fc分子を、サイトカイン放出(IFN−γ及びIL−2)及びT細胞増殖により決定した、人工抗原提示細胞(aAPC)K562/OKT3+/−PD−L1の存在下でのT細胞を刺激するそれらの能力について、1nM、10nM及び100nMの3つの濃度で試験した。
100,000個の単離したPan T細胞を、8,000個のK562/OKT3またはK562/OTK3/PD−L1細胞(12.5:1の比率)及び1nM、10nM、または100nMのCD80−IgV−Fc(エフェクター)またはCD80−IgV−Fc(不活性)とインキュベートした。細胞混合物はまた、抗PD−L1抗体、野生型ヒトIgG1、ヒトIgG1 Fc(不活性)、野生型CD80 IgV−Fc(エフェクター)、野生型CD80 IgV−Fc(不活性)、野生型CD80 ECD−Fc(不活性)、野生型CD80 ECD−Fc(エフェクター)、または対照として処理なし、とインキュベートした。IFN−γ、IL−2、及び増殖は72時間のインキュベーション後に測定した。
IL−2放出の結果を表19に記載する。最初の実験では、ある特定の例示的な評価したバリアントCD80 IgV−Fc(エフェクター)分子の存在下でのT細胞及びK562/OKT3 aAPC(PD−L1を発現しない)の共培養がIL−2産生の増加をもたらした。第2の実験では、T細胞とK562/OKT3/PD−L1 aAPCの共培養時に、特定のバリアントCD80 IgV−Fc(不活性)分子の存在下でCD28共刺激が増加し、これは、これらのバリアントのPD−L1依存性CD28共刺激活性と一致した。PD−L1にほとんど結合しないCD80 IgV−Fc分子(すなわち、E35G/K54E/A71D/L72P)は、有意な共刺激及びIL−2産生をもたらさなかった。場合によっては、E35Dのような、ある特定のバリアントCD80 IgV−Fc(エフェクター)分子は、PD−L1発現aAPCの存在下でのみCD28共刺激をもたらすことができた。IFN−γ及び増殖の結果は、IL−2の放出で観察された結果と同様だった。
(表19)CD80−IgC−Fc分子のFc受容体またはPD−L1媒介性架橋を介した初代T細胞CD28共刺激
実施例11
PD−L1/PD−1相互作用またはPD−L1依存性共刺激を遮断するバリアントCD80ポリペプチドの評価
A.PD−L1/PD−1結合及び遮断
PD−L1発現細胞への選択された免疫調節融合タンパク質の結合を評価して、PD−L1/PD−1相互作用の遮断について試験した。CHO/PD−L1細胞をバリアントCD80 IgV−Fcドメイン含有分子の滴定によって染色し、洗浄し、次いで蛍光コンジュゲートPD−1−Fcとインキュベートした。試験した例示的なバリアントCD80 IgVドメイン含有分子は、
を含有した。対照として、抗PD−L1抗体及び野生型CD80 IgV−Fcもまた評価した。試料をフローサイトメーターで取り込み、蛍光標識PD−1のMFIをFlowjoソフトウェア分析によって決定した。図9Dにて示すように、試験した例示的なバリアントCD80 IgV−Fc分子は、PD−1のPD−L1への結合を拮抗またはこれを遮断することが示された。
B.活性
例示的なバリアントCD80−Fcポリペプチドを、上記のPD−1を発現するJurkat/IL−2レポーター細胞を使用してそれらのPD−L1依存性共刺激を送達する能力について評価した。Jurkat/IL−2レポーター細胞を、上記のK562/OKT3/PD−L1人工抗原提示細胞(aAPC)と、滴定量(40pM〜100nMの範囲)の例示的なバリアントCD80 IgV−Fcポリペプチドの存在下でインキュベートした。例示的なバリアントCD80 IgV−Fcポリペプチドには、例示的なFc(EU番号付けによるC220S/L234A/L235E/G237A;SEQ ID NO:1714)に融合した、
のいずれかのバリアントIgVを含有する分子がある。他の試験したバリアントCD80 IgV−Fcポリペプチドは、野生型IgG1(SEQ ID NO:1429)に融合したE35D/M47I/L70M,SEQ ID NO:199;またはE35D/M47L,SEQ ID NO:208)のいずれかのバリアントIgVを含有した。対照として、PD−L1発現細胞はまた、野生型CD80 IgV−Fc(SEQ ID NO:3031)または抗PDL1抗体(BioLegend USA)とインキュベートした。
Jurkat/IL−2/PD−1レポーター細胞を、Jurkatアッセイ緩衝液(RPMI1640+5%FBS)にウェル当たり100,000個の細胞をプレーティングした。次いで、Jurkat細胞を室温で15分間、試験または対照タンパク質とともにインキュベートした。次いで、K562/OKT3/PD−L1細胞を加えて、各ウェルが最終比5:1のJurkat:K562細胞になるようにした。Jurkat細胞、K562細胞、及び試験または対照タンパク質を、加湿した5%CO2インキュベーションチャンバーで、摂氏37度で5時間インキュベートした。次に、プレートをインキュベーターから取り出し、15分間室温に順応させた。100μLの細胞溶解及びルシフェラーゼ基質溶液(BioGloルシフェラーゼ試薬,Promega)を各ウェルに加え、プレートをオービタルシェーカーで10分間インキュベートした。BioTek Cytationルミノメーターを使用して、積分時間1秒/ウェルで発光を測定し、各試験試料について相対発光値(RLU)の倍率増加を決定した。
図9Eにて示すように、例示的な評価したバリアントCD80 IgV−Fcの追加によりTCR活性化のPD−L1媒介性抑制を遮断し、及び/またはCD28を作動させ、発光の増加をもたらした。PD−L1に対する結合親和性の増加が確認されたバリアント分子は、T細胞活性化の作動においてより大きな活性を示す。
実施例12
バリアントCD80ポリペプチドのIn Vivo抗腫瘍活性
A.CD80バリアントの抗腫瘍活性
マウスMC38腫瘍細胞にヒトPD−L1(MC38 hPD−L1)を安定的にトランスフェクトし、C57BL/6マウスに皮下移植した。不活性Fc対照、または不活性Fc分子(例えばSEQ ID NO:1714)もしくはエフェクター活性を媒介できるFc分子(SEQ ID NO:1429)のいずれかを融合したバリアントIgV(E35D/M47I/L70M,SEQ ID NO:199;またはE35D/M47L,SEQ ID NO:208)を含有する例示的なバリアントCD80 IgV−Fc分子を、移植後8、10、13、15、及び17日目に100μg/マウスを腹腔内注射した。腫瘍体積を経時的に追跡した。
図10にて示すように、Fc対照と比較して腫瘍増殖の抑制がCD80−IgVで処置した全てのマウスにおいて観察され、このことはバリアントCD80−IgV分子がin vivoで機能的に活性であることを示す。
B.抗腫瘍活性の用量依存性
1.腫瘍体積(50ug、100ug、及び500ug)
MC38 hPD−L1腫瘍細胞の移植後、約50〜51mm3の類似した腫瘍体積を含有する70匹の雌C57CL/6マウスを分類し、それぞれ14匹のマウスを含む5つの処置群に分けた。8、10、及び12日目に、群1(アイソタイプ対照)には、75μgのFc(SEQ ID NO:1714)のみを与え;群2、3、及び4には、GSG4Sリンカー(SEQ ID NO:1716)を介して、不活性なヒトFc(SEQ ID NO:1714)に融合したCD80バリアントE35D/M47L(SEQ ID NO:208)をそれぞれ50、100、及び500μg与え;群5には、100μgのヒト抗PD−L1 mAb(デュルバルマブ)を与えた。腫瘍体積は、7、10、及び12日目に測定した。13日目に、以下のセクションで説明するように、分析のために5匹の動物を屠殺した。17、20、及び27日目に各群の残りの9匹のマウスの腫瘍測定を再開した。26、28、及び31日目に、群1の動物(Fcアイソタイプ対照)に、100μgのE35D/M47L CD80−IgV−Fcの腫瘍内注射を与えた。
腫瘍体積の中央値及び平均値を図11に示す。図示のように、Fc対照と比較して、CD80−IgV−Fcで処置した場合、用量依存的な腫瘍体積の減少が観察された。この研究では、100μg〜500μgのCD80−IgV−Fcで処置したマウスにおいて観察された腫瘍体積の中央値は、抗PD−L1抗体対照で処置したマウスと同様であった。
2.サイトカイン分析
MC38腫瘍の酵素消化後、溶解液を遠心分離し、上清を収集し、アッセイの準備ができるまで−80℃で保存した。次に、各試料のマウスIFNγの濃度を、製造元の指示に従って市販のELISAキット(R&D Systems,Inc.)を使用して測定し、腫瘍重量または腫瘍から単離した総細胞数のいずれかに基づいて濃度を正規化した。図12に記載の結果は、最高用量(500μg)のE35D/M47L CD80−IgV−Fcが腫瘍溶解物中の最高濃度のIFNγをもたらしたことを示し、このことは、CD80−IgV−Fcがその処置の結果としてIFNγを産生していることを示唆しており、これは抗腫瘍免疫を促進することが知られている機序である。
C.CD80選択バリアントの抗腫瘍及び再刺激活性
95匹の雌C57BL/6マウスにMC38 hPD−L1腫瘍細胞を移植した。腫瘍を7日目に分類し、約60mm3の類似の腫瘍体積を持つ77匹のマウスを、それぞれ11匹のマウスを含む7つの処置群に分けた。7、9、及び11日目に、群1(アイソタイプ対照)には、75μgの不活性Fc(SEQ ID NO:1714)のみを与え;群2には、100μgのCD80バリアントE35D/M47V/N48K/V68M/K89N IgV(SEQ ID NO:2250)−Fc(不活性)を与え;群3には、100μgのCD80バリアントH18Y/A26E/E35D/M47L/V68M/A71G/D90G IgV(SEQ ID NO:2276)−Fc(不活性)を与え;群4には、100μgのCD80バリアントE35D/D46V/M47L/V68M/L85Q/E88D IgV(SEQ ID NO:2280)−Fc(不活性)を与え;群5には、100μgのCD80バリアントE35D/D46E/M47V/V68M/D90G/K93E IgV(SEQ ID NO:2284)−Fc(不活性)を与え;群6には、100μgのCD80バリアントE35D/M47L(SEQ ID NO:208)−Fc(不活性)を与え;群7には、100μgのヒト抗PD−L1 mAb(デュルバルマブ)を与えた。バリアントCD80−IgV−Fc分子の場合、CD80IgVドメインは、GSG4Sリンカー(SEQ ID NO:1716)を介して、SEQ ID NO:1714に記載の不活性なヒトFcに融合した。腫瘍体積を14、17、21、24、28、31、及び37日目に測定した。Fcアイソタイプ対照を投与した動物は、過剰な腫瘍量のために28日目までに死んだ。
腫瘍体積の中央値及び平均値を図13に示す。これは、全ての試験したCD80−IgV−Fc分子が、抗PD−L1対照と比較して、類似の、または場合によっては大幅に改善された活性を示したことを示す。試験が完了すると、群3の8匹のマウス、群4の2匹のマウス、群6の1匹のマウス、及び群7の2匹のマウスは、もはや腫瘍を検出できず、「腫瘍なし」と指定した。
49日目に、群3、4、6、及び7の腫瘍なしマウスならびに2匹のナイーブC57CL/6マウスを、hPD−L1 MC38細胞の追加注射で再刺激した。腫瘍体積を56、59、及び63日目に測定した。結果を図14に示す。ナイーブマウスは、予想どおり急速な腫瘍成長を示した。59日目に、群3の8/8匹のマウス、群4の1/2匹のマウス、群6の1/1匹のマウス、群7の2/2匹のマウスには腫瘍がなく、そして、63日目まで群3、群4、群6、及び群7の全てのマウスには腫瘍がなかった。この結果は、CD80−IgV−Fc分子を含む試験物質が、長期間持続性、耐久性のある免疫、抗腫瘍効果を提供することができたことと一致する。
2回目の用量が消化されてから3日後に屠殺したマウスの腫瘍及び生きたCD45−腫瘍細胞を、結合した不活性Fc、CD80バリアント−Fc、及び抗PD−L1抗体の存在についてフローサイトメトリーにより分析した。群1、3、6、及び7の結果を図15に提供する。上記の研究と同様に、結果は、CD80−IgV−Fc分子が抗PD−L1抗体対照と比較して腫瘍への結合が少ないことを示した。これにもかかわらず、SEQ ID NO:2276(H18Y/A26E/E35D/M47L/V68M/A71G/D90G)に記載の例示的なCD80−IgV−Fcで処置したマウスによって示されるようなCD80−IgV−Fcによる優れた活性を、CD28作動作用(PD−L1依存性CD28共刺激)及び/またはCTLA−4拮抗作用による活性における分化因子と一致して達成することができた。
D.CD80バリアント及び抗PD−L1抗体の抗腫瘍活性
hPD−L1 MC38腫瘍細胞を移植してから7日後に、75匹の動物を3つの処置群に分類した。群1には75μgの不活性Fc(SEQ ID NO:1714)を3回注射し、群2には100μgのCD80バリアントH18Y/A26E/E35D/M47L/V68M/A71G/D90G IgV(SEQ ID NO:2276)−Fc(不活性)を3回注射し、群3には100μgのヒト抗PD−L1 mAb(デュルバルマブ)を3回注射した(これらの注射は移植後8、10、及び12日目に行った)。11日目〜35日目まで、3〜4日毎に腫瘍体積を測定した。1回目、2回目、及び3回目の投与の3日後、各群から4匹のマウスを腫瘍及びLN分析のために屠殺し、13匹のマウスを研究期間を通して腫瘍体積を測定するために残した。
図16では、抗PD−L1対照と比較して、例示的なCD80−IgV−Fcによってこの試験で処置したマウスの中央値及び平均腫瘍体積においてより大きな減少が示される。18日目に、群1(Fc対照処置)の0/13匹のマウスには腫瘍がなく、群2(CD80バリアントIgV−Fc処置)の6/13匹のマウスには腫瘍がなく、群3(デュルバルマブ処置)の3/13匹のマウスには腫瘍がなかった。35日目に、それぞれ群1、2、及び3の、1/13、6/13、及び3/13匹のマウスは腫瘍がなかった。バリアントCD80−IgV−Fcで処置したマウスは、抗hPD−L1抗体または不活性Fc対照で処置したマウスの腫瘍と比較して、平均してサイズが縮小した腫瘍を示した。
1.腫瘍細胞の特性決定
Fc対照、CD80バリアントIgV−Fc、及び抗PD−L1抗体(デュルバルマブ)の2回目の投与の3日後、腫瘍及び流入領域リンパ節(LN)を各処置群の3〜4匹のマウスから採取した。組織は単一細胞懸濁液に処理され(腫瘍は処理の一部として酵素的に消化されたが、流入領域LNは酵素的に処理しなかった)、CD45+細胞サブセット(LNまたは腫瘍のいずれかの免疫細胞)でのCD8+T細胞のマルチカラーフローサイトメトリー分析、及び腫瘍細胞に結合した分子(CD80−IgV−Fcまたは抗PD−L1)を検出するためのCD45−細胞サブセット(腫瘍細胞)での%hIgG+染色に供した。結果は図17A〜Cに提供する。
CD8+T細胞の割合(%)は、Fc対照または抗PD−L1抗体処置(図17A(LN)及び図17B(腫瘍)と比較して、H18Y/A26E/E35D/M47L/V68M/A71G/D90G CD80−IgV−Fcで処置したマウスのTIL及びLNの両方で有意に大きかった(p<0.05またはp<0.01)。これは、H18Y/A26E/E35D/M47L/V68M/A71G/D90G CD80−IgV−Fc処置が抗腫瘍免疫の重要な寄与因子であるin vivoでのCD8+T細胞の拡大を促進できることを示している。さらに、H18Y/A26E/E35D/M47L/V68M/A71G/D90G CD80−IgV−Fcは腫瘍上で検出された(CD45−細胞でのhIgG+染色によってex vivoで)が、抗PD−L1抗体のレベルと比較して低下したレベルであった(図17C)。腫瘍上のE35D/M47L CD80−Fcの存在は低下しているにもかかわらず、検出された抗PD−L1と比較して、抗腫瘍活性は、抗PD−L1抗体と比較してCD80−Fcに対して優れていた(上記セクションB1を参照のこと)。これらの結果は、CD80−IgV−Fcの活性がPD−L1/PD−1拮抗作用に対してだけでない可能性があるが、分化因子がCD28作動作用(PD−L1依存性CD28共刺激)及び/またはCTLA4拮抗作用の活性に関連している可能性があるという観察と一致する。
実施例13
追加のバリアントCD80 IgVドメインの生成
A.追加のCD80 IgV結合ドメイン及び結合評価
追加のCD80バリアントを生成し、基本的に実施例2〜5に記載されるようにFc融合タンパク質として発現させた。バリアントを、実質的に実施例7に記載されるように結合について試験し、実質的に実施例9に記載される生理活性について試験した。結合及び活性研究の結果を表20〜23に提供する。
1.結合評価
(表20)CTLA4またはPD−L1を安定的に発現するJurkat(CD28)及びCHO細胞へのフロー結合
(表21)CTLA4またはPD−L1を安定的に発現するJurkat(CD28)及びCHO細胞へのフロー結合
2.生理活性評価
(表22)Jurkat/IL2+CHO/OKT3/PD−L1レポーターアッセイ:相対ルシフェラーゼ単位(RLU)
(表23)JURKAT/IL2+CHO/OKT3/PD−L1レポーターアッセイ:相対ルシフェラーゼ単位(RLU)
B.バリアントCD80 IgV結合ドメインの生成及びハイスループット選択
実施例7に記載した酵母アウトプットから300個のCD80 IgV−Fc構築物を生成した後、追加のCD80 IgVバリアントを選択した。次に、CD80 IgV−Fcタンパク質を含有する上清を、Octet(登録商標)システムを使用して、96ウェルプレートフォーマットでPD−L1結合についてスクリーニングした。上記の実施例7に記載されるように、高いPD−L1結合を示すバリアントを選択し、結合について再スクリーニングし、高いPD−L1結合を示したバリアントを選択した。例示的なバリアント及びFACS結合データを表24に提供する。選択したバリアントはまた、実質的に実施例9に記載される方法を使用して生理活性について評価し、その結果は表25に示されている。
(表24)CTLA4またはPD−L1を安定的に発現するJurkat(CD28)及びCHO細胞へのフロー結合
(表25)Jurkat/IL2+CHO/OKT3/PD−L1レポーターアッセイ:相対ルシフェラーゼ単位(RLU)
C.CD80 IgVコンセンサスバリアントの生成
CD80 IgVバリアントのコンセンサスバリアントは、上記の全ての酵母選択からのアウトプットのアラインメントに基づいて設計した。次いで、コンセンサス配列を使用してCD80 IgV−Fcタンパク質を生成し、次いで、上記のように結合及び生理活性について試験した。結合及び生理活性の結果を、それぞれ表26及び27に提供する。
(表26)CTLA4またはPD−L1を安定的に発現するJurkat(CD28)及びCHO細胞へのフロー結合
(表27)Jurkat/IL2+CHO/OKT3/PD−L1レポーターアッセイ:相対ルシフェラーゼ単位(RLU)
実施例14
CD80 IgVバリアントのパネルの結合活性の評価
SEQ ID NO:2250、2276、及び2280に記載の選択したバリアントのセットを参照して、結合及び活性に関与する残基を特定するため、復帰(逆)変異のパネルを設計し、実質的に実施例4及び5に記載されるようにFc融合タンパク質として発現させた。生成したバリアントは、表28に記載の様々な組み合わせでSEQ ID NO:2250、2276、及び2280に見いだされた1〜6個の変異を含んだ。
上記のように、結合及び生理活性についてバリアントを試験した。結合結果は表29及び30に記載されており、生理活性結果は表31及び32に記載されている。
(表29)CTLA4またはPD−L1を安定的に発現するJurkat(CD28)及びCHO細胞へのフロー結合
(表30)CTLA4またはPD−L1を安定的に発現するJurkat(CD28)及びCHO細胞へのフロー結合
(表31)Jurkat/IL2+CHO/OKT3/PD−L1レポーターアッセイ:相対ルシフェラーゼ単位(RLU)
(表32)Jurkat/IL2+CHO/OKT3/PD−L1レポーターアッセイ:相対ルシフェラーゼ単位(RLU)
実施例15
NNKライブラリー選択によるバリアント最適化
SEQ ID NO:2250、2276、及び2280に記載の位置に基づいて18、26、35、47、48、68、71、85、88、90、及び93位に変異の組み合わせを有する追加のバリアントCD80 IgVドメイン含有分子を生成した。縮重コドンが全ての潜在的なアミノ酸をコードするが、2つの停止残基TAA及びTGAのコードを防止するように、バリアントを選択した位置でNNKライブラリー(N=A、G、CまたはT、K=TまたはG)から生成した。実質的に実施例2に記載されるようにDNAを含有するNNKを酵母に導入し、酵母ライブラリーを生成した。該ライブラリーを使用して、実質的に実施例3に記載されるようにCD80の親和性改変バリアントを発現する酵母を選択した。
実質的に実施例4に記載されるようなrhPD−L1−Fcによる3回のFACS選択からのアウトプットを、実質的に実施例5に記載されるような不活性Fc融合タンパク質としてさらにフォーマット化し、選択し、発現させた。Fc−融合タンパク質を、実質的に実施例7に記載されるように結合について試験し、実質的に実施例9に記載される生理活性について試験した。野生型CD80 ECD−Fc(不活性)、野生型CD80 IgV−Fc(不活性)、H18Y/A26E/E35D/M47L/V68M/A71G/D90G(SEQ ID NO:2276)CD80 IgV−Fc(不活性)及び不活性Fcのみの結合及び生理活性も参考のために測定した。結合及び活性研究の結果は、それぞれ表33及び34に提供する。
(表33)CTLA4またはPD−L1を安定的に発現するJurkat(CD28)及びCHO細胞へのフロー結合
(表34)Jurkat/IL2+CHO/OKT3/PD−L1レポーターアッセイ:相対ルシフェラーゼ単位(RLU)
実施例16
CD80 IgV−Fcリンカーバリアント
CD80 IgV−Fcバリアントを、IgVとFcドメイン間の異なるリンク領域(リンカー)によって構築し、結合及び/または生理活性を評価した。CD80 E35D/M47V/N48K/V68M/K89N IgV−Fc及びE35D/D46V/M47L/V68M/L85Q/E88D IgV−Fcタンパク質を含有する融合タンパク質を、EAAAK(SEQ ID NO:3026)、(EAAAK)3(SEQ ID NO:3027)、GS(G4S)3(SEQ ID NO:3028)、GS(G4S)5(SEQ ID NO:3029)リンカーを含有して生成した。
野生型CD80(SEQ ID NO:3030に記載の骨格配列)においてIgVをIgCに接続する3つのアミノ酸が欠失したCD80 IgV骨格配列にE35D/M47V/N48K/V68M/K89NまたはE35D/D46V/M47L/V68M/L85Q/E88D改変を含有するCD80 IgV−Fcタンパク質もまた生成した。次いで、生成したバリアントCD80 IgVを、ヒンジ領域の6アミノ酸をさらに欠く不活性Fcに融合させた(FcはSEQ ID NO:3025に記載)。この戦略によって生成した分子は、「デルタ」リンカーと呼ばれる追加のリンカーなしでFcに直接融合した。
次いで、実施例7及び9に記載されるように、結合及び生理活性についてCD80−IgV−Fcバリアントを試験した。GSG4Sリンカー(SEQ ID NO::1716)を含有する、野生型CD80 IgV(SEQ ID NO:3031)−Fc(不活性)、CD80 ECD(SEQ ID NO:2)−Fc(不活性)及び不活性Fcのみの結合及び生理活性も比較のために測定した。結果を、それぞれ表34及び35に提供する。
(表34)CTLA4またはPD−L1を安定的に発現するJurkat(CD28)及びCHO細胞へのフロー結合
(表35)CTLA4またはPD−L1を安定的に発現するJurkat(CD28)及びCHO細胞へのフロー結合
実施例17
追加の親和性改変IgSFドメイン
本実施例は、免疫活性化及び阻害の両方で実証された二重の役割を有する免疫シナプス(IS)の他の構成成分である追加の親和性改変CD155、CD112、PD−L1、PD−L2、及びCD86(B7−2)免疫調節タンパク質の設計、作成、及びスクリーニングについて記載する。親和性改変NKp30バリアントもまた生成及びスクリーニングした。これらの実施例は、IgSFドメインの親和性改変により、免疫学的活性の増加及び減少の両方に作用できるタンパク質が生成されることを証明する。これらのドメインの様々な組み合わせは、バリアント親和性改変CD80とペアで融合(すなわち、スタック状)し、II型免疫調節タンパク質を形成し、免疫調節活性を達成する。
酵母ディスプレイライブラリーとしての翻訳及び発現のためのヒトCD155、CD112、CD80、PD−L1及びPD−L2のIgVドメインのバリアントをコードする変異体DNA構築物を、実質的に実施例1に記載されるように生成した。縮重コドンによる完全または部分的ランダム化のための特定の残基を標的とする標的ライブラリー及び/またはランダムライブラリーを構築して、CD112(SEQ ID NO:829)、CD155(SEQ ID NO:421)、PD−L1(SEQ ID NO:1196)のIgVのバリアント、及び実質的に実施例1に記載されるようにPD−L2(SEQ ID NO:1257)のIgVのバリアントを同定した。同様の方法をさらに使用して、NKp30(SEQ ID NO:355)のIgC様ドメインのライブラリーを生成した。
縮重またはランダムライブラリーDNAを実質的に実施例2に記載されるように酵母に導入して、酵母ライブラリーを生成した。該ライブラリーを使用して、実質的に実施例3に記載されるように、CD155、CD112、PD−L1、PD−L2、CD86(B7−2)、及びNKp30の親和性改変バリアントを発現する酵母を選択した。実質的に実施例3に記載されるように、細胞を処理して非結合物質を減らし、外因性組換えカウンター構造体タンパク質に結合する能力を有するCD155、CD112、PD−L1またはPD−L2バリアントを濃縮した。
CD80、CD86、及びNKp30ライブラリーによって、標的リガンドタンパク質は、R&D Systems(USA)から供給され、以下のとおりである:ヒトrCD28.Fc(すなわち、組換えCD28−Fc融合タンパク質)、rPDL1.Fc、rCTLA4.Fc、及びrB7H6.Fc。実質的に実施例3に記載されるように、2色フローサイトメトリーを実施した。フローサイトメトリーソートからの酵母アウトプットを、より高い特異的結合親和性についてアッセイした。ソートアウトプット酵母を増殖及び再誘導して、これらがコードする特定のIgSF親和性改変ドメインバリアントを発現させた。次いで、この集団を、フローサイトメトリーによって、親の野生型酵母系統、またはビーズアウトプット酵母集団のような任意の他の選択したアウトプットと比較することができる。
B7−H6への結合のために選択したNKp30酵母バリアントの場合、F2ソートアウトプットは、16.6nMのrB7H6.Fcで染色した場合、533のMFI値を示した一方、同じ濃度のrB7H6.Fcで染色した場合、親NKp30系統のMFIは90と測定された(6倍の改善)。
特定したNKp30バリアントの中には、SEQ ID NO:275に記載の位置に対応するNKp30細胞外ドメインの位置置に基づいて変異L30V/A60V/S64P/S86Gを含有するバリアントがあった。
表20Aで提供されるCD155バリアントの場合、TIGIT、CD96、及びCD226のそれぞれに対して個別にCD155ライブラリーを選択した。表20B−Fで提供されるCD155バリアントの場合、選択は、所望のカウンター構造体TIGIT及びCD96を使用した2つのポジティブ選択と、それに続いてCD226を除いて選択するカウンター構造体CD226を使用した1つの負の選択を伴い、バリアントCD155の結合特異性を改善した。選択は、カウンター構造体(TIGIT/CD96)の濃縮物を除き、基本的に上記の実施例3に記載されるように実施し、リードの同定を最適化するために、正のソートの選択ストリンジェンシーを変更した。負の選択のためのCD226の濃度は100nMに保たれた。
表21Aで提供されるCD112バリアントの場合、TIGIT、CD112R、及びCD226のそれぞれに対して個別にCD112ライブラリーを選択した。表21B−Cで提供される追加のCD112バリアントの場合、選択は、所望のカウンター構造体TIGIT及びCD112Rを使用した2つの正の選択と、それに続いてCD226を除いて選択するカウンター構造体CD226を使用した1つの負の選択を伴い、バリアントCD112の結合特異性を改善した。選択は、カウンター構造体(TIGIT/CD112R)の濃度を除き、基本的に上記の実施例3に記載されるように実施した。リードの同定を最適化するために、正のソートの選択ストリンジェンシーを変更した。負の選択のためのCD226の濃度は100nMに保たれた。
それぞれ表22A−Cまたは表23A及び23Bに示されるPD−L1及びPD−L2の場合、PD−1に対して酵母ディスプレイターゲットライブラリーまたはランダムPD−L1またはPD−L2ライブラリーを選択した。これに続いて、外因性カウンター構造体タンパク質染色を使用した2〜3回のフローサイトメトリーソーティングを行って、改善された結合物質を示す酵母細胞の画分を濃縮した。あるいは、PD−L1の場合、選択は、ヒトrCD80.Fc(すなわち、R&D Systems,USAのヒト組換えCD80 Fc融合タンパク質)によって実施した。主として上記のPD−1について記載されるように選択を実施した。磁気ビーズの濃縮及びフローサイトメトリーによる選択は、基本的にMiller K.D.,et al.,Current Protocols in Cytometry 4.7.1−4.7.30,July 2008に記載のとおりである。表22A〜BのPD−L1バリアントを、細胞発現カウンター構造体への結合について評価した。上記のスクリーニングで特定した追加のPD−L1バリアントを、表22Cに記載する。
実質的に実施例4に記載されるように、例示的な選択アウトプットは、それぞれがFc分子に融合したCD155の親和性改変(バリアント)IgV、CD112のバリアントIgV、PD−L1のバリアントIgV、PD−L2のバリアントIgV(バリアントIgV−Fc融合分子)を含有する免疫調節タンパク質として再フォーマット化し、Fc融合タンパク質は、実質的に実施例5に記載されるように発現及び精製した。
次に、実質的に実施例6に記載されるように、例示的なIgSFドメインバリアントの細胞発現カウンター構造体への結合を評価した。コグネイト結合パートナーを発現する細胞を産生し、実質的に実施例6に記載されるように結合研究及びフローサイトメトリーを実施した。加えて、Fc融合バリアントタンパク質の生理活性を、実質的に実施例6に記載される混合リンパ球反応(MLR)アッセイまたは抗CD3共固定化アッセイのいずれかによって特性決定した。
上記のように、各表について、例示的なアミノ酸置換は、それぞれの参照非改変ECD配列に対応するアミノ酸位置番号によって指定される(表2)。アミノ酸位置が中央に示され、対応する非改変(例えば、野生型)アミノ酸が番号の前に列挙され、特定したバリアントのアミノ酸置換が番号の後に列挙(または番号によって指定されて挿入)される。
また、コグネイトカウンター構造体リガンドを発現するように操作した細胞への各バリアントFc融合分子の結合の平均蛍光強度(MFI)値によって測定した結合活性、及び同じ細胞発現カウンター構造体リガンドへのアミノ酸置換を含有しない対応する非改変Fc融合分子の結合と比較したMFI比も示す。T細胞の活性を調節するPD−L2バリアントFc融合分子の機能的活性も、MLRアッセイにおいて、記載のバリアントFc融合分子によって生成した培養上清中のIFN−γの算出レベル(pg/mL)に基づいて示される。表23Bは、MLRアッセイにおいて対応する非改変IgV−Fcと比較した各バリアントIgV−Fcによって産生されたIFN−γの比率も示す。示すように、選択により少なくとも1つの、場合によっては2つ以上のコグネイトカウンター構造体リガンドの増加した結合を示すように親和性を改変した多数のCD155、CD112、PD−L1、及びPD−L2 IgSFドメインバリアントを特定した。加えて、結果は、バリアント分子の親和性改変もまた、免疫学的活性を増加及び減少させる改善された活性を示したことを示した。
(表20A)コグネイト結合パートナーに対して選択したバリアントCD155分子配列、結合データ、及び共刺激生理活性データ
(表20B)追加のCD155バリアント及び結合データ
(表20C)追加のCD155バリアント及び結合データ
(表20D)追加のCD155バリアント及び結合データ
(表20E)追加のCD155バリアント及び結合データ
(表20F)追加のCD155バリアント及び結合データ
(表21A)コグネイト結合パートナーに対して選択したバリアントCD112。分子配列/結合データ/及び共刺激生理活性データ
(表21B)追加のCD112バリアント及び結合データ
(表21C)追加のCD112バリアント及び結合データ
(表22A)選択したPD−L1バリアント及び結合データ
(表22B)PD−1またはCD80を発現する細胞へのフロー結合
(表22C)追加の親和性成熟IgSFドメイン含有分子
(表23A)PD−1に対して選択したバリアントPD−L2分子配列及び結合データ
(表23B)MLRにおいてPD−1に対して選択したPD−L2バリアントの生理活性データ
実施例18
抗PD−L1抗体と比較したHuPD−L1形質導入MC38腫瘍細胞に対する細胞傷害性
本実施例は、huPD−L1形質導入MC38腫瘍細胞のin vitro細胞傷害性の評価を記載している。非形質導入またはhuPD−L1によって形質導入したMC38腫瘍細胞をマイトマイシン−Cで処理し、1:5の比率でCFSEで標識したヒトpan T細胞でプレーティングした。WT IgG1 Fcまたは不活性Fcのいずれかとともに、E35D/M47I/L70M(SEQ ID NO:125)を含有するバリアントCD80 IgV−FcをMC38腫瘍細胞に100nMまたは10nMで添加し、細胞とともに72時間培養した。対照として、例示的な抗PD−1抗体ニボルマブまたはFc(不活性)のみの対照もまた評価した。次に、細胞を採取し、7−AAD生存性色素で染色した。フローサイトメーターで試料を取り込んだ後、死細胞の割合を、CFSE−ゲートにおいて7−AAD+細胞をゲーティングすることによってFlowjo分析を使用して計算した。図18にて示すように、huPD−L1形質導入MC38腫瘍細胞(ただし非形質導入MC38親細胞ではない)に対する細胞傷害性の増加を、例示的な評価したバリアントCD80 IgV−Fc分子により観察した。このアッセイでは、細胞傷害活性は、対照抗PD−1抗体の存在下では観察されず、バリアントCD80 IgV Fc分子が抗PD−1抗体対照と比較して改善された活性を示すことを示した。
実施例19
初代ヒトT細胞及び単球へのCD80バリアント結合
例示的なバリアントCD80−IgV Fc分子の初代CD28+ヒトCD4 T細胞及びヒトPD−L1+単球への結合を評価した。評価した例示的なバリアントCD80 IgV−Fc分子は、
を含有した。
非活性化ヒト汎T細胞を、様々な濃度のバリアントCD80 IgV−Fcとインキュベート後、次いで抗CD4、抗CD8及び抗ヒトIgGで染色して、CD80 IgV−FcのFc部分を検出した。対照として、野生型CD80 IgV−Fc、Fcのみの陰性対照、及びCD28結合ICOSL vIgD−Fcの結合も評価した。結合はフローサイトメトリーによって評価し、MFIはFlowjo分析ソフトウェアを使用して決定した。図19Aにて示すように、試験したバリアントCD80 IgV−Fc分子は、初代ヒトT細胞への異なる結合を示し、これは場合によっては野生型CD80−IgV−Fcよりも大きかった。
ヒト単球発現PD−L1への結合の場合、抗CD3及び抗CD28の存在下で、ヒトPBMCを一晩プレーティングした。翌日、細胞を採取し、様々な濃度のバリアントCD80 IgV−Fcまたは抗PD−L1抗体対照(デュルバルマブ)とインキュベートし、次いで、単球及び抗ヒトIgGを特定するために抗CD14で染色し、CD80 IgV分子のFc部分を検出した。結合はフローサイトメトリーによって評価し、MFIはFlowjo分析ソフトウェアを使用して決定した。図19Bにて示すように、試験した全てのバリアントCD80 IgV−Fc分子は、野生型CD80 IgV−Fcよりも初代ヒト単球への実質的により大きな結合を示した。
実施例20
PD−L1媒介性PD−1 SHP2動員のバリアントCD80 IgV−Fc拮抗作用
本実施例では、PD−L1/PD−1相互作用を遮断することによりPD−1への細胞質タンパク質チロシンホスファターゼSHP−2の動員に拮抗するバリアントCD80 IgV−Fc分子の効果を評価するためのJurkat/PD−1/SHP2シグナル伝達アッセイについて説明する。例示的なアッセイでは、組換えβ−ガラクトシダーゼ(β−gal)断片酵素ドナー(ED)タグ付きPD−1受容体及び酵素アクセプター(EA)タグ付きSHP−2ドメインを含有するJurkat細胞株を使用した(例:DiscoverX,USA;cat.93−1106C19)。アッセイでは、PD−1へのSHP−2動員により、EA及びEDが極めて近接し、この2つの酵素断片の相補が基質を加水分解して化学発光シグナルを生成する機能的β−gal酵素の形成を可能にする。
K562/OKT3/PD−L1 aAPCを様々な濃度の例示的なバリアントCD80 IgV−Fc(不活性)と30分間プレインキュベートした。評価した例示的なバリアントCD80 IgV−Fc分子は、
を含有した。対照として、野生型CD80 IgV−Fc(不活性)、抗PD−L1抗体、及びFc(不活性)のみの対照も評価した。Jurkat/PD−1/SHP2細胞(DiscoverX Pathhunter酵素相補断片動員株)を加え、細胞を2時間インキュベートした。β−galの基質(DiscoverXバイオアッセイ検出試薬)をウェルに加え、暗所で室温で1時間インキュベートし、ルシフェラーゼをマイクロプレートリーダー(BioTek Cytation)で測定した。
図20にて示すように、例示的なバリアントCD80 IgV−Fc分子は、ルシフェラーゼ活性を減少させ、これは、バリアントCD80 IgV−Fc分子がPD−L1媒介性PD−1 SHP2の動員に拮抗する強力な活性を示したという観察と一致する。強力な拮抗活性は、抗PD−L1陽性対照でも観察されたが、野生型CD80 IgV−Fc分子の存在下でルシフェラーゼシグナルの減少が検出されないことから明らかなように、野生型CD80 IgV−Fc分子はPD−1/PD−L1拮抗活性を示さなかった。
実施例21
B7/CTLA−4結合のCD80バリアント拮抗作用
CTLA−4及びB7結合の相互作用に拮抗するCD80 vIgD−Fcの能力を評価するため、表面ヒトCTLA−4を安定して発現するCHO細胞に
または野生型CD80 vIgD−Fc、または陽性対照としての抗CTLA−4抗体(イピリムマブ)を滴定してプレーティングした。洗浄後、細胞を25nMの蛍光色素コンジュゲート野生型CD80−Fcとインキュベートした。結合した蛍光競合タンパク質が検出され、フローサイトメトリーで測定した。図21にて示すように、全てのCD80 vIgD−Fcバリアント(ただし野生型CD80−Fcではない)がCTLA−4へのCD80の結合に拮抗した。
本発明は、例えば本発明の様々な態様を例示するために提供される、特定の開示された実施形態に範囲が限定されることを意図していない。記載の組成物及び方法に対する様々な修正が、本明細書の説明及び教示から明らかになるであろう。そのような変形は、本開示の真の範囲及び趣旨から逸脱することなく実践されてよく、これが本開示の範囲内にあると意図される。