発明の分野:
本発明は、新たなトキソプラズマ・ゴンディ(Toxoplasma gondii)タンパク質(以後、BCLA(脳嚢胞負荷関連抗原)と呼ぶ)に関し、発現がトキソプラズマ症(ブラディゾイト/嚢胞)の潜伏形態に制限された新たな血清マーカーである。本発明はまた、この新たなタンパク質に特異的に結合する抗体に関する。この特定のタンパク質及びその抗原性フラグメントは、潜伏形態のトキソプラズマ症の診断用に患者の血清中の自己抗体を検出するために使用することができる。
発明の背景:
古代のアピコンプレックス門は、世界の顕著な原生動物病原体の多くを含む。ヒトに対して最も致命的なのはプラスモジウムであり、マラリアの病原体であり、毎年50万人近くが死亡している。Tゴンディ(T. gondii)は、トキソプラズマ症の病因となる病原体であり、家畜、野生動物、及びコンパニオンアニマルの最も広汎性の原生動物の寄生虫の1つである。トキソプラズマ症は、重大な公衆衛生上の問題を提起する、ヒトにおける広汎性の食物由来の感染症であり、米国における食物由来の死亡の主な原因として認識されている(Scallan et al., 2015)。トキソプラズマ症は通常、免疫能力のあるヒトにおいては軽度疾患であり、生命を脅かす脳、肺、心臓、又は播種性の病理を経験する免疫不全患者においては主要な脅威となりうる。経胎盤感染症は、変動する程度の臨床症状を伴う先天性感染症を起こしうるが、先天性異常(例、水頭症、小頭症、頭蓋内石灰化)から胎児消失にわたる。
嚢胞形成性の腸内コクシジウム寄生虫Tゴンディは、性的伝播についてネコ固有宿主に依存する交互の2宿主ライフサイクルにより伝播される一方で、多様な代替宿主(齧歯類及びヒトを含む)において無性伝播を受ける。ネコ科温血後生動物におけるその長期間生息にわたり、Tゴンディは、周りの環境に応じて(宿主の先天的防御及び異なる宿主への適応を含む)、複雑な発生プログラムを開始する。中間宿主における最初の感染時に、寄生虫はタキゾイトとして複製し、身体中の多くの組織に播種する前に数において劇的に増える。最初の感染は一般的に、大量のタキゾイト集団の大規模な破壊に導く強力なTh1媒介性の炎症誘発性宿主応答により制御される一方で、微量のタキゾイトの亜集団は、遅く増殖するブラディゾイト段階に分化し、それは、長寿命の細胞(ニューロン及び骨格筋細胞を含む)中に存在する組織嚢胞内の宿主の生涯にわたり持続する(Dubey, 1997)。ネコ固有宿主による組織嚢胞の摂取によってサイクルが完了し、オーシストの排出を生じ、後者は高度に感染性である(Dubey, 2001)。
組織嚢胞は、肉食を介したヒト感染の主要な源であり、そのようなものとして、トキソプラズマ症の合併症としてのヒト疾患における重要な要因が、不可逆的な損傷を与えるブラディゾイトの能力に固定化される一方で、複製タキゾイト段階に戻って分化する。実際に、無症候性の寄生は、免疫能力のある宿主において生涯にわたる平衡及び保護を提供する一方で、持続的な免疫機能障害は、寄生虫の休眠を破壊し、ブラディゾイトがタキゾイト移行及びさらなるタキゾイト集団の増大を促進することが公知である。これらの組み合わされた過程は、最終的には、免疫不全である個人における主要な転帰として、脳炎、間質性肺炎、網膜脈絡膜炎、又はさらには播種性トキソプラズマ症を招く(Dard et al., 2018)。従って、偏性細胞内寄生虫としてのTゴンディの戦略は、非病原性、即ち、感染に対する宿主の自然免疫応答を減弱させるが、しかし、完全に相殺しない能力のための探求に基づき、このように、伝播を待つために要求される恒久的な居場所を確保することである。
Tゴンディのライフサイクルにおける組織嚢胞の重要性及び免疫不全の宿主におけるトキソプラズマ症の再燃のためのリザーバーとしてのその重要な役割にもかかわらず、ブラディゾイト及びそれらが形成する嚢胞の生物学は不十分にしか理解されていない。嚢胞は、遊離ブラディゾイトの移動及びブラディゾイト嚢胞の分裂の両方を介して、中間のタキゾイト段階を通過することなく、経時的に増殖し、播種し、慢性感染症を持続させると考えられている(Dzierszinski et al., 2004;Frenkel and Escajadillo, 1987)。組織嚢胞内のブラディゾイトが休眠中の実体であるという概念は、内生二分裂及び内生多分裂の両方を使用し、非同期的に複製することにより、ブラディゾイトがインビボで、組織嚢胞内で周期的な偶発性の成長を呈示することを示す説得力のある証拠により最近異議が唱えられた(Dzierszinski et al., 2004)。
タキゾイトからブラディゾイトへの発生上の移行は双方向性であり、寄生虫の遺伝子発現の劇的な変化により典型的に表され、代謝における主要な変化、段階特異的な表面抗原の制限された発現を伴う寄生虫表面のリモデリング、及び嚢胞壁の形成をもたらす。後者は、厳しい胃腸環境条件からブラディゾイトを保護し、宿主の免疫防御に対する物理的障壁を提供する可能性が高いと考えられる。Tゴンディ分化は、段階移行が複雑で依然として未知である発生遺伝学的プログラムにより方向付けられ、さらに、また、宿主細胞の生理学により影響されるという点で試験するのが困難であった(Lueder and Rahman, 2017)。実験室においては、タキゾイトからブラディゾイトの変換は、インビトロでの宿主免疫の非存在において、外因性ストレス(例、アルカリストレス、栄養欠乏、及び薬物)により誘発されうる。
転写調節は、段階特異的な遺伝子発現を示す多くの試験により証明されているように、ブラディゾイト発生において明らかに重要な役割を果たす。これらの変化が分子レベルでどのように調節されているかは、大部分が未知のままであるが、しかし、本発明者ら及び他は、エピジェネティックな変化が寄生虫分化の原動力であるという強力な証拠をもたらした。初期のエビデンスが、インビボでの感染の間にマウスから迅速に回収されたタキゾイトが特に分化する傾向があり、経時的にこの「感作」状態を徐々に失うという観察から由来した。そのようなものとして、組織培養におけるタキゾイトの長期継代によって、インビボで高い嚢胞負荷を発生させるII型株の能力が劇的に減弱される。このように、発生上の可塑性を促すこと、即ち、同じゲノムからの多様な表現型の顕在化によるエピジェネティックな機構によって、寄生虫は数千の潜在的な中間宿主に適応し、著しく異なる免疫系に応答することが可能になりうる。
Tゴンディは、それらが感染する細胞により用いられる戦略に対抗し、環境合図に対する応答において、又は発生プログラムの一部として、段階的分化を受ける顕著な能力を伴うゾイトを提供するエピジェネティックな変化、例えばヒストンマークにおける活性変化及びクロマチンリモデリングなどを促進するための洗練された方法を進化させてきた。本発明者らは、ヒストンの翻訳後修飾(PTM)、具体的にはアセチル化(Saksouk et al., 2005)に早期に興味を持ったが、それらによって、段階特異的な遺伝子の近傍におけるヒストンH4のアセチル化の速度における変化が、寄生虫の分化を駆動するエピジェネティックな分子モーターの1つであることを本発明者らが示すように導いた(Bougdour et al., 2009)。コアヒストンのアセチル化は、ヒストンアセチルトランスフェラーゼ(HAT)により媒介され、多くの例において、クロマチン構造の弛緩及び関連遺伝子の転写活性化をもたらす。ヒストンデアセチラーゼ(HDAC)は、ヒストンテールにおけるリジン残基からのアセチル部分の除去を触媒することによりHAT活性を相殺し、それによりクロマチン凝縮及び転写抑制を誘導する(Kurdistani and Grunstein, 2003)。
分化の制御のためのヒストンアセチル化の重要性が、低用量の化合物FR235222を用いたTgHDAC3の化学的阻害によって、インビトロでタキゾイトからブラディゾイトへの段階的変換が誘導されるという知見により強調されている(Bougdour et al., 2009;Maubon et al., 2010)。この化合物に耐性であるTgHDAC3対立遺伝子を用いてトランスフェクトされた組換え株はこれらの効果を示さず、化合物のTgHDAC3特異性が確認され、TgHDAC3の活性がブラディゾイト分化を活発に防止することを示唆している(Bougdour et al., 2009)。このインビトロの変換は、>350の遺伝子の上流領域の高アセチル化を伴い、その3分の1がブラディゾイトに特異的である(Bougdour et al., 2009)。TgHDAC3はHATTgGCN5bの作用に主に対抗しているように思われ、それは、ChIPにより、活性遺伝子のプロモーターに局在するのに対し、TgHDAC3は、ChIPにより、ブラディゾイト遺伝子のプロモーターに局在する(Saksouk et al., 2005)。それらのデータは、Tゴンディにおけるヒストンアセチル化と遺伝子発現の間の因果関係の理解に向けた一歩を表し、段階的変換におけるTgHDAC3の決定的な役割を指摘しているのに対し、それらは、実験用マウスにおいて組織嚢胞又は潜伏的な感染症を容易に発生しない病原性RH株だけで実施された。最終的に、潜伏形態のトキソプラズマ症についての新たな診断法を開発する必要性がある。
この試験において、本発明者らは、インビボで嚢胞形成を起こす傾向のあるII型起源の株を使用し、インビトロでタキゾイトからブラディゾイトへの変換を刺激するFR235222の能力を再検討した。FR235222に対するTゴンディプロテオーム応答の定量分析によって、段階特異的タンパク質(ブラディゾイトに制限されていると認識されているものを含む)として以前に同定されている多くのタンパク質が明らかになった。寄生虫の生物学に対するそれらの可能性のある重要性(Hakimi et al., 2017)に起因して、本発明者らは、分泌されると予測される新規タンパク質に対して本発明者らの注目の焦点を合わせることを選んだ。~200の推定FR235222応答性のブラディゾイト分泌エフェクターがこのアプローチにより同定された。1つの候補、BCLA(脳嚢胞負荷関連抗原)がさらなる研究のために選ばれた。BCLAは、FR235222処理時にだけ発現され、液胞空間中でのその分泌に続いて、このタンパク質が寄生胞膜(PVM)に蓄積することが示された。インビボ条件下では、BCLAは嚢胞のマトリックス空間中に、ならびに嚢胞壁にあり、後者は潜伏段階でのPVMに起源を持つと考えられている。その機能を評価する一方で、本発明者らは、BCLA欠損が慢性感染マウスから単離された脳嚢胞の完全性に影響を及ぼしていることを明らかにしているが、このタンパク質が、少なくとも本発明者らの慢性トキソプラズマ症のマウスモデルにおいて、適切な嚢胞機能に不可欠である。
ブラディゾイトによるBCLAの制限された発現及び嚢胞壁でのその位置を仮定し、本発明者らは次に、血清診断におけるその潜在的な適用を研究しようとした。ここで、本発明者らは、組換え技術により産生されたBCLAのC末端ペプチドが強く抗原性であり、慢性的に感染されたマウスにおいて抗TゴンディIgGの検出のための優れた抗原候補を構成することを見出した。本発明者らは、慢性的に感染されたマウスの脳における嚢胞の存在と、抗原BCLAの血清中での検出の間での明らかな相関を示す強いデータを提供する。ヒト血清を用いた陽性アッセイによって、BCLAの抗原性の特徴が検証され、慢性的に感染された宿主における嚢胞負荷の血清学的検出の興味深い展望を伴う、抗トキソプラズマ診断のためのこの抗原の使用に道が開かれる。
発明の概要:
本発明は、単離されたトキソプラズマ・ゴンディポリペプチドを提供し、以後、BCLA(脳嚢胞負荷関連抗原)と呼び、それはアミノ酸配列番号1及び免疫原性ペプチドフラグメントを含む。
本発明はさらに、本発明の単離ポリペプチドに対して生成された抗体に関する。
本発明はさらに、本発明に従ったトキソプラズマ・ゴンディポリペプチドを検出するための方法、及び/又は生物学的サンプル中、特に固体サンプル中のその量を評価するための方法に関する。
本発明はさらに、生物学的サンプル中、特に体液サンプル中の抗BCLA抗体を検出するために、本発明に従ったポリペプチドを使用した、潜伏形態のトキソプラズマ症の診断方法に関する。
発明の詳細な説明:
エピドラッグを使用してタキゾイトゲノム発現を調節することにより、本発明者らは、発現がブラディゾイトに制限されている遺伝子を同定することができた。本発明において、本発明者らは、ブラディゾイト誘導条件下で発現された場合にインビトロで寄生体胞膜に蓄積するタンパク質BCLA(脳嚢胞負荷関連抗原)の特徴付けを報告する。マウスの脳において、このタンパク質は嚢胞内及び表面に散在している。この遺伝子の欠失は、マウスにおいて低下した脳嚢胞負荷をもたらし、残りの嚢胞は、円形の喪失から特有の出芽表現型にわたるそれらの壁表面の変形により典型的である。最後に、組換えタンパク質として合成された場合、BCLAは、マウス脳における嚢胞の存在と明らかに及び独占的に相関する高感度を伴う潜伏感染の効率的な血清マーカーを構成する。本発明者らにより開発された最初のELISA BCLAテストを用いて、BCLA抗原に対して向けられた抗体が、血清中だけ、又は血清及び房水の両方において、強い疑い又は証明された眼トキソプラズマ症を伴うヒト患者において検出された。血清アッセイは長い間、Tゴンディ感染を確認するための第一選択テストであったが、現在の血清診断によって、急性、潜伏性、及び再燃の疾患状態が常に区別されるわけではない。さらに、現在の血清学によって、組織中での嚢胞負荷と、血清陽性の免疫不全患者におけるトキソプラズマ症の再燃のその後のリスクは評価されない。これらの制限の一部は、現在では、BCLA(慢性的に感染された宿主における嚢胞の血清学的検出のための重大な抗原候補)の発見で克服することができた。
最初のELISAテストを、BCLA免疫原性ペプチドの検出のために最適化した。最初に、BCLA C末端ドメイン、及び最も保存された内部ペプチド反復配列TgR4(図12a)の両方を使用して設計されたペプチドマイクロアレイを、ペプチドドットブロットスクリーニングを使用し、高解像度BCLAエピトープマッピング(図12b及び図12c)のためにスクリーニングした。マウスとは対照的に、全ての陽性ヒト血清は、一度、rBCLAに加えられると、テスト感度を有意に増加させる内部リピートから由来するペプチドに対して頑強な反応性を示した。従って、BCLA ELISAは、最も高感度のペプチド及びポリペプチドの組み合わせに基づいてカスタマイズされ、眼のトキソプラズマ症又は確認された過去の免疫のいずれかと診断されたヒト間での高い信頼性の識別のために最適であることが証明された(図13)。ELISAテストによって、また、≪無症候性≫又は症候性のいずれかの慢性トキソプラズマ症エピソードを受けている免疫不全患者からの血清中で有意な量の循環抗BCLA抗体が検出された(図13)。
単離ペプチド。
本発明は、アミノ酸配列番号1を含む、BCLA(脳嚢胞負荷関連抗原)と呼ばれる、単離されたトキソプラズマ・ゴンディポリペプチドに関する。
本発明はまた、以下からなる群より選択される、単離されたトキソプラズマ・ゴンディポリペプチドを提供する:
(i)トキソプラズマ・ゴンディポリペプチドBCLAからなるアミノ酸配列(配列番号1);
(ii)C末端抗原ドメイン(rBCLAと呼ばれるBCLAのres 1089-1275)からなるアミノ酸配列(配列番号2);
(iii)以下からなる群より選択されるBCLAの内部反復ドメインからなるアミノ酸配列:TgR1(配列番号4)、TgR2(配列番号5)、TgR3(配列番号6)、TgR4(配列番号7)、TgR5(配列番号8)、TgR6(配列番号9)、TgR7(配列番号10)、TgR8(配列番号11)、TgR9(配列番号12)、tgR10(配列番号13)、TgR11(配列番号14)、TgR12 (配列番号15)、及びTgR13(配列番号16);
(iv)(i)から(iii)の配列と実質的に相同なアミノ酸配列、好ましくは(i)から(iii)の配列と少なくとも80%同一のアミノ酸配列;
(v)(i)から(iv)の配列の少なくとも9つの連続アミノ酸のフラグメント。
ペプチドドットブロットスクリーニング(図12を参照)を使用することによって、BCLAのC末端抗原ドメイン(rBCLAと呼ばれるBCLAのres 1089-1275)中の、ならびにTgR1からTgR13(配列番号4から配列番号16)と呼ばれるBCLAのBCLAの内部反復ドメイン(res 304-924)中の最も強力なBCLA免疫原性ペプチドを特定することが可能になる。
したがって、特定の実施形態において、rBCLAポリペプチドからの単離されたトキソプラズマ・ゴンディポリペプチドは、以下からなる群より選択される:
(i)GELQPAEAEEARLLVADLKAV(配列番号32)
(ii)VRVEGEAFFRASVDLYEA(配列番号33)
(iii)KLRPLTKGELVDVVRQ(配列番号34)
(iv)TQIFVQDRASAFLRV(rBCLAのペプチド36)(配列番号35)
(v)AAEQMKAVFAMVEEG(rBCLAのペプチド44)(配列番号36)
(vi)(i)から(v)の配列と実質的に相同なアミノ酸配列、好ましくは(i)から(v)の配列と少なくとも95%同一のアミノ酸配列
(vii)(i)から(vi)の配列の少なくとも9つの連続アミノ酸のフラグメント。
より特定の実施形態において、rBCLAポリペプチドからの単離されたトキソプラズマ・ゴンディポリペプチドは、以下からなる群より選択される:
(i)GELQPAEAEEARLLV(rBCLAのペプチド12)(配列番号37);
(ii)QPAEAEEARLLVADL(rBCLAのペプチド13)(配列番号38)、
(iii)EAEEARLLVADLKAV(rBCLAのペプチド14)(配列番号39)、
(iv)VRVEGEAFFRASVDL(rBCLAのペプチド21)(配列番号40)、
(v)EGEAFFRASVDLYEA(rBCLAのペプチド22)(配列番号41);
(vi)AFFRASVDLYEAVKN(rBCLAのペプチド23)(配列番号42)、
(vii)KLRPLTKGELVDVVR(rBCLAのペプチド30)(配列番号43)
(viii)(i)から(vii)の配列と実質的に相同なアミノ酸配列、好ましくは(i)から(vii)の配列と少なくとも95%同一のアミノ酸配列
(vii)(i)から(viii)の配列の少なくとも9つの連続アミノ酸のフラグメント。
したがって、特定の実施形態において、BCLAの内部反復ドメインからの単離されたトキソプラズマ・ゴンディポリペプチドは、以下からなる群より選択される。
(i)TgR4の内部反復ドメインからなるアミノ酸配列、MERPAAGSMEKEKPVLPGEGEGHVLPKHETKPALTDEKRTKPGGPRTE(配列番号7)
(ii)(i)の配列と実質的に相同なアミノ酸配列、好ましくは(i)の配列と少なくとも80%同一のアミノ酸配列
(iii)(i)から(ii)の配列の少なくとも9つの連続アミノ酸のフラグメント。
より特定の実施形態において、BCLAの内部反復ドメインからの単離されたトキソプラズマ・ゴンディポリペプチドは、以下からなる群より選択される:
(i)AAGSMEKEKPVLPGEGEGH(TgR4のドメインA);(配列番号44)
(ii)VLPKHETKPALTDEKRTKPGGP(TgR4のドメインB)、(配列番号45)
(iii)(i)から(ii)の配列と実質的に相同なアミノ酸配列、好ましくは(i)から(ii)の配列と少なくとも95%同一のアミノ酸配列
(iv)(i)から(iii)の配列の少なくとも9つの連続アミノ酸のフラグメント。
より特定の実施形態において、BCLAの内部反復ドメインからの単離されたトキソプラズマ・ゴンディポリペプチドは、以下からなる群より選択される:
(i)AAGSMEKEKPVLPGE(TgR4のペプチド3);(配列番号46)
(ii)GSMEKEKPVLPGEGE(TgR4のペプチド4)(配列番号47)
(iii)MEKEKPVLPGEGEGH(TgR4のペプチド5)(配列番号48)
(iv)KEKPVLPGEGEGHVL(TgR4のペプチド6)(配列番号49)
(v)KPVLPGEGEGHVLPG(TgR4のペプチド7)(配列番号50)
(vi)HVLPKHETKPALTDEK(TgR4のペプチド13)、(配列番号51)
(vii)PKHETKPALTDEKRT(TgR4のペプチド14)、(配列番号52)
(viii)HETKPALTDEKRTKP(TgR4のペプチド15)(配列番号53)
(ix)TKPALTDEKRTKPGG(TgR4のペプチド16)(配列番号54)
(x)(i)から(ix)の配列と実質的に相同なアミノ酸配列、好ましくは(i)から(ix)の配列と少なくとも95%同一のアミノ酸配列
(xi)(i)から(x)の配列の少なくとも9つの連続アミノ酸のフラグメント。
BCLAポリペプチドは、異なるドメイン(特に、rBCLA中、ならびにBCLA TgR1からTgR13の内部反復ドメイン中)にわたり多数のエピトープを有するため、本発明のBCLA免疫原性ペプチドフラグメントを組み合わせることが有利でありうる。
したがって、別の実施形態において、本発明の単離ポリペプチドは、本発明に従った2つのペプチドフラグメント間の融合物である。
改善されたELISAアッセイに関して、以下のBCLAペプチド(2つの内部反復ペプチドを組み合わせた、少なくとも融合ペプチドを伴う)を、全長組換えBCLAポリペプチド(配列番号1)との組み合わせにおいて使用した。
ペプチドAB_F:MERPAAGSMEKEKPVLPGEGEGLPKHETKPALTDEKRTKPGGP(Tgr4/Trg12/Tgr13中に存在するリピートモチーフ及びTgr3/Trg4/Tgr5/Tgr6/Tgr9中に存在するリピートモチーフからのペプチドフラグメントの融合物)(配列番号55)
ペプチドA3_B:AAGSMEKDKLVLPGE(Tgr3/Tgr5/Tgr6/Tgr7/Trg10/Tgr11中に存在するリピートモチーフからのペプチドフラグメント)(配列番号56)
したがって、BCLAの内部反復ドメインからの単離されたトキソプラズマ・ゴンディポリペプチドは、以下からなる群より選択される:
(i)MERPAAGSMEKEKPVLPGEGEGLPKHETKPALTDEKRTKPGGP(Tgr4/Trg12/Tgr13中に存在するリピートモチーフ及びTgr3/Trg4/Tgr5/Tgr6/Tgr9中に存在するリピートモチーフからのペプチドフラグメントの融合物)(配列番号55)、
(ii)AAGSMEKDKLVLPGE(Tgr3/Tgr5/Tgr6/Tgr7/Trg10/Tgr11中に存在するリピートモチーフからのペプチドフラグメント)(配列番号56)
(iii)(i)から(ii)の配列と実質的に相同なアミノ酸配列、好ましくは(i)から(ii)の配列と少なくとも95%同一のアミノ酸配列
(iv)(i)から(iii)の配列の少なくとも9つの連続アミノ酸のフラグメント。
BCLAポリペプチドは、BCLAの異なる内部反復ドメイン(TgR1からTgR13)にわたり多数のエピトープを有するため、BCLAの内部反復ドメインのアミノ酸残基を組み合わせることが有利でありうる。
したがって、本発明はまた、以下の配列を有するBCLAの内部反復ドメイン(TgRx)を含む、BCLAポリペプチドに関する:
M-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-Xaa7-M-E-Xaa8-Xaa9-K-Xaa10-V-Xaa11-P-G-E-G-Xaa12-Xaa13-H-Xaa14-Xaa15-P-K-Xaa16-E-Xaa17- Xaa18-L-T-Xaa19-Xaa20-Xaa21-Xaa22-T-Xaa23-P-Xaa24-Xaa25-P-Xaa26-Xaa27-Xaa28(配列番号64)
ここで、Xaa1は)グルタミン酸(E)である又はアミノ酸残基はない、
ここで、Xaa2はアルギニン(R)又はセリン(S)である、
ここで、Xaa3はプロリン(P)又はグリシン(G)である、
ここで、Xaa4はアラニン(A)又はグリシン(G)である、
ここで、Xaa5はアラニン(A)である又はアミノ酸残基はない、
ここで、Xaa6はグリシン(G)又はアルギニン(R)である、
ここで、Xaa7はセリン(S)、プロリン(P)、又はアラニン(A)である、
ここで、Xaa8はリジン(K)又はグルタミン酸(E)である、
ここで、Xaa9はリジン(K)、グルタミン酸(E)、又はアスパラギン酸(D)である、
ここで、Xaa10はプロリン(P)又はロイシン(L)である、
ここで、Xaa11はロイシン(L)又はセリン(S)である、
ここで、Xaa12はグルタミン酸(E)又はリジン(K)である、
ここで、Xaa13はグリシン(G)又はアルギニン(R)である、
ここで、Xaa14はバリン(V)又はアラニン(A)である、
ここで、Xaa15はロイシン(L)又はセリン(S)である、
ここで、Xaa16はヒスチジン(H)、アスパラギン酸(D)、又はアラニン(A)である、
ここで、Xaa17はスレオニン(T)、アルギニン(R)、メチオニン(M)、又はグルタミン(Q)である、
ここで、Xaa18はプロリン(P)、スレオニン(T)、又はアラニン(A)である、
ここで、Xaa19はアスパラギン酸(D)、グルタミン酸(E)、又はグルタミン(Q)である、
ここで、Xaa20はグルタミン酸(E)又はリジン(K)である、
ここで、Xaa21はリジン(K)、グリシン(G)、又はグルタミン酸(E)である、
ここで、Xaa22はアルギニン(R)又はバリン(V)である、
ここで、Xaa23はリジン(K)、グルタミン酸(E)、又はアスパラギン(N)である、
ここで、Xaa24はグリシン(G)、バリン、又はイソロイシン(I)である、
ここで、Xaa25はグリシン(G)又はグルタミン酸(E)である、
ここで、Xaa26はアルギニン(R)又はプロリン(P)である、
ここで、Xaa27はスレオニン(T)システイン(C)リジン(K)又はメチオニン(M)である、
ここで、Xaa28はグルタミン酸(E)又はアラニン(A)である、
及び配列番号64の配列の少なくとも9つの連続アミノ酸のフラグメント。
本明細書で使用するとき、用語「アミノ酸」は、キラルアミノ酸についてのそれらのD及びL立体異性体中の天然又は非天然アミノ酸を指す。例えば、ペプチジル構造中に存在するような、アミノ酸及び対応するアミノ酸残基の両方を指すことが理解される。天然及び非天然アミノ酸は当技術分野において周知である。一般の天然アミノ酸は、アラニン(Ala)、アルギニン(Arg)、アスパラギン(Asn)、アスパラギン酸(Asp)、システイン(Cys)、グルタミン(Gln)、グルタミン酸(Glu)、グリシン(Gly)、ヒスチジン(His)、イソロイシン(Ile)、ロイシン(Leu)、リジン(Lys)、メチオニン(Met)、フェニルアラニン(Phe)、プロリン(Pro)、セリン(Ser)、スレオニン(Thr)、トリプトファン(Trp)、チロシン(Tyr)、及びバリン(Val)を含むが、これらに限定されない。まれな非天然アミノ酸は、アリルグリシン(AllylGly)、ノルロイシン、ノルバリン、ビフェニルアラニン(Bip)、シトルリン(Cit)、4-グアニジノフェニルアラニン(Phe(Gu))、ホモアルギニン(hArg)、ホモリジン(hLys)、2-ナフチルアラニン(2-Nal)、オルニチン(Orn)、及びペンタフルオロフェニルアラニンを含むが、これらに限定されない。
アミノ酸は典型的には、側鎖に従って、1つ以上のカテゴリー(極性、疎水性、酸性、塩基性、芳香族を含む)に分類される。極性アミノ酸の例は、側鎖官能基、例えばヒドロキシル、スルフヒドリル、及びアミドなどを有するもの、ならびに酸性及び塩基性アミノ酸を含む。極性アミノ酸は、アスパラギン、システイン、グルタミン、ヒスチジン、セレノシステイン、セリン、スレオニン、トリプトファン、及びチロシンを含むが、これらに限定されない。疎水性又は非極性アミノ酸の例は、非極性脂肪族側鎖、例えば、限定しないが、ロイシン、イソロイシン、バリン、グリシン、アラニン、プロリン、メチオニン、及びフェニルアラニンなどを有する残基を含む。塩基性アミノ酸残基の例は、塩基性側鎖、例えばアミノ基又はグアニジノ基などを有するものを含む。塩基性アミノ酸残基は、アルギニン、ホモリジン、及びリジンを含むが、これらに限定されない。酸性アミノ酸残基の例は、酸性側鎖官能基、例えばカルボキシ基などを有するものを含む。酸性アミノ酸残基はアスパラギン酸及びグルタミン酸を含むが、これらに限定されない。芳香族アミノ酸は、芳香族側鎖基を有するものを含む。芳香族アミノ酸の例は、ビフェニルアラニン、ヒスチジン、2-ナフチルアラナニン、ペンタフルオロフェニルアラニン、フェニルアラニン、トリプトファン、及びチロシンを含むが、これらに限定されない。一部のアミノ酸は複数の群に分類されることに注意し、例えば、ヒスチジン、トリプトファン、及びチロシンは、極性アミノ酸及び芳香族アミノ酸の両方に分類される。アミノ酸はさらに、非荷電又は荷電(正又は負)アミノ酸として分類されうる。正荷電アミノ酸の例は、リシン、アルギニン、及びヒスチジンを含むが、これらに限定されない。負荷電アミノ酸の例は、グルタミン酸及びアスパラギン酸を含むが、これらに限定されない。上の群の各々に分類される追加のアミノ酸は、当業者に公知である。
参照ペプチドと「実質的に相同」なペプチドは、1つ以上の保存的置換により参照配列から由来しうる。2つのアミノ酸配列は、1つ以上のアミノ酸残基が生物学的に類似の残基により置換される場合、あるいはアミノ酸の80%超が同一である場合、又は約90%超、好ましくは約95%超が類似している(機能的に同一である)場合、「実質的に相同」、又は「実質的に類似」である。好ましくは、類似の、同一の、又は相同の配列は、例えば、GCG(Genetics Computer Group、Program Manual for the GCG Package、Version 7、ウィスコンシン州マディソン)パイルアッププログラム、又は当技術分野において公知のプログラム(BLAST、CLUSTAL、FASTAなど)を使用し、アラインメントにより同定する。同一性のパーセンテージは、Needleman-Wunschアラインメントアルゴリズムに基づいてペアワイズグローバルアラインメントを実施し、例えばNeedleを使用し、BLOSUM62マトリックスを使用し(ギャップオープニングペナルティ10及びギャップエクステンションペナルティ0.5を伴う)、それらの全長に沿った2つの配列の最適なアラインメント(ギャップを含む)を見出すことにより算出してもよい。
本明細書で使用される用語「保存的置換」は、ペプチドの全体的な立体構造及び機能を改変することなく、アミノ酸残基を別のアミノ酸残基により置換することを意味し、アミノ酸を、同様の特性(例えば、極性、水素結合ポテンシャル、酸性、塩基性、形状、疎水性、芳香族など)を有するアミノ酸で置換することを含むが、これらに限定されない。同様の特性を伴うアミノ酸は当技術分野において周知である。例えば、アルギニン、ヒスチジン、及びリジンは親水性-塩基性アミノ酸であり、互換的でありうる。同様に、イソロイシン(疎水性アミノ酸)は、ロイシン、メチオニン、又はバリンで置換してもよい。中性の親水性アミノ酸は、互いに置き換えることができ、アスパラギン、グルタミン、セリン、及びスレオニンを含む。
「置き換えられた」又は「修飾された」により、本発明は、天然アミノ酸から改変又は修飾されたアミノ酸を含む。
そのようなものとして、本発明の文脈において、保存的置換は、類似の特性を有する別のアミノ酸についての1つのアミノ酸の置換として当技術分野において認識されていることを理解すべきである。
本発明によれば、第2のアミノ酸配列と少なくとも80%の同一性を有する第1のアミノ酸配列は、第1の配列が、第2のアミノ酸配列と80;81;82;83;84;85;86;87;88;89;90;91;92;93;94;95;96;97;98;又は99%の同一性を有することを意味する。アミノ酸配列同一性は、好ましくは、適切な配列アラインメントアルゴリズム及びデフォルトパラメーター、例えばBLAST P(Karlin and Altschul, 1990)などを使用して決定される。
一部の実施形態において、本発明の単離ペプチドは、最大で1275アミノ酸(及び少なくとも9)を含む。一部の実施形態において、本発明のポリペプチドは、
又は9のアミノ酸を含む。一部の実施形態において、本発明のポリペプチドは50未満のアミノ酸を含む。一部の実施形態において、本発明のポリペプチドは30未満のアミノ酸を含む。一部の実施形態において、本発明のポリペプチドは25未満のアミノ酸を含む。一部の実施形態において、本発明のポリペプチドは20未満のアミノ酸を含む。一部の実施形態において、本発明のポリペプチドは15未満のアミノ酸を含む。
本発明による単離ポリペプチドは、当技術分野において公知の任意の方法を使用して産生することができる。それらは、例えば、宿主細胞(例、細菌、酵母、又は真核生物の宿主細胞)中で組換えポリペプチドとして産生されうる、又は化学的に合成されうる(総説については、Kent S.B.H. Chem. Soc. Rev., 2009,38, 338-351及びBradley L. et al Annu Rev Biophys Biomol Struct. 2005; 34: 91-118又はR. B. Merrifield (1969). “Solid-phase peptide synthesis.” Advances in enzymology and related areas of molecular biology 32: 221-96.;R. B. Merrifield (1969). “The synthesis of biologically active peptides and proteins.” JAMA 210(7): 1247-54.及びRaibaut, L., O. El Mahdi and O. Melnyk (2015). “Solid Phase Protein Chemical Synthesis.”Topics in current chemistryを参照)。
本発明の抗体
本発明者らは、本発明のポリペプチドに対して向けられた特異的抗体を生成した。
第1に、TゴンディにおけるBLCAのインサイツ動態をアッセイするために、本発明者らは、BCLAタンパク質の保存された反復の末端にそれぞれ位置付けられる2つの合成ペプチドに対するポリクローナル抗体を産生した(実施例1及び図2bを参照)。これらの反復中に含まれる2つのペプチド(ペプチド1及び2)に対する自家抗体が生成された。2つのBCLA由来ペプチドに対して産生された自家製抗体を使用したウエスタンブロットによるBCLA発現モニタリングは、FR235222処理後のBCLAの上方調節を示す(図2cを参照)。
第2に、単一ドメイン抗体(又はナノボディもしくはVHH)が、合成ペプチド、BCLAのC末端抗原ドメイン(res 1089-1275)(配列番号2)でマウスを免疫化することにより産生された。より正確には、本発明者らは、抗体が、本発明の単離ポリペプチドを特異的に認識し、トキソプラズマ・ゴンディに感染された細胞株サンプルならびにトキソプラズマ症患者(組織嚢胞の検出)からの及びトキソプラズマ症のマウスモデルからの脳サンプルを染色する能力についてスクリーニングされることを見出した。本発明の抗体のスクリーニング工程は、これらの抗体が、特にBCLAの抗原ドメインを伴う、本発明の単離ポリペプチドに特異的であることを示している。
本発明は、本発明の単離ポリペプチドに特異的に結合する抗体を提供する。
本発明によれば、「抗体」又は「免疫グロブリン」は同じ意味を有し、本発明において等しく使用されうる。本明細書で使用される用語「抗体」は、免疫グロブリン分子及び免疫グロブリン分子の免疫学的に活性な部分、即ち、抗原に免疫特異的に結合する抗原結合部位を含む分子を指す。そのようなものとして、用語「抗体」は、全抗体分子だけでなく、また、抗体フラグメント、ならびに抗体及び抗体フラグメントの変異体(誘導体を含む)を包含する。天然抗体において、2本の重鎖はジスルフィド結合により互いに連結されており、各々の重鎖はジスルフィド結合により軽鎖に連結されている。2つの型の軽鎖、ラムダ(l)及びカッパ(k)がある。抗体分子の機能的活性を決定する5つの主な重鎖クラス(又はアイソタイプ)がある:IgM、IgD、IgG、IgA、及びIgE。各々の鎖は、異なる配列ドメインを含む。軽鎖は、2つのドメイン、すなわち可変ドメイン(VL)及び定常ドメイン(CL)を含む。重鎖は、4つのドメイン、すなわち可変ドメイン(VH)及び3つの定常ドメイン(CH1、CH2、及びCH3、まとめてCHと呼ばれる)を含む。軽鎖(VL)及び重鎖(VH)の両方の可変領域が、抗原に対する結合認識及び特異性を決定する。軽鎖(CL)及び重鎖(CH)の定常領域ドメインは、重要な生物学的特性、例えば抗体鎖会合、分泌、経胎盤移動性、補体結合、及びFc受容体(FcR)への結合などを付与する。Fvフラグメントは、免疫グロブリンのFabフラグメントのN末端部分であり、1つの軽鎖及び1つの重鎖の可変部分からなる。抗体の特異性は、抗体結合部位と抗原決定基の間の構造的相補性に存在する。抗体結合部位は、主に超可変領域又は相補性決定領域(CDR)からの残基で構成されている。場合により、非超可変領域又はフレームワーク領域(FR)からの残基が、全体的なドメイン構造、ひいては結合部位に影響を及ぼす。相補性決定領域又はCDRは、天然の免疫グロブリン結合部位の天然Fv領域の結合親和性及び特異性を一緒に定義するアミノ酸配列を指す。免疫グロブリンの軽鎖及び重鎖は各々が、3つのCDRを有し、VL-CDR1、VL-CDR2、VL-CDR3及びVH-CDR1、VH-CDR2、VH-CDR3とそれぞれ命名されている。抗原結合部位は、従って、重鎖及び軽鎖のV領域の各々からのCDRセットを含む、6つのCDRを含む。フレームワーク領域(FR)は、CDRの間に挿入されたアミノ酸配列を指す。
本発明の単離ポリペプチドに結合する抗体は、当技術分野において公知の、従来の方法によりアッセイすることができる。本発明のポリペプチドの成熟形態は、好ましくは、本発明のポリペプチドのエピトープに結合する抗体をアッセイするために使用される。あるいは、ナノボディXXの結合を保持する本発明の単離ポリペプチドの任意のバリアント形態を使用することができる。多くの異なる競合結合アッセイフォーマットを、エピトープ結合を決定するために使用することができる。使用することができるイムノアッセイは、技術、例えばラジオイムノアッセイ、ELISA、「サンドイッチ」イムノアッセイ、免疫沈降アッセイ、蛍光イムノアッセイ、プロテインAイムノアッセイ、及び補体固定アッセイなどを使用した競合アッセイシステムを含むが、これらに限定されない。そのようなアッセイはルーチン的であり、当技術分野において周知である(例、Ausubel et al., eds, 1994 Current Protocols in Molecular Biology, Vol. 1, John Wiley & sons, Inc., New Yorkを参照)。例えば、BIACORE(登録商標)(GE Healthcare、ニュージャージー州ピスカタウェイ)は、モノクローナル抗体のビンパネルをエピトープ化するためにルーチン的に使用されている多様な表面プラズモン共鳴アッセイフォーマットの1つである。加えて、ルーチン的なクロスブロッキングアッセイ、例えばAntibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane, 1988において記載されているようなクロスブロッキングアッセイを実施することができる。適したELISAアッセイの例はまた、以下の実施例において記載されている。
本明細書で使用するとき、用語「親和性」は、単一の抗原部位での抗体と抗原の間の相互作用の強さを指す。各々の抗原部位内で、抗体「アーム」の可変領域は、弱い非共有結合力を通じて多数の部位で抗原と相互作用する;相互作用が多いほど、親和性は強くなる。親和性は、KDを測定することにより決定することができる。用語「KD」は、本明細書で使用するとき、解離定数を指すことを意図しており、それは、Kd対Kaの比率(即ち、Kd/Ka)から得られ、モル濃度(M)として表される。抗体についてのKD値は、当技術分野において十分に確立された方法を使用して決定することができる。抗体のKDを決定するための方法は、表面プラズモン共鳴を使用すること、又はバイオセンサーシステム、例えばBiacore(登録商標)システムなどを使用することによる。
本発明は、以下を含むか又はそれらからなる単離ポリペプチドに特異的に結合する抗体を提供する:
(i)トキソプラズマ・ゴンディポリペプチドBCLAからなるアミノ酸配列(配列番号1);
(ii)C末端抗原ドメイン(BCLAのres 1089-1275)からなるアミノ酸配列(配列番号2);
(iii)以下からなる群より選択される、BCLAの内部反復ドメインからなるアミノ酸配列:TgR1(配列番号4)、TgR2(配列番号5)、TgR3(配列番号6)、TgR4(配列番号7)、TgR5(配列番号8)、TgR6(配列番号9)、TgR7(配列番号10)、TgR8(配列番号11)、TgR9(配列番号12)、tgR10(配列番号13)、TgR11(配列番号14)、TgR12(配列番号15)、及びTgR13(配列番号16);
(iv)(i)から(iii)の配列と実質的に相同なアミノ酸配列、好ましくは(i)から(iii)の配列と少なくとも80%同一のアミノ酸配列
(v)(i)から(iv)の配列の少なくとも9つの連続アミノ酸のフラグメント。
これらの抗体は、単離ポリペプチド(i)から(v)のいずれか1つの少なくとも9つの連続アミノ酸のフラグメント内に位置付けられる、又はその内に位置付けられる少なくとも1つのアミノ酸を含むエピトープを認識することができる。
好ましくは、前記エピトープは、単離ポリペプチド(i)から(v)のいずれか1つを含む、又はそれからなるフラグメント内に位置付けられる。
最も好ましくは、前記エピトープは、BCLAのC末端抗原ドメイン(配列番号2)内、及びTgR1からTgR13(配列番号4から配列番号16)と呼ばれる、BCLAのBCLA(res 304-924)の内部反復ドメイン内に位置付けられる。そのような抗体は、それらが本発明のトキソプラズマ・ゴンディBCLAポリペプチドに特異的に結合することにおいて特徴付けられる。
特定の実施形態において、rBCLAポリペプチドに特異的に結合する抗体は、以下からなる群より選択されるアミノ酸配列に特異的に結合する:
(i)GELQPAEAEEARLLVADLKAV(rBCLAのドメインA)(配列番号32)
(ii)VRVEGEAFFRASVDLYEA(rBCLAのドメインB)(配列番号33)
(iii)KLRPLTKGELVDVVRQ(rBCLAのドメインC)(配列番号34)
(iv)TQIFVQDRASAFLRV(rBCLAのペプチド36及びrBCLAのドメインD))(配列番号35)
(v)AAEQMKAVFAMVEEG(rBCLAのペプチド44及びrBCLAのドメインE))(配列番号36)
(vi)(i)から(v)の配列と実質的に相同なアミノ酸配列、好ましくは(i)から(v)の配列と少なくとも95%同一のアミノ酸配列
(vii)(i)から(vi)の配列の少なくとも9つの連続アミノ酸のフラグメント。より特定の実施形態において、rBCLAポリペプチドに特異的に結合する抗体は、以下からなる群より選択されるアミノ酸配列に特異的に結合する:
(i)GELQPAEAEEARLLV(rBCLAのペプチド12)(配列番号37);
(ii)QPAEAEEARLLVADL(rBCLAのペプチド13)(配列番号38)、
(iii)EAEEARLLVADLKAV(rBCLAのペプチド14)(配列番号39)、
(iv)VRVEGEAFFRASVDL(rBCLAのペプチド21)(配列番号40)、
(v)EGEAFFRASVDLYEA(rBCLAのペプチド22)(配列番号41);
(vi)AFFRASVDLYEAVKN(rBCLAのペプチド23)(配列番号42)、
(vii)KLRPLTKGELVDVVR(rBCLAのペプチド30)(配列番号43)
(viii)(i)から(vii)の配列と実質的に相同なアミノ酸配列、好ましくは(i)から(vii)の配列と少なくとも95%同一のアミノ酸配列
(vii)(i)から(viii)の配列の少なくとも9つの連続アミノ酸のフラグメント。
本発明はさらに、TgR1からTgR13(配列番号4から配列番号16)と呼ばれる、BCLAのBCLAの内部反復ドメイン(res304-924)からなるアミノ酸配列に特異的に結合する抗体を提供する。
したがって、特定の実施形態において、BCLAの内部反復ドメインに特異的に結合する抗体は、以下からなる群より選択されるアミノ酸配列に結合する:
(i)TgR4の内部反復ドメインからなるアミノ酸配列、MERPAAGSMEKEKPVLPGEGEGHVLPKHETKPALTDEKRTKPGGPRTE(配列番号7)
(ii)(i)の配列と実質的に相同なアミノ酸配列、好ましくは(i)の配列と少なくとも80%同一のアミノ酸配列
(iii)(i)から(ii)の配列の少なくとも9つの連続アミノ酸のフラグメント。
より特定の実施形態において、BCLA TgR4の内部反復ドメインに特異的に結合する抗体は、以下からなる群より選択されるアミノ酸配列に結合する:
(i)AAGSMEKEKPVLPGEGEGH(TgR4のドメインA);(配列番号44)
(ii)VLPKHETKPALTDEKRTKPGGP(TgR4のドメインB)、(配列番号45)
より特定の実施形態において、BCLA TgR4の内部反復ドメインに特異的に結合する抗体は、以下からなる群より選択されるアミノ酸配列に結合する:
(i)AAGSMEKEKPVLPGE(TgR4のペプチド3);(配列番号46)
(ii)GSMEKEKPVLPGEGE(TgR4のペプチド4)(配列番号47)
(iii)MEKEKPVLPGEGEGH(TgR4のペプチド5)(配列番号48)
(iv)KEKPVLPGEGEGHVL(TgR4のペプチド6)(配列番号49)
(v)KPVLPGEGEGHVLPG(TgR4のペプチド7)(配列番号50)
(vi)HVLPKHETKPALTDEK(TgR4のペプチド13)、(配列番号51)
(vii)PKHETKPALTDEKRT(TgR4のペプチド14)、(配列番号52)
(viii)HETKPALTDEKRTKP(TgR4のペプチド15)(配列番号53)
(i)TKPALTDEKRTKPGG(TgR4のペプチド16)(配列番号54)
特定の実施形態において、抗体は、以下の配列を有するBCLA(TgRx)の内部反復ドメインに特異的に結合する:
M-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-Xaa7-M-E-Xaa8-Xaa9-K-Xaa10-V-Xaa11-P-G-E-G-Xaa12-Xaa13-H-Xaa14-Xaa15-P-K-Xaa16-E-Xaa17- Xaa18-L-T-Xaa19-Xaa20-Xaa21-Xaa22-T-Xaa23-P-Xaa24-Xaa25-P-Xaa26-Xaa27-Xaa28(配列番号64)
ここで、Xaa1は)グルタミン酸(E)である又はアミノ酸残基はない、
ここで、Xaa2はアルギニン(R)又はセリン(S)である、
ここで、Xaa3はプロリン(P)又はグリシン(G)である、
ここで、Xaa4はアラニン(A)又はグリシン(G)である、
ここで、Xaa5はアラニン(A)である又はアミノ酸残基はない、
ここで、Xaa6はグリシン(G)又はアルギニン(R)である、
ここで、Xaa7はセリン(S)、プロリン(P)、又はアラニン(A)である、
ここで、Xaa8はリジン(K)又はグルタミン酸(E)である、
ここで、Xaa9はリジン(K)、グルタミン酸(E)、又はアスパラギン酸(D)である、
ここで、Xaa10はプロリン(P)又はロイシン(L)である、
ここで、Xaa11はロイシン(L)又はセリン(S)である、
ここで、Xaa12はグルタミン酸(E)又はリジン(K)である、
ここで、Xaa13はグリシン(G)又はアルギニン(R)である、
ここで、Xaa14はバリン(V)又はアラニン(A)である、
ここで、Xaa15はロイシン(L)又はセリン(S)である、
ここで、Xaa16はヒスチジン(H)、アスパラギン酸(D)、又はアラニン(A)である、
ここで、Xaa17はスレオニン(T)、アルギニン(R)、メチオニン(M)、又はグルタミン(Q)である、
ここで、Xaa18はプロリン(P)、スレオニン(T)、又はアラニン(A)である、
ここで、Xaa19はアスパラギン酸(D)、グルタミン酸(E)、又はグルタミン(Q)である、
ここで、Xaa20はグルタミン酸(E)又はリジン(K)である、
ここで、Xaa21はリジン(K)、グリシン(G)、又はグルタミン酸(E)である、
ここで、Xaa22はアルギニン(R)又はバリン(V)である、
ここで、Xaa23はリジン(K)、グルタミン酸(E)、又はアスパラギン(N)である、
ここで、Xaa24はグリシン(G)、バリン、又はイソロイシン(I)である、
ここで、Xaa25はグリシン(G)又はグルタミン酸(E)である、
ここで、Xaa26はアルギニン(R)又はプロリン(P)である、
ここで、Xaa27はスレオニン(T)システイン(C)リジン(K)又はメチオニン(M)である、
ここで、Xaa28はグルタミン酸(E)又はアラニン(A)である、
及び配列番号64の配列の少なくとも9つの連続アミノ酸のフラグメント。
本発明はさらに、TgR1からTgR13(配列番号4から配列番号16)と呼ばれるBCLAの内部反復ドメイン内のペプチド1及びペプチド2(配列番号17から27)のいずれかからなるアミノ酸配列に特異的に結合する抗体を提供する。
特定の実施形態において、本試験において使用されるペプチド1及び2は、
ペプチド1:EMERPAAGSMEK(配列番号21)
ペプチド2:VLPKHETKPALT(配列番号22)である。
これらの抗体は、ポリクローナル又はモノクローナルであることができる。抗体がモノクローナルである場合、それらは、例えば、キメラ、ヒト化又は完全ヒト抗体、抗体フラグメント、及び単一ドメイン抗体に対応しうる。
用語「キメラ抗体」は、抗体のVHドメイン及びVLドメイン、ならびにヒト抗体のCHドメイン及びCLドメインを含む抗体を指す。
本発明によれば、用語「ヒト化抗体」は、ヒト抗体からの可変領域フレームワーク及び定常領域を有する抗体を指すが、しかし、以前の非ヒト抗体のCDRを保持する。
用語「抗体フラグメント」は、前記抗体のCDRを含む可変ドメインを含む抗体のフラグメントを指す。基本的な抗体フラグメントは、Fab、Fab’、F(ab’)2、Fv、scFv、dsFvを含む。抗体フラグメントの例については、総説、Holliger et al Nature Biotechnology 23, issue 9 1126 - 1136 (2005)も参照のこと。これは参照により本明細書に含まれる。
用語「Fab」は、約50,000の分子量及び抗原結合活性を有する抗体フラグメントを意味し、それにおいて、IgGをプロテアーゼであるパパインで処理して得られたフラグメントのうち、H鎖のN末端側の約半分及びL鎖全体がジスルフィド結合を通じて一緒に結合されている。
用語「F(ab’)2」は、約100,000の分子量及び抗原結合活性を有する抗体フラグメントを指し、それは、IgGをプロテアーゼであるペプシンで処理して得られたフラグメントのうち、ヒンジ領域のジスルフィド結合を介して結合されたFabよりもわずかに大きい。
用語「Fab」は、約50,000の分子量及び抗原結合活性を有する抗体フラグメントを指し、それは、F(ab’)2のヒンジ領域のジスルフィド結合を切断することにより得られる。
単鎖Fv(「scFv」)ポリペプチドは、共有結合的に連結されたVH::VLヘテロダイマーであり、それは通常、ペプチドをコードするリンカーにより連結されたVH及びVLをコードする遺伝子を含む遺伝子融合物から発現される。「dsFv」は、ジスルフィド結合により安定化されたVH::VLヘテロダイマーである。二価及び多価抗体フラグメントは、一価scFvの会合により自発的に形成することができる、又はペプチドリンカー、例えば二価sc(Fv)2などにより一価scFvを結合させることにより生成することができる。
用語「ダイアボディ」「トリボディ」、又は「テトラボディ」は、多価抗原結合部位(2、3、又は4)を伴う小さな抗体フラグメントを指し、そのフラグメントは、同じポリペプチド鎖中で軽鎖可変ドメイン(VL)に接続された重鎖可変ドメイン(VH)を含む(VH-VL)。同じ鎖上の2つのドメイン間の対合を可能にするにはあまりにも短過ぎるリンカーを使用することにより、ドメインが、別の鎖の相補的ドメインと対合し、2つの抗原結合部位を作ることが強制される。
本明細書で使用するとき、用語「単一ドメイン抗体」は、当技術分野におけるその一般的な意味を有し、天然で軽鎖を欠いているラクダ哺乳動物において見出すことができる型の抗体の単一重鎖可変ドメインを指す。そのような単一ドメイン抗体はまた、VHH又は「ナノボディ(登録商標)」と呼ばれる。(単一)ドメイン抗体の一般的な説明については、上で引用される先行技術、ならびにEP 0 368 684、Wardら(Nature 1989 Oct 12; 341 (6242): 544-6)、Holt et al., Trends Biotechnol., 2003, 21(11):484-490;及びWO 06/030220、WO 06/003388も参照のこと。ナノボディは、ヒトIgG分子の分子量の約10分の1の分子量を有し、タンパク質は、わずか数ナノメートルの物理的直径を有する。この小さなサイズの1つの結果は、より大きな抗体タンパク質には機能的に不可視である抗原部位に結合するためのラクダ科のナノボディの能力であり、即ち、ラクダ科のナノボディは、古典的な免疫学的技術を使用した、その他の点では潜在性である抗原を検出する試薬として、及び可能な治療用薬剤として有用である。このように、小さなサイズのさらに別の結果は、ナノボディが、標的タンパク質の溝又は狭い間隙内の特定部位に結合する結果として阻害することができ、それ故に、古典的な抗体の機能よりも、古典的な低分子量薬物の機能により近く似る能力において役立つことができることである。低分子量及びコンパクトなサイズによって、さらに、極度に熱安定的であり、極度のpHに対して及びタンパク質分解消化に対して安定であり、不十分な抗原性であるナノボディがもたらされる。別の結果は、ナノボディが循環器系から組織中に容易に移動し、さらには血液脳関門を通過し、神経組織に影響を及ぼす障害を処置することができることである。ナノボディは、血液脳関門を横切って薬物輸送をさらに促進することができる。2004年8月19日に公開された米国特許出願20040161738を参照のこと。これらの特色は、ヒトに対する低い抗原性と組み合わされて、大きな治療の可能性を示す。単一ドメイン抗体のアミノ酸配列及び構造は、4つのフレームワーク領域又は「FR」で構成されると考えることができ、それらは、当技術分野において、及び本明細書で「フレームワーク領域1」又は「FR1」と;「フレームワーク領域2」又は「FR2」と;「フレームワーク領域3」又は「FR3」と;及び「フレームワーク領域4」又は「FR4」とそれぞれ呼ぶ;それらのフレームワーク領域は3つの相補性決定領域又は「CDR」により中断され、それらは当技術分野において、「CDR1」についての相補性決定領域」と;「相補性決定領域2」又は「CDR2」と、及び「相補性決定領域3」又は「CDR3」とそれぞれ呼ぶ。したがって、単一ドメイン抗体は、以下の一般的な構造を伴うアミノ酸配列として定義することができる:FR1-CDR1-FR2 -CDR2-FR3-CDR3-FR4、それにおいて、FR1からFR4はフレームワーク領域1から4をそれぞれ指し、及び、それにおいて、CDR1からCDR3は相補性決定領域1から3をそれぞれ指す。本発明の文脈において、単一ドメイン抗体のアミノ酸残基は、International ImMunoGeneTics情報システムのアミノ酸ナンバリング(http://imgt.cines.fr/)により与えられるVHドメインについての一般的なナンバリングに従って番号付けされる。
いくつかのVHH(単一ドメイン抗体)がラマの免疫化後に生成され、良好な免疫応答がもたらされた。生成されたライブラリーは、良好なサイズ及び挿入頻度であった。His rBCLA(配列番号3)でのファージディスプレイ選択によって、多数の良好なクローンがもたらされているが、そのうちの3つ(ERB-1G6、ERB-1B11、及びERB-1A12)が、非常に良好な見掛け上の親和性を示し、そのうちのERB-1G6がまた、大腸菌において高い産生レベルを示す。
ERB-1F1、ERB-1F2、ERB 1H4、ERB-1D7、ERB-1G6、ERB-1B11、及びERB-1A12VHHの配列を、単一ドメイン抗体の可変重鎖(VH)についての表1において以下に記載する。
そのような抗体を得るための方法は、当技術分野において周知である。例えば、本発明によるモノクローナル抗体は、(i)から(vi)のいずれか1つを含む又はそれからなる前記フラグメントでの非ヒト哺乳動物の免疫化を通じて得ることができる。ポリクローナル抗体から開始して、次に、標準的な方法を使用してモノクローナル抗体を得ることができる。
本発明の抗体を、検出可能な標識とコンジュゲートし、イムノコンジュゲートを形成することができる。適した検出可能な標識は、例えば、ラジオアイソトープ、蛍光標識、化学発光標識、酵素標識、生物発光標識、又は金コロイドを含む。そのような検出可能に標識されたイムノコンジュゲートを作製及び検出する方法は、当業者に周知であり、以下により詳細に記載されている。
検出可能な標識は、オートラジオグラフィーにより検出されるラジオアイソトープでありうる。本発明の目的のために特に有用である同位体は、3H、125I、311I、35S、及び14Cである。
イムノコンジュゲートはまた、蛍光化合物で標識することができる。蛍光標識抗体の存在は、イムノコンジュゲートを適切な波長の光に曝露させ、結果としての蛍光を検出することにより決定される。蛍光標識化合物は、フルオレセインイソチオシアネート、ローダミン、フィコエリスリン(phycoerytherin)、フィコシアニン、アロフィコシアニン、o-フタルアルデヒド(phthaldehyde)、及びフルオレスカミンを含む。
あるいは、イムノコンジュゲートは、抗体を化学発光化合物に結合させることにより検出可能に標識することができる。化学発光タグ付きイムノコンジュゲートの存在は、化学反応の過程の間に生じる発光の存在を検出することにより決定される。化学発光標識化合物の例は、ルミノール、イソルミノール、芳香族アクリジニウムエステル、イミダゾール、アクリジニウム塩、及びシュウ酸エステルを含む。
同様に、生物発光化合物を使用し、本発明のイムノコンジュゲートを標識することができる。生物発光は、触媒タンパク質が化学発光反応の効率を増加させる生物系において見出される化学発光の一種である。生物発光タンパク質の存在は、発光の存在を検出することにより決定される。標識のために有用である生物発光化合物は、ルシフェリン、ルシフェラーゼ、及びエクオリンを含む。
あるいは、イムノコンジュゲートは、モノクローナル抗体を酵素に連結させることにより検出可能に標識することができる。酵素コンジュゲートを適切な基質の存在においてインキュベートされる場合、酵素部分は基質と反応し、例えば、分光光度的、蛍光光度的、又は視覚的な手段により検出することができる化学部分を産生する。多重特異性イムノコンジュゲートを検出可能に標識するために使用することができる酵素の例は、β-ガラクトシダーゼ、グルコースオキシダーゼ、ペルオキシダーゼ、及びアルカリホスファターゼを含む。
本発明の抗体は、金属化学元素、例えばランタニドなどで標識してもよい。ランタニドは、それらが安定な同位体であるという点において他の標識を上回るいくつかの利点を提供し、利用可能なそれらの多数、最大100又はそれ以上の異なる標識があり、それらは比較的安定であり、それらは高度に検出可能であり、質量分析を使用して検出された場合、検出チャネル間で簡単に分離される。ランタニド標識はまた、広いダイナミックレンジの検出を提供する。ランタニドは高い感度を示し、光及び時間に対して低感度であり、従って、非常に柔軟で頑強であり、多数の異なる設定において利用することができる。ランタニドは、原子番号57~71を伴う一連の15の金属化学元素である。それらはまた、希土類元素と呼ばれる。ランタニドは、CyTOF技術を使用して検出されうる。CyTOFは、誘導結合プラズマ飛行時間型質量分析法(ICP-MS)である。CyTOF機器は、利用可能な安定な同位体タグと同じくらい多いパラメーターについて、1秒当たり最大1000個の細胞を分析することが可能である。
当業者は、本発明に従って用いることができる他の適した標識を知っているであろう。モノクローナル抗体へのマーカー部分の結合は、当技術分野で公知の標準的な技術を使用して達成することができる。
さらに、免疫化学的検出の利便性及び汎用性は、アビジン、ストレプトアビジン、及びビオチンとコンジュゲートされているモノクローナル抗体を使用することにより増強させることができる。
本発明の別の目的は、上に記載するように、本発明による少なくとも1つの単離されたトキソプラズマ・ゴンディポリペプチドを使用してTゴンディポリペプチドBCLAに対して向けられた抗体を検出する、及び/又は生物学的サンプル中でのその量を評価するための方法である。
本明細書で使用するとき、用語「生物学的サンプル」は、対象の任意の生物学的サンプル;組織サンプル又は体液サンプルを指す。TゴンディポリペプチドBCLAに対して向けられた抗体を検出するための方法に関する好ましい実施形態において、生物学的サンプルは、前記対象の体液である。そのようなサンプルの非限定的な例は、血液、血清、血漿、尿、唾液、ならびに脳脊髄液(CSF)及び房水を含むが、これらに限定されない。
より具体的には、体液サンプルは血清又は房水サンプルである。本発明のTゴンディBCLAポリペプチドに対する抗体の検出に関する好ましい実施形態において、生物学的サンプルは体液サンプル、より具体的には脳サンプルである。
本発明の検出及び診断方法:
一部の実施形態において、本発明の方法はインビトロ又はエクスビボで実施される。
TゴンディBCLAポリペプチドを検出するための方法。
本発明の目的は、本発明のTゴンディポリペプチドBCLAを検出する、及び/又は生物学的サンプル中のその量を評価するための方法である。
生物学的サンプルは、組織サンプル、培養培地及び細胞サンプル、全血サンプル、血清サンプル、血漿サンプル、房水サンプル、唾液サンプル、脳脊髄液サンプル、筋肉サンプル、又は脳組織サンプルを意味するが、これらに限定されない。
TゴンディBCLAポリペプチドの検出に関する好ましい実施形態において、生物学的サンプルは組織サンプル、より具体的には筋肉サンプル又は脳サンプルである。
TゴンディポリペプチドBCLAを検出することは、タンパク質/ポリペプチドの分離;タンパク質の分子量に基づく遠心分離;質量及び電荷に基づく電気泳動;疎水性に基づくHPLC;サイズに基づくサイズ排除クロマトグラフィー;及び使用されている特定の固相についてのタンパク質の親和性に基づく固相親和性を含みうる。一度、分離されると、TゴンディポリペプチドBCLAは、公知の「分離プロファイル」、例えば、そのタンパク質についての、標準的な技術を使用して測定される保持時間に基づいて同定されうる。あるいは、分離されたタンパク質は、例えば、質量分析計により検出及び測定されうる(実施例のセクションを参照)。
本発明のTゴンディポリペプチドBCLA種の検出及び量は、標準的な電気泳動技術及び免疫診断技術(イムノアッセイ、例えば競合、直接反応、例えば免疫組織化学、又はサンドイッチ型アッセイなどを含む)を使用することにより決定されうる。そのようなアッセイは、ウエスタンブロット;凝集テスト;酵素標識及び媒介イムノアッセイ、例えばELISA;ビオチン/アビジン型アッセイ;ラジオイムノアッセイ;免疫電気泳動;免疫沈降などを含むが、これらに限定されない。この反応は一般的に、標識、例えば蛍光標識、化学発光標識、放射性標識、酵素標識又は色素分子などを明らかにすること、あるいは抗原とそれと反応する抗体又は複数の抗体の間での複合体の形成を検出するための他の方法を含む。
例えば、TゴンディポリペプチドBCLA量の決定は、多様な技術及び方法、当技術分野における任意の周知の方法により実施することができる:RIAキット(DiaSorin; IDS、Diasource)Elisaキット(Fujirebio、Thermo Fisher、EHTGFBI、 R&D DY2935、IDS(手動)IDS(オープンアナライザーで適応)免疫化学発光自動化方法(MesoScaleDiscovery、DiaSorin Liaison、Roche Elecsysファミリー、IDS iSYS)(Janssen et al., 2012)Simoa/Quanterix。
特定の実施形態において、本発明の方法は、生物学的サンプルを結合パートナーと接触させることを含む。
本明細書で使用するとき、結合パートナーは、本発明のTゴンディポリペプチドBCLAと選択的に相互作用することが可能な分子を指す。
結合パートナーは、一般的に、ポリクローナル又はモノクローナル、好ましくはモノクローナルでありうる抗体でありうる。
別の実施形態において、結合パートナーはアプタマーでありうる。アプタマーは、分子認識の点において抗体に対する代替物となる分子のクラスである。アプタマーは、実質的に任意のクラスの標的分子を高い親和性及び特異性で認識する能力を伴うオリゴヌクレオチド又はオリゴペプチド配列である。そのようなリガンドは、Tuerk et al. (1990) Science, 249, 505-510において記載されているように、ランダム配列ライブラリーのSystematic Evolution of Ligands by EXponential enrichment(SELEX)を通じて単離することができる。ランダム配列ライブラリーは、DNAのコンビナトリアル化学合成により入手可能である。このライブラリーにおいて、各々のメンバーは、最終的に化学的に修飾された、固有の配列の線状オリゴマーである。このクラスの分子の可能な修飾、使用、及び利点は、Jayasena 1999において概説されている。ペプチドアプタマーは、2つのハイブリッド方法(Colas et al. (1996) Nature, 380, 548-50)によりコンビナトリアルライブラリーより選択されるプラットフォームタンパク質、例えば大腸菌チオレドキシンAなどにより呈示される立体構造的に制約された抗体可変領域からなる。
本発明の結合パートナー、例えば抗体又はアプタマーなどは、検出可能な分子又は物質、例えば蛍光分子、放射性分子、又は当技術分野において公知の任意の他の標識で標識してもよい。標識は当技術分野において公知であり、それらは一般的に(直接的又は間接的のいずれかで)シグナルを提供する。
本明細書で使用するとき、用語「標識された」は、結合パートナーに関して、検出可能な物質、例えば放射性物質又はフルオロフォア(例、フルオレセインイソチオシアネート(FITC)又はフィコエリトリン(PE)又はインドシアニン(Cy5))などを、抗体又はアプタマーに結合(即ち、物理的に連結)することによる抗体又はアプタマーの直接的な標識 、ならびに検出可能な物質との反応性によるプローブ又は抗体の間接的な標識を包含することを意図する。本発明の抗体又はアプタマーは、当技術分野において公知の任意の方法により放射性分子で標識されうる。例えば、放射性分子は、シンチグラフィー試験用の放射性原子、例えばI123、I124、In111、Re186、Re188などを含むが、これらに限定されない。
前述のアッセイは、一般的に、固体支持体における結合パートナー(即ち、抗体又はアプタマー)の結合を含む。本発明の実施において使用することができる固体支持体は、基質、例えばニトロセルロースなど(例、膜又はマイクロタイターウェルの形態において);ポリ塩化ビニル(例、シート又はマイクロタイターウェル);ポリスチレンラテックス(例、ビーズ又はマイクロタイタープレート);ポリビニリジンフルオリド;ジアゾ化ペーパー;ナイロン膜;活性化ビーズ、磁気応答性ビーズなどを含む。より具体的には、ELISA方法を使用することができ、そこで、マイクロタイタープレートのウェルがTゴンディポリペプチドBCLAに対する抗体のセットでコーティングされる。TゴンディポリペプチドBCLAを含む、又は含むことが疑われる体液サンプルを次に、コーティングされたウェルに加える。結合パートナー-TゴンディポリペプチドBCLA複合体の形成を可能にするのに十分なインキュベーションの期間後、プレートを洗浄して非結合物質を除去し、標識された二次結合分子を加えることができる。二次結合分子は、任意の捕捉されたサンプルマーカータンパク質と反応することができ、プレートは洗浄され、二次結合分子の存在は、当技術分野において周知の方法を使用して検出される。
結合パートナーとして、二次結合分子を標識してもよい。
本発明の抗体及びイムノコンジュゲートは、本発明のTゴンディポリペプチドBCLAを検出する、ならびに/あるいは生物学的サンプル、特に組織サンプル、培養培地、及び細胞サンプル、全血サンプル、血清サンプル、血漿サンプル、脳脊髄液サンプル、又は脳組織サンプル中でのその量を評価するために使用することができる。従って、それらはトキソプラズマ・ゴンディ病原体に関連付けられる全ての疾患を診断するために使用することができる。
潜伏形態のトキソプラズマ症の診断の方法(TゴンディポリペプチドBCLAの検出)
したがって、本発明によるTゴンディBCLAポリペプチドの検出の方法は、結果的に、生物学的サンプルからのトキソプラズマ症のインビトロ診断のために有用である。特に、本発明の検出の方法は、結果的に、生物学的サンプルからの潜伏形態のトキソプラズマ症又は先天性トキソプラズマ症のインビトロ診断のために有用である。本明細書で使用するとき、用語「生物学的サンプル」は、対象の任意の生物学的サンプルを指す。生物学的サンプルは、任意の組織サンプル、培養培地及び細胞サンプル、全血サンプル、血清サンプル、血漿サンプル、尿サンプル、唾液サンプル、脳脊髄液サンプルを意味するが、これらに限定されない。
TゴンディBCLAポリペプチドの検出を使用した方法に関する好ましい実施形態において、生物学的サンプルは、組織サンプル、より具体的には、脳組織サンプル又は筋肉組織サンプルである。
本発明のさらなる目的は、本発明のTゴンディポリペプチドBCLAを検出する、及び/又は生物学的サンプル中でのその量を評価するための方法であって、前記方法は、前記サンプルをトキソプラズマ・ゴンディポリペプチドBCLAと、前記抗体/イムノコンジュゲートの間での免疫複合体の形成を可能にする条件下で接触させること、及び形成された免疫複合体を検出又は測定することを含む。
本発明のさらなる目的は、ブラディゾイト嚢胞を検出する、及び/又は生物学的サンプル中でのその量を評価するための方法であって、前記方法は、前記サンプルを本発明の抗体又はイムノコンジュゲートと、嚢胞の表面でのトキソプラズマ・ゴンディポリペプチドBCLAと前記抗体/イムノコンジュゲートの間での免疫複合体の形成を可能にする条件下で接触させること、及び形成された免疫複合体を検出又は測定することを含む。
形成された免疫複合体は、標準的な技術(非限定的な例として、酵素結合免疫吸着アッセイ(ELISA)又は他の固相イムノアッセイ、ラジオイムノアッセイ、電気泳動、免疫蛍光、又はウエスタンブロットを含む)を使用した多様な方法により検出又は測定することができる。
本発明のさらなる目的は、トキソプラズマ症をインビトロで診断するための方法であって、前記方法は、テストされる対象からの生物学的サンプル中で、上に示すように、トキソプラズマ・ゴンディポリペプチドBCLAの存在を検出することを含む。
用語「トキソプラズマ症」は、当技術分野におけるその一般的な意味を有し、妊娠女性及び免疫不全患者において医学的な重要性を伴う、世界的に分布する人獣共通感染症を指す。トキソプラズマ・ゴンディは、トキソプラズマ症の病原体であり、その恒温性宿主(ヒトを含む)と同時進化してきたが、通常は準潜在性集団として存続し、したがって、無症状の徴候を伴って持続するための戦略であり、それ故に、新たな宿主への伝播の可能性を最適化する。温血後生動物におけるその長期滞在にわたり、増殖段階(タキゾイト)は持続段階(嚢胞に封入されたブラディゾイト)に切り替わり、それによって、寄生虫が、ネコ科に限定される、その性的段階を通じて進むことなく、新たな宿主に広がる特有の機会が与えられる。免疫バランスが一時的に又はより持続的に破綻した場合に生じるタキゾイト集団の制御されない増幅は、生命を脅かす疾患に、先天性トキソプラズマ症の場合においては出生時欠損に導きうる。持続性は、寄生虫のサブセットによる遅い複製スキルの獲得及び速い複製集団の破壊の両方に依存し、IL-12/IFN-γ免疫軸を決定的に要求するが、Tゴンディは、段階変換を操作するために、細かく調整され、後成的に調節された発生プログラムを単独で発達させてきた。
一部の実施形態において、トキソプラズマ症は先天性トキソプラズマ症である。
このように、本発明は、先天性トキソプラズマ症をインビトロで診断するための方法を指し、前記方法は、テストされる対象からの生物学的サンプル中での、請求項1に記載のポリペプチドの存在を検出することを含む。
本明細書で使用するとき、用語「潜伏形態のトキソプラズマ症」は、トキソプラズマ症の持続段階(嚢胞に封入されたブラディゾイト)を指す。身体全体を通したタキゾイト増殖により特徴付けられる感染の初期期間に続いて、宿主の免疫系からの圧力によって、Tゴンディタキゾイトは、ブラディゾイト(寄生虫の半休眠のゆっくりと分裂する細胞段階)に変換される。宿主細胞内では、これらのブラディゾイトのクラスターは組織嚢胞として公知である。嚢胞壁は寄生虫体胞膜により形成される。ブラディゾイトを含む組織嚢胞は実質的に任意の器官において形成されうるが、組織嚢胞は脳、目、及び横紋筋(心臓を含む)において主に形成され、持続する。しかし、特定の組織向性は中間宿主種間で変動しうる;ブタにおいて、組織嚢胞の大部分が筋肉組織中で見出されるのに対し、マウスにおいて、嚢胞の大部分は脳中で見出される。嚢胞は通常、サイズにおいて、直径5~50μmの間の範囲である(50μmは、平均的なヒト毛髪の幅の約3分の2である)。
さらに、本発明はまた、本発明の少なくとも1つの抗体又はそのフラグメントを含むキットを提供する。本発明のキットは、固体支持体、例えば、組織培養プレート又はビーズ(例、セファロースビーズ)に結合された抗体を含むことができる。インビトロでの、例えば、ELISA又はウエスタンブロットにおけるトキソプラズマ・ゴンディポリペプチドBCLAの検出及び定量用の抗体を含むキットを提供することができる。検出用に有用なそのような抗体は、標識、例えば蛍光又は放射性標識などと提供されうる。
潜伏形態のトキソプラズマ症の診断の方法(TゴンディポリペプチドBCLAの自己抗体の検出)
組換えタンパク質として合成された場合、本発明者らは、BCLAが、マウス脳における嚢胞の存在と明らかに、及び独占的に相関した、高い感受性を伴う潜伏感染の効率的な血清マーカーを構成することを明らかに実証している。BCLA抗原に対して向けられた抗体がヒト患者において検出されている。濃縮された力価が、Sag1又はタキゾイト関連抗原に対して血清陽性として適格とされた患者において検出された。抗BCLA IgG合成と嚢胞の間でのヒトにおけるさらなる相関が、嚢胞の存在に強く関連する病理学的パネルにおいて有意に強い記録された力価によりもたらされる。注目すべきことに、血清学的再燃をおこしている患者及び証明された眼トキソプラズマ症を患っている患者において(実施例の図10及び13中の実験データを参照)。後者の場合において、開発されたELISAアッセイはまた、これらの患者の一部の房水及び血清内のBCLA抗体を検出することができる。半休眠の嚢胞に対して向けられたトキソプラズマ抗体の検出は、新たな診断の展望を開くことにより、トキソプラズマ症の血清診断に対する有意な改善である。実際に、嚢胞壁又は表面ブラディゾイトの少数の成分が同定されており、そのいずれも、少なくとも市販のキットにおいて、血清学の目的のための抗原として役立つことは示されていない。理想的な抗原は、潜伏性のブラディゾイトの段階だけにおいて発現されるべきであり、理想的には、嚢胞の表面に曝露されるべきであり、BCLAポリペプチドにおいて見出される2つの特色である。
さらに、本発明者らは、子供が出生前に特異的に抗BCLA IgGを新合成することを実証している。このように、BCLAの反応性は、Vidas(登録商標)及びArchitect(登録商標)によるToxo IgGの滴定との比較において、出生時での先天性トキソプラズマ症の診断をさらに良好に方向付けることができる(実施例3を参照)。
したがって、本発明によるTゴンディポリペプチドの自己抗体の検出の方法は、結果的に、生物学的サンプルからのトキソプラズマ症のインビトロ診断のために有用である。特に、本発明の検出の方法は、結果的に、生物学的サンプルからの潜伏形態のトキソプラズマ症又は先天性トキソプラズマ症のインビトロ診断のために有用である。
本発明のさらなる目的は、トキソプラズマ症をインビトロで診断するための方法であって、前記方法は、テストされる対象からの生物学的サンプル中に、上に示すように、本発明によるTゴンディポリペプチドのT自己抗体の存在を検出することを含む。
このように、本発明は、対象が潜伏形態のトキソプラズマ症に罹患しているか否かを決定する方法に関し、前記方法は以下を含む:
a)患者の生物学的サンプル中で、本発明のTゴンディポリペプチドに対する免疫反応性を検出すること;及び、任意選択的に
b)工程a)の結果から、患者が潜伏形態のトキソプラズマ症に罹患しているか否かを推定すること、本発明のTゴンディポリペプチドに対する免疫反応性は、潜伏形態のトキソプラズマ症を示している。
本発明はまた、患者における潜伏形態のトキソプラズマ症を診断(又は確認)するためのバイオマーカーとしての、潜伏形態のトキソプラズマ症に対して向けられた抗体の使用に関する。
本発明はまた、潜伏形態のトキソプラズマ症を患っている、又は患っていることが疑われる患者において潜伏形態のトキソプラズマ症を診断する又は診断を確認するためのインビトロ方法に関し、以下を含む:
a)患者から生物学的サンプルを得ること、及び
b)生物学的サンプル中で、本発明のTゴンディポリペプチドに対する抗体を検出すること;
ここで、生物学的サンプル中の抗体の存在によって、患者における潜伏形態のトキソプラズマ症を診断する又は診断を確認する。
このように、本発明は、対象が先天性トキソプラズマ症に罹患しているか否かを決定する方法に関し、前記方法は以下を含む:
a)患者の生物学的サンプル中で、本発明のTゴンディポリペプチドに対する免疫反応性を検出すること;及び、任意選択的に
b)工程a)の結果から、患者が先天性トキソプラズマ症に罹患しているか否かを推定すること、本発明のTゴンディポリペプチドに対する免疫反応性は、先天性トキソプラズマ症を示している。
本発明はまた、患者における先天性トキソプラズマ症を診断(又は確認)するためのバイオマーカーとしての先天性トキソプラズマ症に対して向けられた抗体の使用に関する。
本発明はまた、先天性トキソプラズマ症を患っている、又は患っていることが疑われる患者において先天性トキソプラズマ症を診断する又は診断を確認するためのインビトロ方法に関し、以下を含む:
b)患者から生物学的サンプルを得ること、及び
b)生物学的サンプル中で、本発明のTゴンディポリペプチドに対する抗体を検出すること;
ここで、生物学的サンプル中の抗体の存在によって、患者における先天性トキソプラズマ症を診断する又は診断を確認する。
本明細書で使用するとき、用語「生物学的サンプル」は、対象の任意の生物学的サンプルを指す。TゴンディBCLAポリペプチドに対して向けられた抗体の検出を使用する方法に関する好ましい実施形態において、生物学的サンプルは、前記対象の体液である。そのようなサンプルの非限定的な例は、血液、血清、血漿、尿、唾液、ならびに脳脊髄液(CSF)及び房水を含むが、これらに限定されない。
より具体的には、体液サンプルは血清又は房水サンプルである。
好ましい実施形態において、テストされる患者は、トキソプラズマ症を患っている、又は患っていることが疑われる。
別の好ましい実施形態において、テストされる患者は、トキソプラズマ症を患っていることが疑われ、この方法は、患者が潜伏形態のトキソプラズマ症に実際に罹患していることを確認するために実施される。
別の実施形態において、テストされる患者は、妊娠している女性及び/又は免疫不全の患者(即ち、HIV患者又は移植を受ける前に免疫調節により処置された患者)であり、この方法は、患者が潜伏形態のトキソプラズマ症に実際に罹患しているか否かを決定するために実施される。
被験者が急性トキソプラズマ症の徴候及び症状を呈した場合のトキソプラズマ症のための現在の処置は以下である:
・ピリメタミン(ダラプリム)。この医薬は、典型的にはマラリアのために使用され、葉酸拮抗薬である。それは、特に患者が長期間にわたり高い用量を摂取している場合、身体がビタミンB群の葉酸(葉酸、ビタミンB-9)を吸収するのを妨げうる。その理由のため、追加の葉酸を摂取することが推奨されうる。ピリメタミンの他の潜在的な副作用は、骨髄抑制及び肝毒性を含む。
・スルファジアジン。この抗生物質は、トキソプラズマ症を処置するためにピリメタミンと使用される。
HIV/AIDS患者については、トキソプラズマ症のために選ばれる処置はまた、ピリメタミン及びスルファジアジンであり、葉酸(ロイコボリン)を伴う。代替物は、クリンダマイシン(クレオシン)と摂取されるピリメタミンである。
トキソプラズマ症に感染された妊娠女性及び乳児について:
感染が妊娠16週以前に生じた場合、妊娠女性は抗生物質スピラマイシンを受ける。この薬物の使用によって、先天性トキソプラズマ症からの神経学的問題の乳児のリスクが低下しうる。
感染が妊娠16週後に生じた場合、又はテストによって、胎児がトキソプラズマ症を有することが示された場合、妊娠女性にはピリメタミン及びスルファジアジン及び葉酸(ロイコボリン)が与えられうる。
本発明はまた、少なくとも1つの葉酸拮抗薬及び/又は抗生物質化合物で処置されるのに適した潜伏形態のトキソプラズマ症に罹患している患者を選択するためのインビトロ方法を提供し、以下を含む:
a)患者の生物学的サンプル中で、本発明のTゴンディポリペプチドに対する免疫反応性を検出すること;及び、任意選択的に
b)本発明のTゴンディポリペプチドに対する免疫反応性が検出された場合、少なくとも1つの葉酸拮抗薬(即ち、ピリメタミン)及び/又は抗生物質化合物(即ち、スルファジアジン又はスピラマイシン)で処置されるのに適した患者を選択すること。
患者が潜伏形態のトキソプラズマ症に罹患しているか否かを決定する方法、潜伏形態のトキソプラズマ症を診断(又は確認)するためのバイオマーカーとしての本発明のTゴンディポリペプチドに対して向けられた抗体の使用、ならびに本発明の少なくとも1つの葉酸拮抗薬及び/又は抗生物質化合物で処置されるのに適した潜伏形態のトキソプラズマ症に罹患している患者を選択する方法は、例えば、インビトロ又はエクスビボの方法でありうる。
本発明はまた、本発明のTゴンディポリペプチドに対して免疫反応性を示す潜伏形態のトキソプラズマ症に感染された患者を処置するための方法に関し、この方法は、患者に葉酸拮抗薬(即ち、ピリメタミン)及び/又は抗生物質化合物(即ち、スルファジアジン又はスピラマイシン)、あるいは前記化合物を含む医薬組成物を投与することを含む。
本発明はまた、本発明のTゴンディポリペプチドに対して免疫反応性を示す、潜伏形態のトキソプラズマ症を患っている患者の処置における使用のための、葉酸拮抗薬(即ち、ピリメタミン)及び/又は抗生物質化合物(即ち、スルファジアジン又はスピラマイシン)、又は前記化合物を含む医薬組成物を提供する。
一部の実施形態において、免疫反応性がテストされる、本発明のTゴンディポリペプチドは、BCLA(脳嚢胞負荷関連抗原)タンパク質(「BCLA」として略記)、BCLAのC末端ドメイン末端(res 1089から1275、配列番号2)(「rBCLA」として略記)、又はBCLAの内部反復ドメイン(BCLAのres 304-924)(TgR1からTgR13(配列番号4から配列番号16)と呼ばれる)である。
特定の実施形態において、免疫反応性がテストされるタンパク質は、rBCLAポリペプチドである。
別の特定の実施形態において、免疫反応性がテストされるタンパク質は、BCLAの少なくとも9つの連続アミノ酸のペプチドフラグメント、rBCLA配列又はBCLAの内部反復ドメイン(BCLAのres 304-924)(TgR1からTgR13(配列番号4から配列番号16)と呼ばれる)である。
特に、免疫反応性がテストされる、本発明の用語「Tゴンディポリペプチド」は、以下を指す:
(i)トキソプラズマ・ゴンディポリペプチドBCLA(配列番号1)からなるアミノ酸配列;
(ii)C末端抗原ドメイン(rBCLAと呼ばれる、BCLAのres 1089-1275)からなるアミノ酸配列(配列番号2);
(iii)以下からなる群より選択される、BCLAの内部反復ドメインからなるアミノ酸配列:TgR1(配列番号4)、TgR2(配列番号5)、TgR3(配列番号6)、TgR4(配列番号7)、TgR5(配列番号8)、TgR6(配列番号9)、TgR7(配列番号10)、TgR8(配列番号11)、TgR9(配列番号12)、tgR10(配列番号13)、TgR11(配列番号14)、TgR12 (配列番号15)、及びTgR13(配列番号16);
(iv)(i)から(iii)の配列と実質的に相同なアミノ酸配列、好ましくは(i)から(iii)の配列と少なくとも80%同一のアミノ酸配列
(v)(i)から(iv)の配列の少なくとも9つの連続アミノ酸のフラグメント。
したがって、特定の実施形態において、免疫反応性がテストされる、rBCLAポリペプチドからの単離されたトキソプラズマ・ゴンディポリペプチドは、以下からなる群よりテスト/選択される:
(i)GELQPAEAEEARLLVADLKAV(rBCLAのドメインA)(配列番号32)
(ii)VRVEGEAFFRASVDLYEA(rBCLAのドメインB)(配列番号33)
(iii)KLRPLTKGELVDVVRQ(rBCLAのドメインC)(配列番号34)
(iv)TQIFVQDRASAFLRV(rBCLAのペプチド36及びrBCLAのドメインD)(配列番号35)
(v)AAEQMKAVFAMVEEG(rBCLAのペプチド44及びrBCLAのドメインE)(配列番号36)
(vi)(i)から(v)の配列と実質的に相同なアミノ酸配列、好ましくは(i)から(v)の配列と少なくとも95%同一のアミノ酸配列
(vii)(i)から(vi)の配列の少なくとも9つの連続アミノ酸のフラグメント。
より具体的な実施形態において、免疫反応性がテストされる、rBCLAポリペプチドからの単離されたトキソプラズマ・ゴンディポリペプチドは、以下の群より選択される:
(i)GELQPAEAEEARLLV(rBCLAのペプチド12)(配列番号37);
(ii)QPAEAEEARLLVADL(rBCLAのペプチド13)(配列番号38)、
(iii)EAEEARLLVADLKAV(rBCLAのペプチド14)(配列番号39)、
(iv)VRVEGEAFFRASVDL(rBCLAのペプチド21)(配列番号40)、
(v)EGEAFFRASVDLYEA(rBCLAのペプチド22)(配列番号41);
(vi)AFFRASVDLYEAVKN(rBCLAのペプチド23)(配列番号42)、
(vii)KLRPLTKGELVDVVR(rBCLAのペプチド30)(配列番号43)
(viii)(i)から(vii)の配列と実質的に相同なアミノ酸配列、好ましくは(i)から(vii)の配列と少なくとも95%同一のアミノ酸配列
(vii)(i)から(viii)の配列の少なくとも9つの連続アミノ酸のフラグメント。
したがって、特定の実施形態において、免疫反応性がテストされる、BCLAの内部反復ドメインからの単離されたトキソプラズマ・ゴンディポリペプチドは、以下からなる群より選択される:
(i)TgR4の内部反復ドメインからなるアミノ酸配列、MERPAAGSMEKEKPVLPGEGEGHVLPKHETKPALTDEKRTKPGGPRTE(配列番号7)
(ii)(i)の配列と実質的に相同なアミノ酸配列、好ましくは(i)の配列と少なくとも80%同一のアミノ酸配列。
(iii)(i)から(ii)の配列の少なくとも9つの連続アミノ酸のフラグメント。
より特定の実施形態において、免疫反応性がテストされる、BCLAの内部反復ドメインからの単離されたトキソプラズマ・ゴンディポリペプチドは、以下からなる群より選択される:
(i)AAGSMEKEKPVLPGEGEGH(TgR4のドメインA);(配列番号44)
(ii)VLPKHETKPALTDEKRTKPGGP(TgR4のドメインB)、(配列番号45)
(iii)(i)から(ii)の配列と実質的に相同なアミノ酸配列、好ましくは(i)から(ii)の配列と少なくとも95%同一のアミノ酸配列
(iv)(i)から(iii)の配列の少なくとも9つの連続アミノ酸のフラグメント。
より具体的な実施形態において、免疫反応性がテストされる、BCLAの内部反復ドメインからの単離されたトキソプラズマ・ゴンディポリペプチドは、以下からなる群より選択される:
(i)AAGSMEKEKPVLPGE(TgR4のペプチド3);(配列番号46)
(ii)GSMEKEKPVLPGEGE(TgR4のペプチド4)(配列番号47)
(iii)MEKEKPVLPGEGEGH(TgR4のペプチド5)(配列番号48)
(iv)KEKPVLPGEGEGHVL(TgR4のペプチド6)(配列番号49)
(v)KPVLPGEGEGHVLPG(TgR4のペプチド7)(配列番号50)
(vi)HVLPKHETKPALTDEK(TgR4のペプチド13)、(配列番号51)
(vii)PKHETKPALTDEKRT(TgR4のペプチド14)、(配列番号52)
(viii)HETKPALTDEKRTKP(TgR4のペプチド15)(配列番号53)
(ix)TKPALTDEKRTKPGG(TgR4のペプチド16)(配列番号54)
(x)(i)から(ix)の配列と実質的に相同なアミノ酸配列、好ましくは(i)から(ix)の配列と少なくとも95%同一のアミノ酸配列
(xi)(i)から(x)の配列の少なくとも9つの連続アミノ酸のフラグメント。
BCLAポリペプチドは、異なるドメイン全体を通じて(特に、rBCLAにおいて、ならびにBCLA TgR1からTgR13の内部反復ドメインにおいて)多数のエピトープを有するため、本発明のBCLA免疫原性ペプチドフラグメントを組み合わせることが有利でありうる。
したがって、別の実施形態において、免疫反応性がテストされる本発明のポリペプチドは、本発明の2つの免疫原性ペプチドフラグメント間の融合体であり、例えば
ペプチドAB_F:MERPAAGSMEKEKPVLPGEGEGLPKHETKPALTDEKRTKPGGP(Tgr4/Trg12/Tgr13中に存在する反復モチーフ及びTgr3/Trg4/Tgr5/Tgr6/Tgr9中に存在する反復モチーフからのペプチドフラグメントの融合体)(配列番号55)
ペプチドA3_B:AAGSMEKDKLVLPGE(Tgr3/Tgr5/Tgr6/Tgr7/Trg10/Tgr11中に存在する反復モチーフからのペプチドフラグメント)(配列番号56)
したがって、別の実施形態において、免疫反応性がテストされる、BCLAの内部反復ドメイン(TgRx)からの本発明のポリペプチドは、以下の配列を有する:
M-Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-Xaa7-M-E-Xaa8-Xaa9-K-Xaa10-V-Xaa11-P-G-E-G-Xaa12-Xaa13-H-Xaa14-Xaa15-P-K-Xaa16-E-Xaa17- Xaa18-L-T-Xaa19-Xaa20-Xaa21-Xaa22-T-Xaa23-P-Xaa24-Xaa25-P-Xaa26-Xaa27-Xaa28(配列番号64)
ここで、Xaa1は)グルタミン酸(E)である又はアミノ酸残基はない、
ここで、Xaa2はアルギニン(R)又はセリン(S)である、
ここで、Xaa3はプロリン(P)又はグリシン(G)である、
ここで、Xaa4はアラニン(A)又はグリシン(G)である、
ここで、Xaa5はアラニン(A)である又はアミノ酸残基はない、
ここで、Xaa6はグリシン(G)又はアルギニン(R)である、
ここで、Xaa7はセリン(S)、プロリン(P)、又はアラニン(A)である、
ここで、Xaa8はリジン(K)又はグルタミン酸(E)である、
ここで、Xaa9はリジン(K)、グルタミン酸(E)、又はアスパラギン酸(D)である、
ここで、Xaa10はプロリン(P)又はロイシン(L)である、
ここで、Xaa11はロイシン(L)又はセリン(S)である、
ここで、Xaa12はグルタミン酸(E)又はリジン(K)である、
ここで、Xaa13はグリシン(G)又はアルギニン(R)である、
ここで、Xaa14はバリン(V)又はアラニン(A)である、
ここで、Xaa15はロイシン(L)又はセリン(S)である、
ここで、Xaa16はヒスチジン(H)、アスパラギン酸(D)、又はアラニン(A)である、
ここで、Xaa17はスレオニン(T)、アルギニン(R)、メチオニン(M)、又はグルタミン(Q)である、
ここで、Xaa18はプロリン(P)、スレオニン(T)、又はアラニン(A)である、
ここで、Xaa19はアスパラギン酸(D)、グルタミン酸(E)、又はグルタミン(Q)である、
ここで、Xaa20はグルタミン酸(E)又はリジン(K)である、
ここで、Xaa21はリジン(K)、グリシン(G)、又はグルタミン酸(E)である、
ここで、Xaa22はアルギニン(R)又はバリン(V)である、
ここで、Xaa23はリジン(K)、グルタミン酸(E)、又はアスパラギン(N)である、
ここで、Xaa24はグリシン(G)、バリン、又はイソロイシン(I)である、
ここで、Xaa25はグリシン(G)又はグルタミン酸(E)である、
ここで、Xaa26はアルギニン(R)又はプロリン(P)である、
ここで、Xaa27はスレオニン(T)システイン(C)リジン(K)又はメチオニン(M)である、
ここで、Xaa28はグルタミン酸(E)又はアラニン(A)である、
又は配列番号64の配列の少なくとも9つの連続アミノ酸のフラグメント。
「アミノ酸配列が実質的に相同であるポリペプチド」は、全長ポリペプチド参照配列に対して少なくとも約80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、又は99%のアミノ酸配列同一性を有するポリペプチドを意味する。本願の文脈において、同一性のパーセンテージは、グローバルアラインメント(即ち、2つの配列が、それらの全長にわたり比較される)を使用して算出される。2つ又はそれ以上の配列の同一性を比較するための方法は、当技術分野において周知である。≪needle≫プログラム(Needleman-Wunschグローバルアラインメントアルゴリズム(Needleman and Wunsch, 1970 J. Mol. Biol. 48:443-453)を使用し、2つの配列の最適なアラインメント(ギャップを含む)を、それらの全長を考慮した場合に見出す)を、例えば使用することができる。needleプログラムは、例えば、ebi.ac.ukワールドワイドウェブサイトで入手可能である。本発明による同一性のパーセンテージは、好ましくは、10.0に等しい「ギャップオープン」パラメーター、0.5に等しい「ギャップエクステンド」パラメーター、及びBlosum62マトリックスを伴うEMBOSS :: needle(グローバル)プログラムを使用して算出される。
本願を通して使用されるように、表現「標的タンパク質に対する免疫反応性」(ここでは本発明のTゴンディポリペプチド)は、テストされる患者からのサンプルが標的に対して特異的に対する抗体を含むことを意味することを意図する。
従って、標的タンパク質に対する免疫反応性は、テストされる生物学的サンプル中で、標的タンパク質又はこの標的タンパク質のフラグメントに対して特異的に対する抗体の存在を実証することにより簡単に検出することができる。
標的タンパク質のフラグメントは、N末端もしくはC末端で切断されている、又は、例えば、完全長タンパク質と比較した場合、内部残基を欠きうる。好ましくは、前記フラグメントは、少なくとも約9、10、20、30、40、50、60、70、80、90、100、110、120、150、250、300、350、400、450、500又はそれ以上のアミノ酸長である。
そのようなテストは、標準的な方法、例えば、酵素結合免疫吸着アッセイ(「ELISA」)、ウエスタンブロット/ドットブロット、トランスフェクトされた細胞の免疫組織化学、Luminex(総説については、Immunodiagnostics: A Practical Approach, R. Edwards Editor, Oxford University Press 2000;Manual of Molecular And Clinical Laboratory Immunology, J. D. Folds R. G. Hamilton, B. Detrick Editors ASM Press 2006;Immunology and Serology in Laboratory Medicine, M. L. Turgeon, Mosby Inc, 2008を参照)を使用することにより、当技術分野の通常の技能の1つにより実施することができる。
例えば、サンプル中の抗BCLA抗体の存在を決定するために、標的タンパク質は、全長BCLAポリペプチド、C末端抗原ドメイン(BCLAのres 1089-1275)(rBCLA(配列番号2)と呼ばれる)、BCLAの内部反復ドメイン(BCLAのres 304-924)(TgR1からTgR13と呼ばれる)(配列番号4から配列番号16)又はそのフラグメントでありうる。好ましくは、標的タンパク質は、C末端抗原ドメイン(rBCLA(配列番号2)と呼ばれるBCLAのres 1089-1275)、BCLAの内部反復ドメイン(BCLAのres 304-924)(TgR1からTgR13と呼ばれる)(配列番号4から配列番号16)又はそのフラグメントからなる、又はそれらを含む。
本明細書で使用するとき、用語「患者」は、哺乳動物、より具体的にはヒトを意味する。
本発明の文脈において、用語「処置する」は、本明細書において、(1)そのような用語が適用される疾患状態又は条件の症状の進行、増悪、又は悪化を遅らせる又は停止させる;(2)そのような用語が適用される疾患状態又は条件の症状を軽減させる又は寛解をもたらす;ならびに/あるいは(3)そのような用語が適用される疾患状態又は条件の症状を逆転させる又は治癒させることを目的とする治療方法又は過程を特徴付けるために使用される。
上記の方法において使用される、又は潜伏形態のトキソプラズマ症に罹患した患者を処置するために使用される葉酸拮抗薬及び/又は抗生物質化合物は、処置される患者に有害ではない医薬的に許容可能な担体、賦形剤、又は希釈剤中で提供される。
本発明の組成物中で使用されうる医薬的に許容可能な担体及び賦形剤は、イオン交換体、アルミナ、ステアリン酸アルミニウム、レシチン、自己乳化型ドラッグデリバリーシステム(SEDDS)、例えばd-a-トコフェロールポリエチレングリコール1000コハク酸など、医薬的剤形において使用される界面活性剤、例えばTweens 又は他の同様のポリマー送達マトリックスなど、血清タンパク質、例えばヒト血清アルブミンなど、緩衝物質、例えばリン酸、グリシン、ソルビン酸、ソルビン酸カリウム、飽和植物性脂肪酸の部分グリセリド混合物など、水、塩又は電解質、例えば硫酸プロタミン、リン酸水素二ナトリウム、リン酸水素カリウム、塩化ナトリウム、亜鉛塩、コロイド状シリカ、三ケイ酸マグネシウムなど、ポリビニルピロリドン、セルロースベース物質、ポリエチレングリコール、カルボキシメチルセルロースナトリウム、ポリアクリレート、ワックス、ポリエチレン-ポリオキシプロピレン-ブロックポリマー、ポリエチレングリコール及び羊毛脂を含むが、これらに限定されない。
当業者により理解されるように、組成物は、意図された投与の経路と適合性であるように適切に製剤化される。適した投与の経路の例は、非経口経路を含み、例えば、筋肉内、皮下、静脈内、腹腔内、又は局所注射を含む。経口経路を、組成物が経口投与のために適した形態であり、胃及び腸の酵素から活性成分を保護することができるという条件であれば使用することもできる。
さらに、上記の方法において使用される、又は潜伏形態のトキソプラズマ症に罹患している患者を処置するために使用される葉酸拮抗薬及び/又は抗生物質化合物の量は、治療的に有効な量である。
使用される葉酸拮抗薬及び/又は抗生物質化合物の正確な量、ならびに投与される組成物は、処置されている患者の年齢及び体重、疾患の種類、投与の様式、投与の頻度ならびに葉酸拮抗薬及び/又は抗生物質化合物を含む組成物中の他の成分により変動しうる。そのような濃度は、当業者によりルーチン的に決定することができる。実際に投与される化合物の量は、典型的には、関連する状況(処置される状態、選ばれた投与の経路、投与される実際の葉酸拮抗薬及び/又は抗生物質化合物、個々の患者の年齢、体重、及び応答、患者の症状の重症度などを含む)に照らして、医師により決定されうる。
一般的に、上記の方法において使用される、又は潜伏形態のトキソプラズマ症に罹患している患者を処置するために使用される葉酸拮抗薬及び/又は抗生物質化合物は、典型的な範囲において投与されうる。有効な用量はまた、投与の経路、ならびに他の薬剤との同時使用の可能性に依存して変動しうる。
本発明はさらに、潜伏形態のトキソプラズマ症を診断するために、あるいは少なくとも1つの葉酸拮抗薬及び/又は抗生物質化合物で処置するのに適した潜伏形態のトキソプラズマ症に罹患している患者を選択するための上の方法において有用であるキットを提供する。
そのようなキットは、本発明の少なくとも1つのTゴンディポリペプチドに対する抗体を検出するための手段を含む。
好ましくは、キットは、少なくとも、BCLAポリペプチド、あるいはC末端抗原ドメイン(BCLAのres 1089-1275)又はそのフラグメントに対して向けられた抗体を検出するための手段を含む。
そのような手段は、標的タンパク質、即ち、免疫反応性がテストされる本発明のTゴンディポリペプチド、又は上に記載するそのフラグメントでありうる。例えば、BCLAに対する免疫反応性がテストされる場合、標的タンパク質は全長BCLAタンパク質であり、rBCLA(配列番号2)と呼ばれるC末端抗原ドメイン(BCLAのres 1089-1275)、TgR1からTgR13(配列番号4から配列番号16)と呼ばれるBCLAの内部反復ドメイン(BCLAのres 304-924)からなる、又はそれを含み、好ましくは、標的タンパク質は、rBCLA(配列番号2)と呼ばれるC末端抗原ドメイン(BCLAのres 1089-1275)、TgR1からTgR13(配列番号4から配列番号16)と呼ばれるBCLAの内部反復ドメイン(BCLAのres 304-924)からなるか、又はそれを含む。
本発明の少なくとも1つのTゴンディポリペプチドに対して向けられた抗体を検出するための手段はまた、ヒト抗体に特異的に結合する抗体(標的タンパク質に特異的に結合する、テストされるサンプルからの抗体に結合する「二次抗体」として使用される)を含みうる。そのような抗体は、検出可能な化合物、例えばフルオロフォア又は放射性化合物などで標識することができる。
好ましい実施形態において、本発明によるキットは、公知の量の抗体を含む対照サンプル、及び/又は潜伏形態のトキソプラズマ症を診断する際での、あるいは少なくとも1つの葉酸拮抗薬及び/又は抗生物質化合物で処置するのに適している潜伏形態のトキソプラズマ症に罹患している患者を選択する際での前記キットの使用のための説明書をさらに含みうる。
手段は、例えば、バイアル又はマイクロタイタープレート中に存在しうる、あるいは固体支持体に付着されうる。例えば、標的タンパク質は膜に又はアレイに付着させることができる。
本発明のさらなる目的は、ブラディゾイト嚢胞を検出する、及び/又は対象におけるその量を評価するための方法であって、前記方法は以下を含む:
a)対象の体液サンプル中で、請求項1から2のいずれかに記載のTゴンディポリペプチドに対する免疫反応性を検出すること;及び、任意選択的に
b)工程a)の結果から、ブラディゾイト嚢胞の存在及び/又は量を推定すること、本発明のTゴンディポリペプチドに対する免疫反応性は、前記対象におけるブラディゾイト嚢胞の存在及び/又は量を示している。
好ましい実施形態において、生物学的サンプルは、前記対象の体液である。そのようなサンプルの非限定的な例は、血液、血清、血漿、尿、唾液、ならびに脳脊髄液(CSF)及び房水を含むが、これらに限定されない。
より具体的には、体液サンプルは血清又は房水サンプルである。
本明細書で引用される全ての参考文献は、ジャーナルの文献又は要約、公開された特許出願、発行された特許又は他の参考文献を含み、参照により全体が本明細書において組み込まれ、引用された参考文献において提示されている全てのデータ、表、図、及びテキストを含む。
本発明を、以下の実施例及び図を考慮してさらに評価する。
図1.BCLAは、TgHDAC3により調節されるブラディゾイト特異的遺伝子である。(a)FR235222を用いたTgHDAC3阻害後のLC-MS/MSによる定量プロテオームワイド分析によって、BCLAの間でのブラディゾイト特異的タンパク質の発現が明らかになった。火山プロット(volcano plot)は、II型(PruΔku80)株で感染された、未処理(DMSO、0.1%)に対するFR235222処理(90nM)の初代ヒト線維芽細胞を比較したTゴンディタンパク質の分布を示す。タンパク質カウントについてのlog2比率(x軸)が、FR235222処理サンプルの強度をDMSO処理サンプル(コントロール)の強度で割ることにより得られた。下方及び上方調節されたタンパク質が、グラフの左側及び右側にそれぞれ赤色スポットで示されている。垂直の黒色線は、log2倍変化の値を示す。水平の黒色破線はタンパク質(赤色スポット)を区別し、p値<0.01を伴う少なくとも2倍の存在量の変化を示している。(b)マウスにおける、 Tゴンディ嚢胞(CZクローンH3)での経口感染後3日目から7日目 の種々ネコ腸上皮段階(EES)サンプル(EES1:非常に初期のEES;EES2:初期のEES;EES3:混合EES;EES4;後期EES;EES5:非常に後期EES)における、及びマウス脳からの嚢胞における、及びインビトロで培養されたタキゾイトにおける急性(タキゾイト)又は慢性(嚢胞に封入されたブラディゾイト)感染の間でのBCLA遺伝子の発現(100万のマッピングされた読み取り[FPKM]値当たりの転写産物のキロベース当たりのフラグメント)を示す棒グラフ。BCLAは、嚢胞に封入されたブラディゾイトの慢性段階の間でだけ発現され、EES1からEES5までのネコ腸上皮期(EES)においては見出されない(データソース:www.ToxoDB.org)。(c)Tゴンディの染色体Ib上のBCLA遺伝子座(マゼンタ)のゲノムブラウザー(IGB)スクリーンショットであって、2つのヒストンマーク(H3K14ac、H3K9me3)、TgHDAC3、TgCRC230ならびにRNA-seq(FPKMにおいて発現される、黒色)についての読み取りを示している。y軸は読み取り密度を描写する。この表示は、BCLA遺伝子でのH3K14ac、H3K9me3、TgHDAC3、及びTgCRC230の濃縮を示す。(d)左パネル:TgHDAC3のCRISPR媒介性の遺伝子破壊は、免疫蛍光アッセイによりモニターされた場合、TgHDAC3シグナル抑制に導く。右パネル: TgHDAC3のCRISPR媒介性の遺伝子破壊は、免疫蛍光アッセイによりモニターされた場合、BCLA過剰発現を誘発する。
図2.BCLAタンパク質は、非構造化タンデムリピートにより典型的に表される独特の構造を明らかにする。(a)タンパク質アミノ酸位置の関数としての障害スコアを示すチャート図(IUPredサーバーを介して生成)。ANCHOR2及びIUPred2アルゴリズムの結果をそれぞれ青色及び赤色で呈示する。BCLAのC末端ドメイン末端(残基1089から1275、以下rBCLAと呼ぶ)は、コア反復モチーフを含むタンパク質の残りとは対照的に、構造化されていると予測される。(b)II型(ME49)Tゴンディ株によりコードされるBCLAタンパク質は、その構造中で13の繰り返しを呈示する(TgR1からTgR13)。これらの繰り返しにおいて含まれる2つのペプチド(ペプチド1及び2)に対して向けられた自家抗体は、Eurogentec社により作製された。(c)2つのBCLA由来ペプチドに対して産生された自家製抗体を使用したウエスタンブロットによるBCLA発現モニタリングは、DMSO(コントロール)と比較し、FR235222処理後のBCLAの上方調節を示す。
図3.FR235222誘導時のBCLAは、液胞空間内に及び液胞の膜に存在する。(a)FR235222刺激に続く各々のPVにおけるBCLAの強度の定量化。各々の記号は、単一のPVのBCLA密度にマークを付ける。結果は、2つの独立した実験からの平均値±標準偏差として表される;定量化されたPVの数は少なくとも70であった。アスタリスクは、対応のない両側スチューデントのt検定(マンホイットニー検定)により決定された、各々の個々のFR235222処理株と対応するコントロール(DMSO、0.1%)を比較した場合での統計的有意性を示す(****p<0.0001;NS、有意ではない)。
図4.BCLA欠失は、インビトロでの寄生虫の成長又は液胞の形成及び成熟にも劇的に影響を及ぼさない。(a)WT株と比較した、インビトロで培養された76k-GFP-luc-ΔbclaタキゾイトのHFFにおける侵入のパーセンテージ(左パネル)及び細胞内増殖率(右パネル)の評価。HFF侵入の%は両方の株においてかなり似ているが、しかし、BCLAの欠失によって、細胞内増殖の30%減少が誘導される。結果を、2つの独立した実験からの平均値±標準偏差として表す。アスタリスクは、マンホイットニー検定(対応のない両側スチューデントのt検定)により76k-GFP-luc-Δbclaと76k-GFP-lucを比較した場合での統計的有意性を示す。**p<0.01;NS、有意ではない。
図5.BCLA欠失によって、タキゾイトで腹腔内感染されたマウスにおいてTゴンディの病原性又は嚢胞負荷は有意に変化しない。(a)Balb/cマウス及びNMRIマウスにおける76k-GFP-luc-Δbcla株とその親株76k-GFP-luc(WT)の病原性の比較。Balb/cマウス(n=20)及びNMRIマウス(n=43)を、それぞれ104及び106のタキゾイトでの腹腔内(i.p.)注射により接種し、生存を35日の間にモニターした。有意性を、ログ-ランク(Mantel-Cox)検定及びGehan-Breslow-Wilcoxon検定を使用してテストした。Δbclaタキゾイトで感染されたマウスは、WT株と同じ時間枠での感染に対して生存した(NS、有意ではない)。(b)脳血液関門を通じて移動し、Tゴンディで慢性的に感染されたマウスの脳においてTゴンディ嚢胞を形成する、WT株と比較した、Δbcla株の能力の評価。(a)において提示される、チャレンジに対して生存したNMRIマウス及びBalb/cマウスの脳を回収し、顕微鏡を使用して定量PCR±嚢胞数によりテストし、それぞれ寄生虫負荷及び嚢胞の数を評価した。結果を、少なくとも2つの独立した実験からの平均値±標準偏差として表す。統計的有意性を、対応のない両側スチューデントのt検定(マンホイットニー検定)によりテストした。Δbcla株で感染されたマウスは、寄生虫負荷及び脳における嚢胞の数の減少における傾向(しかし、有意ではない、NS)を示す。
図6.BCLA欠損嚢胞は、劇的な形態学的変化により典型的に表される。Δbclaブラディゾイト含有嚢胞の嚢胞形態を、親の76k-GFP-luc(WT)株からのものと比較した。図6aにおいて提示される、チャレンジに対して生存したNMRIマウスの脳を回収し、嚢胞を、パーコール勾配方法を使用して精製し、顕微鏡下で形態学的に特徴付けた。(a)嚢胞面積及び(b)Δbcla含有嚢胞嚢胞のGFP蛍光強度を、ZENソフトウェア(Zeiss)を使用して測定し、WT嚢胞で得られたものと比較した。Δbcla含有嚢胞は、WT嚢胞よりも有意なより低いサイズ及びより低いGFP強度を有する。結果を、少なくとも2つの独立した実験からの平均値±標準偏差として表す。アスタリスクは、対応のない両側スチューデントのt検定(マンホイットニー検定)により決定された、Δbcla含有嚢胞とWT嚢胞の嚢胞面積を比較した場合での統計的有意性を示す(***p<0.001)。スケールバー、10μm。
図7.BCLA欠失によって、嚢胞を経口摂取したマウスの感染力及び宿主の免疫応答は変化していない。76k-GFP-luc親株(WT)と比較した76k-GFP-luc-Δbcla含有嚢胞の病原性及び感染力の評価。C56BL/6マウス(n=6)及びNMRIマウス(n=20)を、それぞれΔbcla株又はWT株の46の嚢胞及び20の嚢胞で経口感染させた。回腸における急性応答が、感染後8日のC56BL/6マウスにおいて観察された。脳における慢性応答を、感染後8から10週のNMRIマウスにおいて評価した。(a)8日前に経口感染されたC56BL/6マウスの、qPCRにより定量化された回腸における寄生虫負荷。Δbcla株とWT株の間での統計的有意性を、対応のない両側スチューデントのt検定(マンホイットニー検定)によりテストした。有意差は観察されなかった(NS、有意ではない)。(b)8日前に経口感染されたC56BL/6マウスの回腸におけるサイトカイン(IFNγ、IL-22、IL-18、及びIL-1β)及びケモカイン(CCL2)のqRT-PCR分析。RNAレベルを、TBPレベルを使用して標準化した。平均値±標準偏差を示す。ΔbclaとWTの間での統計的有意性をマンホイットニー検定によりテストした。有意差は観察されなかった(NS、有意ではない)。(c)8~10週間前に経口感染されたNMRIマウスの脳を回収し、定量PCR及び顕微鏡を使用した嚢胞数によりテストし、それぞれ寄生虫負荷及び嚢胞の数を評価した。結果を、2つの独立した実験からの平均値±標準偏差として表す。ΔbclaとWTの間での統計的有意性をマンホイットニー検定によりテストした。有意差は観察されなかった(NS、有意ではない)。Δbcla株で感染されたマウスは、寄生虫負荷及び脳における嚢胞の数の減少における傾向(しかし、有意ではない、NS)を示す。(d)8~10週間前に経口感染されたNMRIマウスの脳におけるサイトカイン(TNF-α、IFNγ、IL-6、IL-22)のqRT-PCR分析。RNAレベルを、TBPレベルを使用して標準化した。平均値±標準偏差を示す。ΔbclaとWTの間での統計的有意性をマンホイットニー検定によりテストした。有意差は観察されなかった(NS、有意ではない)。
図8.rBCLAは、急性感染されたマウス血清と反応していない。単一のウエスタンブロットストリップに0.5μgの組換えrBCLAを負荷した。ストリップを、種々のTゴンディ株、感染の経路、及びマウスの遺伝的背景を伴うトキソプラズマ症の急性期におけるマウスから収集された血清でテストした。rBCLAは、感染の急性期(7~8日)の間にマウス抗体と反応していない。(a)7日間にわたるCOUG株及びCOUG-Δmyr1(非定型ハプロタイプ11)株の104タキゾイトの腹腔内注射(i.p.)により感染されたNMRIマウスからの血清でのイムノブロット。血清はrBCLAと反応していない。(b)7日間にわたるRH(I型)株の103タキゾイトでのi.p.により感染されたCBAマウスからの血清でのイムノブロット。血清はrBCLAと反応していない。(c)8日間にわたる76k-GFP-luc株又は76k-GFP-luc-Δbcla(II型)株の47の嚢胞での経口経路により感染されたC57BL/6マウスからの血清でのイムノブロット。血清はrBCLAと反応していない。
図9.rBCLAは、マウスモデルにおけるTゴンディ慢性感染の血清マーカーである。単一のウエスタンブロットストリップに0.5μgのrBCLAを負荷し、トキソプラズマ症の亜慢性期(21~41日)又は慢性期(>42日)におけるマウスから収集された血清でテストした。rBCLAは、II型嚢胞形成株(PruA7、ME49、又は76k-GFP-luc)による感染に続く亜慢性又は慢性トキソプラズマ症を伴うマウスの抗TゴンディIgG抗体とだけ反応する。(a)42日間にPruA7(II型)株の103~106タキゾイト/マウスでのi.p.により感染されたBalb/cマウスからの血清でのイムノブロット。血清は、タキゾイト負荷に従って、rBCLAとかなり比例的に反応している。(b)80日間にME49(II型)株の106タキゾイト/マウスでのi.p.により感染されたCBAマウスからの血清でのイムノブロット。血清はrBCLAと強く反応している。(c)22ヶ月間に76k-GFP-luc(II型)株の20の嚢胞で経口感染されたNMRIマウスからの血清でのイムノブロット。血清はrBCLAと強く反応している。(d)21日間に76k-GFP-luc株又は76k-GFP-luc-Δbcla(II型)株の106タキゾイト/マウスのでi.p.により感染されたBalb/cマウスからの血清でのイムノブロット。76k-GFP-lucで感染されたマウスからの血清は、rBCLAと強く反応しているのに対し、76k-GFP-luc-Δbclaで感染されたマウスの血清は、rBCLAとほとんど反応していない。(e)22日間、RH(I型)株の103タキゾイト/マウスでのi.p.により感染され、ピリメタミン(PYR)又はスルファジアジン(スルファ)処置が続いたCBAマウスからの血清でのイムノブロット。血清はrBCLAと非常にわずかに反応している。(f、g)42日間、(f)106タキゾイト/マウスでのi.p.により、CTG(II型I)株又は(g)PruΔku80(II型)株でのi.p.により感染されたNMRIマウスからの血清でのイムノブロット。血清はrBCLAと反応していない。(h)42日間に76k-GFP-luc(II型)株の105タキゾイト/マウスでのi.p.、燃、又はコルチコステロイド処置を使用しないことにより感染されたBalb/cマウスからの血清でのイムノブロット。全ての血清がrBCLAと強く反応している。
図10.rBCLAのタンパク質分解分析によって、BCLAの最小抗原領域の境界が明らかになる。(a)SDS PAGEによるタンパク質分解反応の分析。すべてのプロテアーゼ(トリプシン、キモトリプシン、エラスターゼ、及びパパイン)の投入サンプル及び全てのこれらの時間点(10、20、及び50分)を示すクーマシー着色SDS PAGE。(b)陽性のマウス血清とインキュベートされ、抗マウスIgG抗体により明らかにされたブロットゲル。(c)ペルオキシダーゼに結合された抗6his IgGとインキュベートされたブロットゲル。黒色矢印は、非分解rBCLAを示す。赤色及び青色カーソル矢印は、N末端分解が再発することを示し、rBCLAがキモトリプシンにより急速に分解され、エラスターゼ、トリプシン、及びパパインにより部分的に分解され、17kDaマーカーの周囲に安定なフラグメントを生成することを示している。
図11.ヒトにおける血清マーカーとしてのrBCLAの評価。単一のウエスタンブロットストリップに0.5μgのrBCLAを負荷し、ヒトから単離された株で感染されたマウス血清で又は直接的にヒトの血清でテストした。(a)疑われる(臨床的に疑われるが、しかし、羊水又は胎盤ではTゴンディPCR陰性)又は確認された(羊水ではTゴンディPCR陽性)先天性トキソプラズマ症を伴う女性からの羊水又は胎盤でi.p.感染されているSwissマウスからの血清でのイムノブロット。陽性の羊水で感染されたマウスからの血清は、rBCLAと強く反応している。(b)トキソプラズマ症感染を伴う、又は伴わないヒト患者からの血清(S)又は房水(HA)でのイムノブロット。ヒト血清及び房水を、Grenoble Alpes University HospitalのParasitology-Mycology Clinical Laboratoryのバイオバンクより無作為に選択した。各々のサンプルについて、トキソプラズマ血清アッセイを、Vidas(登録商標)(bioMerieux)及びArchitect(登録商標)(Abbott))システム(両方ともELISA由来の技術に基づく)を使用して実施し、臨床状態を、各々の患者の医療記録を使用して評価した。注目すべきことに、Vidas(登録商標)はrSAG1抗原に、Architect(登録商標)はrSAG1及びrGRA8抗原に基づく。rBCLAで得られた血清学的結果を、各々の患者の血清学的及び臨床的状態と比較し、それらが特定のTゴンディの血清学的及び/又は臨床的状態と相関しているか否かを評価した。(α)証明された又は疑われる眼トキソプラズマ症を伴う患者の血清、(β)造血系疾患(免疫抑制)の間でのトキソプラズマ症の再燃、及び(γ)最近の一次感染(1~2ヶ月の間)がrBCLAと反応している。(δ)「過去の免疫」として認定された3名の血清陽性患者からの血清及びかなり最近の感染(2.5ヶ月)からの1つの血清は、rBCLAと反応していない。(ζ)血清反応陰性の患者からテストされた全ての血清はrBCLAと反応しておらず、ヒトにおけるこの抗原の良好な特異性を示している。
図12|ヒトの血清マーカーとしてのBCLAの評価。(a)、リピートn°4及びrBCLA領域の両方におけるエピトープマッピング領域の概略図。ペプチドカバレージを、ペプチド配列の上又は下の個々の15aaペプチドを表す線として呈示し、部分的なナンバリングを呈示している。有意な又は強い反応性を呈示する領域を、それぞれ実線又は破線のボックスにおいて強調表示し、各々の個々のペプチドフラグメントを(*又は**)でマークしている。(b)、BCLA陽性血清のエピトープマッピング。以下は、コアリピート領域及びrBCLA領域の両方でのペプチドの相対反応性を呈示するヒストグラムであって、負のバックグラウンド減算を伴う5つの異なる正のブロットを使用して算出される。上は、番号が付けられたペプチドを用いたドットブロットメンブレンの明かにされたパターンの例であって、陽性ヒト血清で実施されている。(c)、ペプチドのナンバリング及び領域がカバーされた5つの陽性血清及び1つの陰性血清についてのペプチドドットブロット。右側では、rBCLA及びSAG1(Architect)についてのELISA滴定をこれらの同じ血清について示している。
図13.ヒト血清におけるBCLA反応性。古典的なSAG1血清(Vidas and Architect IgG/IgM)及び他の医学的前提条件を通じて評価された臨床状態カテゴリー内にグループ化された個々のBCLA ELISA滴定(UI)のスキャッタープロット。これらの群は以下の通りである:SAG1血清陰性患者(青色点)、過去の免疫患者(ひしがた)、免疫不全患者(立方体)における活動性トキソプラズマ、免疫不全患者(三角形)及び証明された眼トキソプラズマ症患者(立方体)における無症候性血清学的再燃。ヒストグラムによって、群当たりのBCLA滴定値の中央値及び四分位範囲が呈示される。統計的有意性を、クラスカル・ウォリスのノンパラメトリック検定、それに続くダンの事後検定を使用して算出し、全ての後者の群を血清陰性の患者の群と個別に比較した。灰色ゾーン(70から90UI)及び陽性カットオフライン(90UI)を示す。
図14.rBCLA免疫原性は、マウスにおける感染の慢性段階での嚢胞形成株と相関する。(a)経時的に及びTゴンディ株に依存した、マウスにおけるrBCLA反応性のELISA血清滴定。UIにおいて与えられる個々のELISA測定値を、Tゴンディ株型に従ってグループ化し、嚢胞形成株(ME49、PruA7、76K)をスポットで示し、非嚢胞形成株(RH、PruKU80、CTG)を星形で、ΔBCLA株(76K又はPruKU80のバックグラウンド中)を三角形で示す。感染後の時間区分を呈示して、急性期(≦8日)、亜慢性期(21~22日)、及び慢性期(≧42日)を区別する。(b)、寄生虫負荷、miR-155及びmiR-146a発現とのrBCLA ELISA反応性の相関。rBCLA IgG(UI)、寄生虫負荷(寄生虫qPRCカウント)、及びmiR-155/miR-142-aの重ね合わせ滴定を、異なるTゴンディ株で感染されていない、又は感染されている(全てが慢性感染時間枠内(≧11週間))異なるマウス系統(NMRI、Balb-C)について示す。嚢胞形成株(ME49、PruA7、76K)を円で示し、非嚢胞形成株(RH、PruKU80、CTG)を星形で示し、ΔBCLA株(76K又はPruKU80バックグラウンド中)を三角形で示す。
図15:先天性トキソプラズマ症のリスクがある母親及び新生児の血清におけるBCLA反応性。(A-B)出産時(母親)又は出生から5.5ヶ月(乳児)の間に収集された23名の母親及びそれぞれの新生児の血清におけるBCLA ELISA滴定のバイオリンプロット(UI)。(C-D)Sag1滴定(Vidas(登録商標)及びArchitect(登録商標)IgG/IgM)のバイオリンプロット。血清を、先天性トキソプラズマ症を伴わない「母親-新生児」の組(A及びC)及び確認された先天性トキソプラズマ症を伴う組(B及びD)の臨床状態カテゴリー内に分類した。各々のパネルの上部で、平均値±SDの値を表している一方で、中央値の間の差をマンホイットニー検定で算出した。
実施例1:
材料及び方法
宿主細胞及び寄生虫の培養。HFF初代細胞(Bougdour et al., 2009)、RAW264.7細胞、L929細胞、HCT116細胞、A549細胞、及びHEK293細胞を、10%熱不活化ウシ胎児血清(FBS)(Invitrogen)、10mM(4-(2-ヒドロキシエチル)-1-ピペラジンエタンスルホン酸)(HEPES)緩衝液pH 7.2、2mM L-グルタミン、ならびに50μg/mlのペニシリン及びストレプトマイシン(Thermo Fisher Scientific)を添加したダルベッコ改変イーグル培地(DMEM)(Thermo fischer Scientific、フランス)中で培養した。細胞を5%CO2中37℃でインキュベートした。以下のトキソプラズマ菌株を本試験において使用した:I型(RH、GT1)、II型(ME49)、III型(CTG)、非定型(COUG)、ネオスポラ・カニナム(Neospora caninum);RHΔku80(Huynh and Carruthers, 2009)、PruΔku80(Fox et al., 2011)、PruA7(Saeij et al., 2007)、COUGΔmyr1(Hakimi、未発表)、PruΔku80Δbcla、PruΔku80-HF-BCLA及び76k-GFP-luc-Δbcla(本試験において得られた)。全ての寄生虫株を、HFFの単層上での連続継代によりインビトロで維持した。
Tゴンディのトランスフェクション。TゴンディRHΔku80、PruΔku80、及び76k-GFP-lucを、BTX ECM 630マシーン(Harvard装置)を使用し、cytomix緩衝液(120mM KCl、0.15mM CaCl2、10mM K2HPO4/KH2PO4、pH 7.6、25mM HEPES pH 7.6、2mM EGTA、5mM MgCl2)中でベクターを用いてエレクトロポレーションした。エレクトロポレーションは、2mmキュベット中で、1.100V、25Ω、及び25μFで実施した。安定したトランスジェニック寄生虫を1μMピリメタミンで選択し、限界希釈により96ウェルプレート中でシングルクローニングし、蛍光抗体法により検証した。
TゴンディにおけるCas9媒介性のC末端タグ付け及び遺伝子破壊。プラスミドpTOXO_Cas9-CRISPRは(Sangare et al., 2016)により記載された。目的の遺伝子(GOI)は、CRISPR/Cas9システムを使用したC末端タグ付け(HA-Flag(HF))及び遺伝子破壊(KO)の両方についてBCLA(TGME49_209755)であった。BCLAに対応する4つのオリゴヌクレオチドを、Golden戦略を使用してクローン化した。簡単には、TgBCLAゲノム配列を標的化するsgRNAを含むプライマーTgBCLA-CRISP_FWD及びTgBCLA-CRISP_REVをリン酸化し、アニーリングし、Bsalを用いて、線形化されたpTOXO_Cas9-CRISPプラスミド中にライゲーションし、pTOXO_Cas-CRISPR::sgTgBCLAに導いた。Tゴンディタキゾイトを次に、プラスミドを用いてトランスフェクトし、HFF細胞上で18~36時間増殖させた。
本試験において使用されたクローニングオリゴヌクレオチドは以下である:
TgBCLA-KO-CRISP-FWD:5’-AAGTTGATCACTATTCGTGAAGAAGG-3’(配列番号28)
TgBCLA-KO-CRISP-REV:5’-AAAACCTTCTTCACGAATAGTGATCA-3’(配列番号29)
TgBCLA-HF-CRISP-FWD:5’-AAGTTGGAACGGCGGTACGGCGACCG-3’(配列番号30)
TgBCLA-HF-CRISP-REV:5’-AAAACGGTCGCCGTACCGCCGTTCCA-3’(配列番号31)
FR235222処置及び誘導。FR235222はアステラス製薬株式会社(日本、大阪)により提供され、Bougdour et al., 2009により記載される通りにDMSO中に溶解させ、培地中の最終濃度は25ng/mL又は50ng/mLのいずれかであった。FR235222を含む培地を、感染後16時間に、24時間から7日間感染HFF細胞に加えた。
マウス及び実験的感染。6週齢のBALBC/c、CBA、NMRI、又はSwissマウスをJanvier Laboratories(Le Genest-Saint-Isle、フランス)より得た。マウスの世話及び実験手順を、確立された施設のガイダンス及びUniversity Grenoble AlpesのInstitutional Animal Care and Use Committeeからの承認済みプロトコル(合意番号B3851610006)に従って、病原体のない条件下で実施した。雌マウスを全ての試験について使用した。腹腔内(i.p.)感染のために、タキゾイトをインビトロで増殖させ、27ゲージ針を通した通過により宿主細胞から抽出し、PBS中で3回洗浄し、血球計算器で定量化した。寄生虫をハンクス平衡塩類溶液(Life)中で希釈し、マウスに、28ゲージ針を使用し、各々の株のタキゾイト(200μl中)を用いてi.p.経路により接種した。感染性嚢胞の経口強制投与のために、慢性的に感染されたマウス(76k-GFP-luc及び76k-GFP-luc-Δbcla)からの脳をPBS中で粉砕し、嚢胞の数を顕微鏡的に定量化し、マウスに、先端が球状の給餌針を使用して、20から40の嚢胞を含む100μlの脳ホモジネートを強制的に与えた。血液を、マウスを安楽死させた際に、尾側穿刺により又は心臓内穿刺により収集した。動物の安楽死は、承認されたCO2チャンバーにおいて完了した。回腸の組織学的分析及び脳の組織学的切片での免疫標識のために、又は、回腸及び脳をマウスから除去し、パラフィンワックスブロック中に完全に包埋し、ミクロトームを使用して厚さ5μmの層に切断した。マウス生存データの統計分析のために、Mantel-Cox及びGehan-Breslow-Wilcoxon検定を使用した。
嚢胞の精製。嚢胞を、76k-GFP-luc株又は76k-GFP-luc-Δbcla株に少なくとも6週間慢性的に感染されたマウスの脳から、以前に記載されたPercoll勾配方法(Cornelissen et al., 1981)を使用し、透過性試験のために嚢胞壁を変質させないために、染料実験のために10μlのピペットを使用して嚢胞により直接的に単離した。サポニンもトリプシンも実験の終了時に加えなかった。
嚢胞の定量化。感染後5から12週間で、レシピエントマウスの各々の脳を2mlのPBS中でホモジナイズした。脳懸濁液の3つ又は10のアリコート(各々20μl)中での嚢胞の数を顕微鏡的に数えた。嚢胞の総数を、20μlのアリコート中で嚢胞を数え上げて、100を掛けることにより決定された。76k-GFP-luc及び76k-GFP-luc-Δbclaで感染されたマウスの間での嚢胞の定量化の差の統計分析のために、ノンパラメトリックWilcoxon-Mann-Whitney検定を使用した。
嚢胞の特徴付け。精製された嚢胞の画像を、蛍光ZEISS ApoTome.2顕微鏡を用いてスライドとスリップカバーの間で取得した。嚢胞面積及びGFP強度を、ZENソフトウェア(Zeiss)を使用して測定した。嚢胞面積及び76k-GFP-lucと76k-GFP-luc-Δbcla嚢胞の間でのGFP強度の差の統計分析のために、ノンパラメトリックWilcoxon-Mann-Whitney検定を使用した。
定量PCR。脳又は回腸における寄生虫負荷を、トキソプラズマ特異的529bpリピートエレメントの定量PCRターゲティングを使用し、DNA抽出(QiAmp DNAミニキット、Qiagen)に続いて定量化した(Reischl et al., 2003)。76k-GFP-luc及び76k-GFP-luc-Δbclaで感染されたマウスの間での寄生虫負荷の差の統計分析のために、ノンパラメトリックWilcoxon-Mann-Whitney検定を使用した。
脳及び回腸におけるインターロイキンのqRT-PCR分析。全RNAを、TRIzol(Thermo Fisher Scientific)を使用して脳又は回腸から単離した。cDNAを、高容量RNA-to-cDNAキット(Applied Biosystems)を使用することにより、ランダムヘキサマーで合成した。サンプルを、TaqMan Gene Expression Master Mix(Applied Biosystems)を使用し、適切なプローブ(脳:TNF-α、INF-γ、IL-6、IL-22β;回腸:INF-γ、CCL2、IL-22β、IL-18、及びIL-1β)についてのリアルタイム定量PCRにより分析した。RNAレベルを、TBPレベルを使用して標準化した。qRT-PCRを、各々のサンプルの3つの独立した生物学的複製物について繰り返し、結果の平均値を使用した。76k-GFP-luc及び76k-GFP-luc-Δbclaで感染されたマウスの間でのRNAレベルの統計分析のために、ノンパラメトリックWilcoxon-Mann-Whitney検定を使用した。
免疫蛍光顕微鏡。インビトロの寄生虫での免疫蛍光アッセイを、以前に記載された通りに実施した(Braun et al., 2013)。簡単には、カバースリップ又はマウスの脳から精製された嚢胞上で増殖されたTゴンディ感染HFF細胞を、3%ホルムアルデヒド中で、室温で20分間固定し、0.1%(v/v)TritonX-100で15分間にわたり透過性にし、3%(v/v)ウシ血清アルブミン(BSA)を含むリン酸緩衝生理食塩水(PBS)中でブロックした。脳の組織切片上での免疫標識のために、スライドガラス上にスポットされた脳層を最初に、トルエンを3*10分間、無水アルコールを3*10分間使用して溶媒脱脂した。スライドを次に、クエン酸緩衝液pH 6で処理し、100℃で1時間加熱し、水で2*10分間リンスし、3%(v/v)ウシ血清アルブミン(BSA)を含むPBS中でブロックした。細胞又は脳層を次に、図中に示す一次抗体と1時間インキュベートし、次にAlexa Fluor 488又は594(Molecular Probes)にコンジュゲートされた1:1,000希釈の二次抗体を1時間添加された。宿主細胞及び寄生虫の両方の核を、PBS中の2μg/mlのHoechst33258を用いて、室温で10分間染色した。カバーガラスを、Mowiol封入剤を用いてスライドガラス上に封入し、画像を、蛍光ZEISS ApoTome.2顕微鏡を用いて取得し、画像をZENソフトウェア(Zeiss)により処理した。
抗体。一次抗体:ウサギ抗BCLA(Eurogentec)、マウス抗HA(Roche、RRID:ab_2314622)、ラット抗flag(SIGMA)、マウス抗CC2(Pr. Louis Weissからの寄贈)、マウス抗GRA1、マウス抗GRA5、マウス抗GRA7。ウエスタンブロット二次抗体をアルカリホスファターゼ(Promega)にコンジュゲートしたのに対し、免疫蛍光二次抗体をAlexa Fluor488又はAlexa Fluor494(Thermo Fisher Scientific)に結合させた。
ウエスタンブロット。タンパク質をSDS-PAGEにより分離し、ポリフッ化ビニリデンメンブレン(Immobilon-P;EMP Millipore)に液体トランスファーによりトランスファーし、ウエスタンブロットを、適切な一次抗体、続いてホスファターゼコンジュゲートヤギ二次抗体(Promega)を使用してプローブ化した。シグナルを、NBT-BCIP(Amresco)を使用して検出した。
インビトロFR235222寄生虫及びエクスビボ嚢胞でのDBAレクチン標識。カバースリップ上で増殖されたTゴンディ感染HFF細胞又はマウスの脳から精製された嚢胞を、3%ホルムアルデヒド中で、室温で20分間固定し、0.1%(v/v)Triton X-100で15分間透過性にし、3%(v/v)ウシ血清アルブミン(BSA)を含むリン酸緩衝生理食塩水(PBS)中でブロックした。感染された細胞又は嚢胞を、1:100に希釈されたDolichosレクチンで30分間染色した。染色された液胞又は嚢胞を蛍光ZEISS ApoTome.2顕微鏡で調べて、画像をZENソフトウェア(Zeiss)により処理した。
嚢胞壁の透過性。マウスの脳から精製された76k-GFP-luc及び76k-GFP-luc-Δbcla単離嚢胞を、1:100希釈の、異なるサイズの異なる色素(デキストラン、テキサスレッド、又はカスケードブルー、3000から40 000Da、中性又はアニオン性リジン固定可能)(Promega)とインキュベートした。室温での20分間のインキュベート後、画像を、蛍光ZEISS ApoTome.2顕微鏡を用いて取得し、画像をZENソフトウェア(Zeiss)により処理した。最低5つの嚢胞を各々の異なる色素について分析した。色素の非存在においてインキュベートされた嚢胞を、陰性コントロールとして利用した。
BCLAのC末端ドメインの組換え発現(Cter-BCLA)。
デザイン及びクローニング。障害傾向検索(Dis-EMBL又はIUPredを使用)によって、コア反復モチーフを含むその配列の大半全体を通じてBCLAが高度に無秩序であると予測される。しかし、C末端(およそaa 1100から1275)は、構造化されているとして予測され、別々のドメインを構成しうる。このドメインを組換え発現させるために、N末端境界はメチオニン1089で選び、本来のC末端は保存された。DNA合成をGenscriptにより実施し、TEV切断可能なN末端Hisタグを伴うCter-BCLA(1089-1275)で構成される融合コンストラクトを生成した(図1b)。大腸菌についてのコドン最適化を実施し、遺伝子を、NdeI部位及びXhoI部位を使用してpet30-(a)ベクター(Addgene)内でGenscriptによりクローン化した。
組換え発現。形質転換を、BL21(DE3)-CodonPlus-RIL化学的コンピテント大腸菌(Stratagene)を使用して実施し、1μgのpet30-(a)Cter-BCLAプラスミドと氷上で10分間インキュベートし、42℃で45分間ヒートショックを与え、37℃のLB中で45分間プレインキュベートし、次にカナマイシン(Kan)及びクロラムフェニコール(Chlo)を含むLB寒天プレート上に広げ、12時間インキュベートした。単一のコロニーを次に選び、16時間増殖させたLB/Kan/Chlo 50ml前培養物に接種した。次に、増殖した前培養物の5mlを使用し、Chlo/Kanを含むTerrific Broth培地(Formedium)の1Lフラスコに接種した。培養物を、OD600が0.5~0.8に達するまで37℃で増殖させ、次に0.7mM IPTG(VWR)を加えることにより誘導し、さらに18℃で一晩インキュベートした。インキュベーション後、細胞を3000Gで25分間遠心分離し、上清を捨てて、ペレットを液体窒素中で急速冷凍し、-80℃に保った。
溶解。精製を1L培養物の3つのペレットで実施し、各々を、600mM NaCl、50mM Tris pH 8、5mMベータメルカプトエタノール(BME)、0.2%w /vN-ラウリルサルコジン、及び1 Complete抗プロテアーゼカクテル(Roche)タブ/50mlを含む50mlの溶解緩衝液中に再懸濁した。溶解を、氷上で50°振幅で10のミニパルス超音波処理(15秒ON、30秒OFF)を使用して実施し、ライセートは13℃を超える温度に達することは決してなかった。超音波処理後、ライセートを4℃で1時間、15,000Gで遠心分離し、ペレットを捨てた。全ての以下の工程は4℃で実施された。5mLの事前に平衡化されたNi-NTA樹脂とのインキュベーションの前に、清澄化されたライセートに30mMイミダゾールを添加した。バッチインキュベーションを、穏やかな撹拌を伴って、4℃で30分間実施した。インキュベーション後、樹脂を垂直カラム上に保持し、次に600mM NaCl、50mM Tris pH 8、5mM BME、0.2%w/vN-ラウリルサルコシン、及び30mMイミダゾールを含む3*20mlの洗浄緩衝液で洗浄した。1.5ml分画を用いた直接的な溶出を次に、300mM NaCl、50mM Tris pH 8、5mM BME、及び300mMイミダゾールを含む緩衝液を使用して実施した。目的の画分(図8)を次にプールし、10KDaカットオフ透析カセット(Thermo Scientific)を使用し、50mM NaCl、50mM Tris pH 8、5mM BME中で透析した。
イオン交換及びサイズ排除クロマトグラフィー。サンプル全体を次に、クロマトグラフィーシステム(Akta Pure、GE Healthcare)を通じて、透析用と同じ緩衝液で事前に平衡化されたHL-Mono-Q(GE Healthcare)5mlカラム上に直接的にポンピングした。カラムを2カラム容量(CV)で洗浄し、次に塩勾配(50mMから2M NaCl)により40ml以上、1.5mlの画分で溶出し、280nmの吸光度モニタリングを溶出の全体について実施した。溶出の間に、SDS PAGE分析(図3)は、サンプルが勾配溶出の後の段階において精製されること、及び初期の溶出画分が、より高い分子量で目に見える細菌混入物の大半を提示することを明らかにしている。所望の画分を収集し、プールし、10KDaカットオフ濃縮器(Amicon-Ultra、Millipore)を使用して600μlに濃縮した。濃縮後、サンプルを、S75(GE Healthcare)上に、150mM NaCl、50mM Tris pH 8、5mM BMEを含む泳動緩衝液を用いて注入し、多量体状態と一致する不均一なピーク中に溶出し、ボイド容量の近くから開始して3ml以上溶出した。全ての溶出画分をプールし、最終サンプルを生成した。
硫酸アンモニウム沈殿。核酸混入を避けるために、アンモニウム沈殿を、15%w/vの硫酸アンモニウム(Sigma)を加えること、4℃で1時間の穏やかな回転、次に10000*Gでの30分間の遠心分離により実施した。上清を捨てて、ペレットを同じ初期量の緩衝液中に再懸濁した。全ての硫酸アンモニウムを除去するために、サンプルを、サイズ排除用と同じ緩衝液中で透析した。
Cter-BCLA内の抗原性サブフラグメントを見出すための限定的なタンパク質分解。Cter-BCLAの高度に抗原性であるサブフラグメントを回収するために、精製されたサンプルでの限定的なタンパク質分解を、トリプシン、キモトリプシン、エラスターゼ、及びパパイン(全てがSigma Aldrich)を使用して試みた。反応は、50mM Tris pH 8.0、150mM NaCl、5mM BME、及び0.5mM MgCl2中の30μlの反応容量中で行った。各々の反応において、3μgのCter-BCLAを、100ngのプロテアーゼ(1/30 w/w)により37℃で50分間の経過にわたり消化した。反応を、10μlのSDS PAGEローディング緩衝液の添加、それに続く95℃で5分間の加熱により各々の時間点で停止させ、次にゲル上にローディングするまで氷上に保った。
ウエスタンブロットBCLA血清テスト。シングルウエスタンブロットストリップを、0.1mg/mlの5μlのサンプルをロードした15ウェルの4~12%NuPageゲル(Life Technologies)を使用して調製した。ゲルを、MES緩衝液中で、185vで40分間泳動し、次にPVDFメンブレン上で、105vで1.5時間エレクトロトランスファーした。トランスファーされたレーンを次に、個別化されたストリップに切り出した。ストリップを次に、5%粉乳(w/v)を伴うTTBS中で1時間ブロックした。血清テストを次に、血清の1/400の希釈を伴うTTBS中で、4℃で1時間実施した。ストリップを次に、TTBS中で3回洗浄し、マウスIgG又はヒトIgGのいずれかを標的化し、ホスファターゼアルカリ酵素(Promega)と結合された、1/7500希釈の2次抗体を用いてさらに1時間インキュベートした。3回のTTBS洗浄に続いて、ブロットを、RTで発色基質(Invitrogen)の添加により明らかにした。陽性血清におけるバンドは1から5分以内に現れる。血清テストと並行して、単一のストリップを、各々のブロットセットについて内部抗原コントロールとして常に使用した。ブロッキング後、このストリップを、TTBS中で1/2000希釈されたペルオキシダーゼ結合抗ポリヒスチジンモノクローナル抗体(Sigma)と1時間インキュベートした。TTBS中での3回洗浄後、ブロットを、金属エンハンサーを伴うSigmaFast DAB(Sigma)を使用して明らかにした。i.p.又は経口感染されたマウスの各々のシリーズについて、少なくとも各々のシリーズのマウスの血清を、市販キットLD bioトキソプラズママウスIgG(LD bio)を使用したIgG免疫応答のウエスタンブロット分析を使用し、BCLAについて以前に記載された同じ抗マウスIgG-アルカリホスファターゼコンジュゲート及び発色基質を用いて、トキソプラズマ抗体についてチェックした。
ヒト血清。ヒト血清を、フランスのGrenoble Alpes University HospitalにおけるParasitology-Mycology Clinical Laboratoryのバイオバンクコレクションから遡及的に選択した。このバイオバンクは、フランス保健省番号DC-2008-582で登録されている。選択された血清は、2014年1月1日から2018年5月1日の間にトキソプラズマ症血清ルーチン分析のために保存された。Vidas(登録商標)Toxo IgM及びIgG(bioMerieux、フランス)ならびにArchitect Toxo IgG及びIgM(Abbott、ドイツ)を用いた分析が、Grenoble Alpes University HospitalのParasitology- Mycology Clinical Laboratoryにおいて実施された。
タンパク質精製、イムノブロッティング、及び質量分析に基づくプロテオミクス分析。Flagタグ付きタンパク質を含むPruΔku80-BCLA-HAFlag感染宿主HFF細胞抽出物を、抗FLAG M2アフィニティーゲル(Sigma-Aldrich)と4℃で1時間インキュベートした。ビーズを、10カラム容量のBC500緩衝液(20%グリセロール、20mM Tris-HCl pH 8.0、500mM KCl、0.05%NP-40、100mM PMSF(フェニルメチルスルホニルフルオリド)、0.5mM DTT、及び1×プロテアーゼ阻害剤)で洗浄した。結合したペプチドを、BC100緩衝液中で希釈された250g/ml FLAGペプチド(Sigma-Aldrich)で段階的に溶出した。タンパク質バンドをコロイド青色染色ゲル(Thermo Fisher Scientific)から切り出し、修飾トリプシン(Sequencing grade;Promega)を使用したゲル内消化の前に、DTT及びヨードアセトアミドで処理してシステインをアルキル化した。個々のバンドからの結果として生じたペプチドを、25分勾配を使用してオンラインnanoLC-MS/MS(LTQ-Orbitrap Velos Proに結合されたUltiMate3000;Thermo Fisher Scientific)により分析した。ペプチド及びタンパク質を、MaxQuant(バージョン1.5.3.17)を使用し、ToxoDB(20151112バージョン)に対する同時検索、及びMaxQuant中に埋め込まれた頻繁に観察される混入物データベースを通じて同定及び定量化した。最小ペプチド長を7アミノ酸に設定した。ペプチドの最小数、razor+固有ペプチド、及び固有ペプチドを全て1に設定した。最大誤検出率をペプチド及びタンパク質レベルで0.01に設定した。
BCLAリピート及びrBCLAのエピトープマッピング。ドットブロットペプチドアッセイを、N末端上にN-アセチル部分を伴うセルロース膜上でJPTペプチド技術によりカスタム合成した。2セットのメンブレンをスクリーニングした:1)rBCLA領域(res 1089-1275)を合計59のペプチドでカバーし、各々が15 aaの長さであり、12のオーバーラップ及び3のオフセットを伴う;2)リピート4(res 446-493)を合計18のペプチドでカバーし、各々が15 aaの長さであり、12のオーバーラップ及び3のオフセットを伴う。ドットブロットアッセイを、製造者により記載されるように実施した。簡単には、メンブレンを最初に100%エタノール中で5分間活性化し、次にDPBS-tween中で3回3分間洗浄した。DPBS-Tween 0.5%粉乳中で、4℃で一晩ブロックし、次にDPBS-tween中で3*3分間再度洗浄した。テストされた血清をDPBS-tween 0.1%BSA中で1/400に希釈し、メンブレンと室温で3時間インキュベートした。3*3分間のDPBS-tween洗浄に続き、メンブレンを、1/100 000に希釈した抗IgGペルオキシダーゼ結合Ab(Sigma A0170)とRTで2時間インキュベートした。DPBS-tween中での3*3分間の洗浄に続き、メンブレンを、新たに調製されたSuperSignal West Pico Chemiluminescent Substrate(ThermoFisher)中に短時間浸し、C-Digit(Licor)スキャナーを使用して明らかにした。ドット強度を、ImageJを使用して統合した。ドット強度を、ImageJを使用して統合した。独立したドットブロットのデータ分析のために、すべてのペプチドドット[I(p)]からの統合強度を、任意の血清と決して反応しない、ペプチド59 [I(p = 59)]のベースライン統合強度を使用して濃縮係数Fe(p)に標準化した。以下を、以下の等式を用いて表現することができる:
式中、pはペプチド番号を表す。
(+)として記号で表されるいくつかの独立した陽性血清ブロットにわたり反応性スコアを増加させるために、Fe(p)濃縮スコアを互いに合計し、非特異的反応性を減算するために、同じ合計を同じ数の陰性血清ペプチドで実施し、(-)として記号で表し、減算した。ペプチド反応性スコアを以下の等式を通じて表現することができる:
式中、Rs(p)は特定のペプチド位置での合計反応性スコアである。
BCLA ELISA。ペプチド合成:以下のBCLAペプチドを、N末端アセチル基を伴うGenscriptにより合成した:
AB_F:Nter-MERPAAGSMEKEKPVLPGEGEGLPKHETKPALTDEKRTKPGGP-Cter(配列番号55)
A3_B:Nter-AAGSMEKDKLVLPGE-Cter(配列番号56)
プレート調製:Midisorpプレート(Nunc)を、100mM炭酸カルシウム緩衝液pH:9.6(100μl/ウェル)中のrBCLA、ペプチドAB_F及びA3_B(全て2μg/ml)でコーティングした。コーティング後、プレートを350μlのDPBS 0.05%Tween 20(DPBS/Tween)で2回洗浄し、次に300μlのSuperblockブロッキング緩衝液(ThermoFisher)で少なくとも2時間ブロックし、その後、緩衝液を除去し、プレートを逆さまで乾燥させた。一度、乾燥させたら、プレートを、血清反応性の喪失を伴うことなく、4℃で長期間にわたり保存することができる。
サンプル調製:全ての血清希釈液を、アッセイの前の2時間以内にDPBS 0.05%Tween 20、0.1%BSA中で調製した。マウス及びヒトのテストされた血清の両方について、1/400希釈液を調製した。また、11の標準を両方のテストにおいて新たに調製し、100UIに設定された陽性凍結ストック血清の10段階希釈液からなった。1/200の希釈で開始し、3/4の希釈増分に続き、以下の滴定点を調製した:200UI(1/200)、150UI(1/266)、112.5UI(1/356)、84.4UI(1 474)、63.3UI(1/632)、47.5UI、(1/843)35.6UI(1/1124)、26.7UI(1/1498)、20UI(1/1998)、15UI(1/2663) 。0UI標準を、1/400に希釈された血清陰性血清を用いて調製した。
アッセイ:全てのその後の工程を、Gemini ELISA自動化プラットフォーム(Stratec)で実施したが、しかし、RTで手動により実施することもできる。乾燥されたプレートを最初に350μlのDPBS/Tweenで2回洗浄した。テストされた血清及び標準の希釈液を、100μl/ウェルを伴う一連のデュプリケートとしてプレート中に分配した。プレートを次に、RTで1時間インキュベートした。インキュベーション期間後、プレートを350μlのDPBS/Tweenで4回洗浄し、DPBS 0.05%Tween 20、0.1%BSA 中の100μlのペルオキシダーゼ結合二次抗体希釈液(1/50000抗マウスIgG又は1/60 000抗ヒトIgG、それぞれSigma Aldrich ref A0168及びA0170)を次に、全てのウェル中に迅速に分配した。RTで1時間後、プレートをDPBS tween中で4回洗浄した。顕色反応を、100μlのTMB基質(Thermofisher ref 34029)を加え、RTで正確に20分間実施し、次に50μlのH2SO4 0.2Mで反応を停止させ、それに続き30秒間混合した。次に、ウェルの吸光度測定を450nmでGemini統合分光光度計を使用して実施した。
データ処理:ブランクサブトラクションをデュプリケートのブランクウェルで実施し、一次抗体/血清をウェル中に配置しなかったが、しかし、全てのその後の工程(洗浄、二次Ab、基質)を実施した。標準の血清希釈液を平均し、4パラメーターロジスティック回帰を用いて適合させ、2.5AUで固定された漸近線の上限値(Di)及び適合することが可能にされた他の全ての変数(Ai、Bi、Ci)を伴った。この回帰から、テストされた希釈のデュプリケートによって、それらの見掛け上のUIを算出して平均することができた。デュプリケート測定において、変動係数が10%を上回って観察された場合、次にサンプルは再テストされうる。この研究において提示された全てのELISAデータは、独立した滴定において数回得られた。
結果
タキゾイトにおけるFR235222へのプロテオーム応答の定量分析によって、新規のブラディゾイト特異的タンパク質としてBCLAが同定される。
シクロペプチドFR235222によるTgHDAC3の特異的阻害によって、TゴンディゲノムにわたりヒストンH4アセチル化の定常状態レベルが破壊され、段階特異的遺伝子の抑制解除が誘導されることが示された(Bougdour et al., 2009;Sindikubwabo et al., 2017)。本発明者らはFR235222の特性を利用し、大規模なプロテオーム試験のために必要とされる量のタンパク質を産生することが可能なインビトロ嚢胞形成システムを開発した(Farhat D et al.、原稿準備中)。嚢胞形成性II型(PruΔku80)株の低用量での及び短期間にわたる処理に続いて、本発明者らは定量プロテオミクス試験を実施し、FR235222処理されたプロテオームが、段階特異的タンパク質(ブラディゾイト段階に制限されるとして認識されているものを含む)において有意に濃縮されることを明らかにした(図1a)。この分析から、本発明者らは、タンパク質TGME49_209755(以下、BCLA(脳嚢胞負荷関連抗原)と呼ぶ)が、いくつかのタンパク質が感染の慢性期に含まれるのと同じ方法で、FR235222処理時に有意に誘導されることを見出した(図1a)。これは、ブラディゾイトデータセットに制限されているとして報告されたその発現プロファイルと一致している(図1b、供給源ToxoDB)。
他のエビデンスによって、BCLA発現のエピジェネティックな調節が裏付けられる。本発明者らは最近、H3K14ac及びH3K9me3 PTMによって、一時的に抑制される遺伝子がブックマークされ、それらが段階特異的発現のために寄生虫段階の分化を待つことを報告した(Sindikubwabo et al., 2017)。タキゾイトにおいて、BCLA遺伝子座は、「平衡を保った」段階特異的遺伝子を弁別的にマークするこの二重PTM濃縮を呈している(図1c)。さらに、最近のTgHDAC3 ChIP-seq分析(Farhat D et al.、原稿準備中)によって、BCLA遺伝子座でのヒストンデアセチラーゼの存在が明らかになった(図1c)。TgHDAC3の、その調節における関与の根底にある決定的な遺伝的エビデンスは、トランスフェクトされたタキゾイトにおいてBCLA誘導を起こすTgHDAC3のCRISPR媒介性の遺伝子破壊によりもたらされ(図1d)、それにより、酵素に対するFR235222の効果を模倣した。本発明者らは、これらのデータから、BCLAが、TgHDAC3により調節されるブラディゾイト遺伝子のファミリーに属し、その周囲のヘテロクロマチンが、細胞分化時での迅速な活性化のためにそれらの平衡を保つ一方で、発生遺伝子をサイレンシングすることが可能な、いわゆる二価クロマチンドメインにより典型的に表されると結論付けた(Sindikubwabo et al., 2017)。
BCLAはPV中に分泌され、インビトロで変換されたブラディゾイト含有液胞のPVMと会合する。
BCLAは、予測されるN末端シグナルペプチド及び13回反復される48アミノ酸のモチーフにより典型的に表される中央コアドメインと境を接する~150残基の保存されたC末端領域を伴う140kDaタンパク質をコードする単一のオープンリーディングフレームであって( 図2a)、その組成及び頻度は、コクシジウムのサブクラスを通じて、Tゴンディ系統の間で進化してきた(図2b)。BCLA相同タンパク質は、ネオスポラ・カニナム(Neospora caninum)において不十分に保存されている一方で、それは、BCLAの繰り返しと共通の特性を持つ短いリピートを伴う、全体的に同じアーキテクチャを有する(データは示さず)。障害傾向検索(dis-embl又はIUPredを使用する)によって、コア反復モチーフを含むその配列の大半全体にわたりBCLAが高度に無秩序であると予測される(図2a)。しかし、C末端(およそaa 1100から1275)は、構造化されているとして予測され、別のドメインを構成しうる(図2a)。
BCLAは、FR235222処理されたサンプルにおける質量分析により明解に及び独占的に同定されたが(図1a)、感染の間でのタンパク質の動態及び細胞内分布はまだ研究されていないままである。TゴンディにおけるBLCAの動態をインサイツでさらに探索するために、本発明者らは、保存されたリピートの末端にそれぞれ位置付けられる2つの合成ペプチドに対するポリクローナル抗体を産生した(図2a)。本発明者らは最初に、細胞をFR235222に曝露することによって、本来なら未処理のタキゾイトにおいて検出不可能である~140kDaの予想サイズのタンパク質バンドとしてBCLAシグナル強度が有意に増加することを示すことにより、プロテオームデータを検証する(図2c)。
ブラディゾイト特異的マーカーのC末端HA-Flagタグ付きバージョンを発現するタキゾイトが宿主とする線維芽細胞において、BCLAは、液胞空間中でのFR235222刺激時に明確に検出され、PVMに明らかに蓄積する一方で、その発現がブラディゾイトマーカーであるENO1及びLDH2の誘導と同時発生する(データは示さず)。逆に、BCLAは、BCLAを欠くように遺伝的に操作されたタキゾイトで感染された細胞においてもはや検出されなかったが(Δbcla、表2)、それにより、自家抗体特異性が確証された(データは示さず)。最後に、本発明者らが、HA-Flagタグとの融合体において内因性タンパク質を発現するI型(RHΔku80)及びII型(PruΔku80)系統におけるBCLA動態をモニターする場合、本発明者らは、一度、FR235222により刺激されると、HAタグ付きBCLAタンパク質が、株の種類に関係なく、液胞空間中に、及び膜で標的化されることを示す(データは示さず)。このように、C末端融合タグの存在は、BCLAの細胞内局在化に影響を及ぼさない。なぜなら、それは、タグ付けされていない株において抗BCLA血清を使用している際に見られるものと同様であるためである。
Tゴンディの異なる寄生虫株をFR235222に曝露している際に、本発明者らは、BCLAシグナル強度が、感染株に依存して大きく変動することを最終的に発見したが、II型(PruΔku80、ME49、76K-GFP-Luc)株における非常に強い誘導から、I型(GT1及びRHΔku80)株及びハプロ群11(COUG)株でのやや中程度まで及び、驚くべきことに、かすかな(ない場合)シグナルが、III型(CTG)株により感染された細胞において検出された(図3a及びデータは示さず)。組織嚢胞を容易に発生させる株の能力により説明されうるこの矛盾を、以下で考察する。
BCLAはインビボで嚢胞マトリックス及び嚢胞壁に局在化する。
レクチンヒマラヤフジマメ凝集素(DBA)が結合するグリコシル化された嚢胞壁は、Tゴンディの持続性及び経口伝染を促進させる重要な構造的特色である(Tomita et al., 2013)。ここで、本発明者らは、インビトロで変換されたブラディゾイトを囲む膜で独占的にBCLAとDBAの同時染色の強力なエビデンスをもたらしたが(データは示さず)、BCLAが、液胞空間中へのその送達に続いて、未熟な嚢胞の壁に経時的に蓄積することを強く示している(薄いDBA陽性嚢胞壁に基づく)。
しかし、組織培養におけるインビトロのブラディゾイト発生によって、完全に成熟な嚢胞がもたらされないことを考慮し、本発明者らは、TゴンディII型株により慢性的に感染されたマウスから分離されたブラディゾイト含有嚢胞におけるBCLAの局在化を再検討した。慢性的に感染されたマウスにおいて、BCLAに対して産生された自家抗体によって、嚢胞壁ならびにブラディゾイトを囲むマトリックス空間が染色される(データは示さず)。免疫蛍光の結果によって、BCLAが嚢胞壁の内層中又は外層中に位置付けられるのかを明白に決定することが可能にならなかったが、興味深いことに、非透過性のエクスビボ嚢胞は抗体により容易に染色され、タンパク質の外側の位置(データは示さず)及び、従って、宿主細胞の細胞質へのその曝露を示唆する。シグナルは、Δbclaブラディゾイトの宿主である嚢胞では検出されず(データは示さず)、従って、抗BCLA抗体の特異性をインビボで確証した(図4a)。
BCLAの液胞外機能のエビデンスはあまりないが、しかし、時折、タンパク質が液胞膜を越えて宿主細胞の細胞質中に輸送されるように見える(データは示さず)。残念ながら、多くの試みにもかかわらず、本発明者らは、本発明者らが他のエフェクターで行ったように、ある場合、宿主細胞中でのその機能をより詳細にさらに試験するための、PVMを超えたBCLAエクスポートの根底にあるアドホック条件を見出さなかった(Hakimi et al., 2017)。それにもかかわらず、本発明者らは、BCLAエクスポートはMyr1非依存的であったが(データは示さず)、そのようなものとして、エクスポートされたタンパク質のTゴンディトランスロコンを要求しないことを示すことができた(Franco et al., 2016)。感染細胞のサイトゾルにおけるタンパク質の蓄積を説明するためのエレガントな方法は、宿主のプロテアーゼの制御下にある可能性が高いPVMで起こりうる処理後のその放出であるが、しかし、これはまだ実証されていない。感染された、FR235222で刺激された宿主細胞のBCLA関連プロテオームの分析は、ある場合、宿主細胞タンパク質(プロテアーゼを含む)とのBCLA相互作用が、PVMの外向き側で、又はBCLAがそこに送達された場合に感染細胞の細胞質中でさえ起こるかを決定するように実施されるだろう。
BCLAはインビボでの適した嚢胞機能のために不要である。
ブラディゾイト組織嚢胞におけるBCLAの機能を決定するために、BCLAのコード領域が欠失された(PruΔku80Δbcla)、又はCas9媒介性の遺伝子編集(76K-GFP-LucΔbcla)を使用し、DHFRカセットにより中断された2つの寄生虫系統を作った(表2)。本発明者らは次に、病態形成及び嚢胞形成を調べた。最初に、BCLA欠損株は、タキゾイト条件下でのインビトロでのそれらの親株と比較した場合、明らかな増殖表現型を示さなかった(図4a及びデータは示さず)。BCLA変異によって、PVの形成及び成熟において含まれるとして以前の試験において認識されたPV常在又はPVM関連タンパク質の発現又は局在化は損なわれない(即ち、GRA1、GRA5、GRA7;データは示さず)。FR235222刺激に続いてレクチンDBAにより正に標識されたΔbcla含有液胞により示されるように、インビトロでブラディゾイト段階に変換し、嚢胞を形成するBCLA欠損寄生虫の能力において、差は検出されなかった(データは示さず)。
BCLAは、タキゾイトでのインビボ感染を開始するために必須ではない。
急性感染の間でのインビボでのBCLAの重要性を調べるために、本発明者らは、II型バックグラウンドからのWT寄生虫又はBCLA欠損寄生虫のいずれかの腹腔内(i.p.)に感染されたBALB/cマウス又はNMRIマウスにおける寄生過程を比較し、接種量は1×104から1×106タキゾイトの範囲であった。感染後5~8日に、II型BCLA欠損タキゾイトで感染された全てのマウスが、感染の徴候(即ち、体重減少及び波立った毛並み)を示し始め、接種物及びマウスの遺伝的背景に関係なく、親株76Kと同じ時間枠での感染まで生き延びた(図5a)。このように、BCLAは、マウスにおける感染の急性期の間でのインビボの増殖及び病態形成のために不要であるように見える。チャレンジを生き延びた動物を、その後、感染後10週に、ウエスタンブロットにより寄生虫抗原への血清応答についてテストした(データは示さず)。明確に、BCLA欠失によって感染力は損なわれない。なぜなら、全てのマウスが、寄生虫株に関係なく、同じパターンを伴ってTゴンディに対するIgGを示したためである(データは示さず)。
BCLA欠損は、慢性的に感染されたマウスから単離された脳嚢胞の完全性に影響を及ぼす。
Δbcla変異体で感染されたマウスの脳の検査によって、嚢胞形成が、変異株という状況下でも依然として起こりうることが実証された(図6b)。しかし、BCLA欠損変異体は、親株と比較し、慢性的に感染されたマウスのCNSにおいてかなり低下した寄生虫負荷を作り出すが、しかし、その差は統計的有意性に達することはなかったが(図6b及びデータは示さず)、BCLAが、少なくとも、慢性感染の間に嚢胞を確立及び維持するために不要ではないことを証明している。嚢胞の徹底的な検査によって、しかし、変異寄生虫で感染されたマウスから分離されたものは比較的小さく(図6a)、より少ないブラディゾイトを含み、「より低いパッキング密度」(Watts et al., 2015)及びGFP蛍光における全体的な低下がもたらされることが明らかになったが(図6b)、それは、脳全体において測定された寄生虫負荷におけるわずかな低下とかなり一致している(図6b)。これらの定量的指標を超えて、Δbcla含有嚢胞は、真円度の喪失に導くそれらの嚢胞壁表面の有意な変形により、ならびに、ある程度まで、独特の「出芽」及び「セグメント化又は亀裂」表現型により独特に典型的に表され(図6a及びデータは示さず)、嚢胞の成長、維持、及び/又は安定性におけるBCLAの可能な役割を明らかにしている。
本発明者らは次に、表面変形によって嚢胞が脆弱(脳Δcst1含有嚢胞について以前に報告された表現型(Tomita et al., 2013))になりうるか否かを評価した。それらの単離の間に、嚢胞を機械的ストレスに供し、脳組織からそれらを放出させ、等密度遠心分離によりそれらを精製した一方で(方法を参照)、本発明者らは、この過酷な手順の間に、Δbcla含有嚢胞がWT嚢胞よりも脆弱であることは観察しなかったが(データは示さず)、しかし、それらの少数は、遺伝的背景に関係なくばらばらになった。
BCLAの欠失によって、慢性的に感染されたマウスの脳から単離された嚢胞のヒマラヤフジマメレクチン(DBA)による壁染色は損なわれない(データは示さず)。従って、及びFR235222により処理されたタキゾイトで既に結論付けられているように、BCLAは、嚢胞壁のGalNAcグリコシル化において直接的に関与していない。嚢胞内のブラディゾイトの生存率は、宿主細胞から来る栄養素に対する壁の透過性に対して条件付けられるが、しかし、後者は非常に限定されており、壁は免疫応答の成分を避けるために、篩として機能している。壁の透過性が、BCLAの非存在においてある方法で変化したか否かをテストするために、本発明者らは、3から40kDaの範囲の異なるサイズにより典型的に表されるフルオロフォアの嚢胞中への侵入をモニターした。インタクトな嚢胞(寄生虫の漏出を伴わない)だけが顕微鏡下で視覚化され、調べられた。透過性は、3kDa(嚢胞マトリックス全体にわたる拡散パターン)又は10kDa(断面部位を伴う拡散パターン)色素のいずれかを用いて、WTとBCLA欠損嚢胞の間で非常に類似していた。興味深いことに、より高分子量(40kDa)を伴う蛍光トレーサーは、以前に報告されたように嚢胞壁を効率的に通過することができなかった(Lemgruber et al., 2011)。さらに、弱い標識は、株間でさえ異なっていた。恐らくは、なぜなら、Δbcla含有嚢胞は、親株を含む嚢胞よりも「緩んでおり」、透過性であり、それほど透過性ではなく、十分に明確化された連続的な嚢胞壁により囲まれたブラディゾイトでより多く満たされているためである(データは示さず)。全体的には、本発明者らの結果は、BCLAはインビボでの適切な嚢胞機能のために不要であるが、しかし、タンパク質は、嚢胞壁において構造的役割を有し、それによって嚢胞壁透過性欠損の表現型に導きうることを示す。
BCLAは、トキソプラズマブラディゾイト含有嚢胞による効率的な口腔感染のために必須ではない。
BCLA依存性嚢胞変形のインビボでの機能的結果を検証するために、本発明者らは、Δbcla又は親株含有嚢胞をマウスに与え、2つの異なるマウスの遺伝的バックグラウンドにおける病原性及び感染力を評価した。C57BL/6マウスを、76k-GFP-luc-Δbcla株又は76k-GFP-WT株の46の嚢胞で経口感染させ、腸における寄生虫の侵入及び播種の動態、ならびに寄生虫により誘発される局所免疫応答を試験した。感染8日目に、マウス血清中のTゴンディ特異的IgGのレベルはかなり類似しており(データは示さず)、それらは、回腸における寄生虫負荷において有意差はなかった(図7a)。回腸の組織学的分析によって、株の遺伝的バックグラウンドに関係なく、炎症性部位(データは示さず)を伴う、変化した陰窩-絨毛形態(データは示さず)を伴う腸上皮構造の全体的な喪失が示されている。サイトカインプロファイルは同じパターンを呈し、回腸における炎症促進性サイトカイン(IFNγ)及びケモカイン(CCL2)における明らかな増加を伴うが、しかし、BCLA非依存的な様式である(図7b)。本発明者らは次に、NMRIマウスを20の嚢胞で経口感染させ、血流中に播種し、深部組織において新たな嚢胞を形成するΔbcla嚢胞の能力を評価した。全ての経口感染されたマウスが、感染の急性期を通じて病気の徴候(体重における低下)を示し、血清変換された(データは示さず)。10週間後、全てのマウスについて、嚢胞数における、また寄生虫負荷における有意差は株間で検出されなかった(図7c)。これらのデータは、BCLA欠損嚢胞が経口経路により感染を伝播し、軽度の炎症状態により典型的に表される、マウスにおける慢性感染を起こすことができることを示す。慢性的に感染されたNMRIマウスの脳における炎症促進性サイトカインのプロファイリングによって、炎症が野生型よりもΔbclaにおいてそれほど重度ではないことが示唆されたが、恐らくは低いサンプルサイズに起因して、統計的有意性は達成されなかった(各々の条件について3匹のマウス;図7d)。脳におけるこの比較的軽度の炎症は、Δbcla感染マウスにおける比較的少ない数の嚢胞の結果でありうるが、しかし、これは決定されなければならない。
血清診断のためのBCLAキメラペプチドの高レベル発現及び精製。
自然免疫系の体液性及び細胞性防御は、Tゴンディに対する身体の最前線の防御である。抗体は、急性感染の間に寄生虫の除去を援助し、二次トキソプラズマ感染に対する耐性を媒介すると報告された(Sayles et al., 2000)。そのようなものとして、一度、免疫が確立されると、IgGによって妊娠の間の垂直伝染から胎児が保護される。急性感染症と慢性感染症の間での血清学的区別は、臨床的及び疫学的関連性を有するが、しかし、現在、感染の時間ならびに嚢胞の存在を正確に推定するためのトキソプラズマ症についてのブラディゾイト特異的血清アッセイはない。さらに、再燃が完全に免疫能力のある患者(例、網膜脈絡膜炎)及び免疫不全患者の両方において生じうるため、及び脳における嚢胞の存在は最近、一部の神経精神障害に関連づけられると疑われた。このように、半休眠嚢胞に対して向けられたトキソプラズマ抗体を検出することは、新たな診断の展望を開くことにより、トキソプラズマ症の血清診断への有意な改善になりうる。しかし、嚢胞壁又は表面ブラディゾイトの成分はほとんど同定されておらず、少なくとも市販のキットにおいて、血清学の目的のために抗原としての役割を果たすものは示されなかった。理想的な抗原は、潜伏性のブラディゾイト段階において独占的に発現されるべきであり、理想的には嚢胞の表面に曝露されるべきであり、本発明者らがその抗原性をテストする動機となった、BCLAにおいて見出された2つの特色である。
血清WBテストのために要求される高純度で豊富な量のBCLAを得るために、BCLAのC末端ドメイン末端(res 1100~1275、以下rBCLAと呼ぶ)を組換え発現させることを選んだが、それは、コア反復モチーフを含むタンパク質の残り部分とは対照的に、構造化されていると予測される(図2a)。rBCLAは、従って、N末端ポリヒスチジンタグを伴うキメラタンパク質として大腸菌において発現された。効率的に発現されるが、それは、天然では不溶性である、又は不溶性の封入体に隔離されているが、しかし、溶解工程の間に0.2%N-ラウリルサルコシドを使用して可溶化することができる。溶解及び遠心分離後、rBCLAを最初に、ニッケルアフィニティーレジンを使用してプルダウンした(データは示さず)。20.9kDaの理論上のMw及び4.7のpIを伴い、BCLAはSDS-PAGEゲル上で17~25kDaの分子量マーカーの間を移動するのが観察され、また、pH:8の緩衝液中では、BCLAは強く負に帯電するであろう。大腸菌混入物は、従って、陰イオン交換クロマトグラフィーを使用して効率的に除去することができる(データは示さず)。最後に、rBCLAはサイズ排除クロマトグラフィーから可溶形態で溶出されるが(データは示さず)、広い容量溶出範囲のため多分散であり、溶出容量がS75カラムのボイド容量に近いためマルチオリゴマーを形成する。溶出画分をプールする際、硫酸アンモニウム沈殿及び透析の最終段階を実施して、核酸混入物を除去する(データは示さず)。精製のこの最終段階後、RH株(LD bio)及びrBCLAの両方のタキゾイト抗原をそれぞれSDS-PAGEにより分離し、次にトキソプラズマ症の異なる状態により誘発されたマウス抗血清を用いたイムノブロットによりプローブ化し、免疫グロブリンG、M、及びAによる抗原認識の並行分析を可能にした。
rBCLAは、急性的に感染されたマウスの血清と反応しないが、しかし、慢性的に感染されたマウスからの抗TゴンディIgGの検出のための優れた抗原を構成する。
本発明者らは最初に、感染の急性期にあるマウスから収集した血清で免疫ブロットを実施した。rBCLAタンパク質は、非定型(COUG、ハプロタイプ11)株、病原性(RH、I型)株、又は嚢胞形成(76K、II型)株(図8a-c)により急性的に感染されたマウスの血清と見掛け上は反応しない一方で、全てのTゴンディ曝露マウスは、遺伝的バックグラウンド(NMRI、CBA、C57BL/6)又は感染の経路(腹腔内又は経口)に関係なく、セロコンバージョンする(図8a-c及びデータは示さず)。しかし、rBCLAは、II型嚢胞形成株(Pru、ME49、又は76K)による感染に続いて潜伏性トキソプラズマ症を発生するマウスのTゴンディIgG抗体と強く反応する(図9a-c)。rBCLAは、感染の亜慢性(>21日、図9d)又は慢性(>42日図9a-c)段階のマウスの血清により検出され、22ヶ月間持続的に感染されたマウスの血清での極めて強いシグナルを伴う(図9c)。反応性は、BCLA欠損株で感染されていない、又は慢性的に感染されたマウスからの血清をアッセイした場合に検出されなかったが、IgG抗体がBCLAに対してインビボで特異的に向けられることを実証している(図9d)。選択過程は抗体親和性成熟の間に生じるため(Eisen, 2014)、本発明者らは、rBCLA抗原は、慢性感染の間でのIgGと比較し、急性感染の間にIgMにより検出されうると判断した。明らかに、rBCLAは抗TゴンディIgM又はIgAと反応していない(データは示さず)。上の知見は、従って、rBCLAによって、マウスに感染した寄生虫段階を、潜伏感染についての優先的なIgG反応性を伴って区別することができたことを強く支持する。
rBCLAは、嚢胞形成株により持続的に感染されたマウスの血清中で独占的に検出される。
rBCLAは、潜伏感染を作る傾向のある嚢胞形成株について特異的な反応性を有することが示された(図9a-d)。議論を持続するためには、しかし、嚢胞を作らない株がrBCLAに対して向けられた特定の抗体応答を産生することができないことを示す必要があるであろう。最初に、非嚢胞形成病原性株RHで感染され、急性トキソプラズマ症を克服するためにピリメタミン又はスルファジアジンで連続的に処置された動物の血清分析によって、抗タキゾイト特異的抗体の濃縮レベルが明らかになった一方で(感染後22日;図9e、下パネル)、rBCLAはほとんど検出可能ではなかった(図9e、上パネル)。本発明者らは、処置によって寄生虫の深部組織中での播種及び、結果的に、ブラディゾイト中へのそれらの分化が変化したことを排除することができないため、本発明者らは、適切な陽性血清により特徴付けられる、非致死性の慢性潜伏感染を起こすIII型株であるCTGにより持続的に感染されたマウスにおけるrBCLAへのIgG応答をモニターした(図9f、右パネル)。接種後42日に、rBCLAに対する反応性は観察されなかった(図9f)。II型感染との主な違い(図9a-d)は、CTGで慢性的に感染されたマウスが、それらの脳において少ない数の(ない場合)嚢胞を有することであったが(Cannella et al., 2014)、嚢胞負荷とrBCLA抗体レベルとの可能性の高い関係を示唆する。同様に、通常はより少ない数の嚢胞を産生するII型(PruΔku80)株により持続的に感染されたマウスからの血清はrBCLAと反応せず(図9g)、rBCLA抗原に対するマウスの抗体反応は亜慢性感染の直後に起こることを示しており(>21日p.i.)、少なくともマウスモデルにおいて、嚢胞の存在により条件付けられているように思われる。潜伏性II型感染の再燃を産生する免疫抑制治療(コルチコイド)は、rBCLAに対する抗体応答を増強しないが、ブラディゾイトの循環中への放出に応答する免疫反応の仮説を除外する(図9h)。
rBCLA内の抗原性サブフラグメントを見出すための限定的なタンパク質分解。
rBCLAの高度に抗原性のサブフラグメントを回収する目的で、精製サンプルでの限定的なタンパク質分解を、トリプシン、キモトリプシン、エラスターゼ、及びパパインを使用して行った。SDS PAGEによるタンパク質分解反応の分析によって(図10a)、rBCLAがキモトリプシンにより急速に分解され、エラスターゼ、トリプシン、及びパパインにより部分的に分解され、17kDaマーカーの辺りに安定なフラグメントを生成することが示されている。上で言及するのと同じプロトコルに従って陽性マウスIgG血清(図10b)及びHisタグ(図10c)に対してブロットする場合、大半の分解がC末端内で生じることを観察することができる。なぜなら、それらは、hisタグブロットにおいて陽性のままであるためである。これらの同じ分解は、抗マウスIgG WBにおいてより弱い強度の顕色バンドを提示し、コンストラクトのさらなるトランケーションによって、ウエスタンブロット分析内でマウスIgGの特異性又は感度が増加しないことを示唆する。
rBCLAはまた、ヒト血清と反応するが、しかし、陽性のパターンは依然として研究中である。
本発明者らは次に、妊娠の間に、先天性トキソプラズマ症の証拠を伴って一次感染された妊娠女性からの陽性羊水で感染されたマウスが、qPCR陰性羊水又は胎盤で感染されたマウスとは対照的に、rBCLAと明らかに反応していることを示した(図11a)。rBCLAは、従って、臨床分離株において、それらの嚢胞形成特性を予測するための適した血清マーカーになる。マウスモデルにおける抗rBCLA免疫グロブリン検出の評価に続いて、本発明者らは、患者の血清学的及び臨床的状態に従って、ヒトにおける抗rBCLA検出のパターンを評価することを目的とした(表3)。rBCLA抗原に対して向けられた抗体は、血清のみに、又は血清及び房水の両方において、強く疑われる又は証明された眼のトキソプラズマ症を伴う3名の患者において検出されている(図11b)。これらの臨床症例は、網膜中でのTゴンディ嚢胞の再燃に起因していたが、IgMが検出されなかったため、一次感染ではなかった。同じように、血液学的疾患に関連づけられる免疫抑制に起因するトキソプラズマ症の再燃を伴う3名の患者がまた、抗rBCLA IgGを有するが、しかし、ウエスタンブロットにおける標識は、眼トキソプラズマ症を伴うものと比較して弱かったが、抗体のレベルは、Vidas(登録商標)及びArchitect(登録商標)を使用してかなり高かった(表3)。比較的小さいサンプルサイズによって幅広い一般化が限定されている場合でさえ、トキソプラズマ症の再燃に起因するヒト血清へのrBCLAの反応性は、本発明者らが、血清マーカーとしてのrBCLAの存在と嚢胞負荷を相関させた本発明者らのマウスモデルに対してさらなるエビデンスを提供する。予想外に、妊娠女性における最近のセロコンバージョンを伴う3つの血清及び先天性トキソプラズマ症を伴う小児の1つの血清がまた、rBCLAに反応する(図11b)。これは証明するのは困難であるが、最近の一次感染が末梢組織中にTゴンディ嚢胞が生成し、それによって、次に、体液性抗BCLA免疫応答が惹起される可能性がある。いずれにせよ、Tゴンディについて血清陰性として同定された患者の全ての血清で、rBCLAは検出されず、トキソプラズマ症を伴う患者についてのこの抗原の良好な特異性を示している(図11b)。
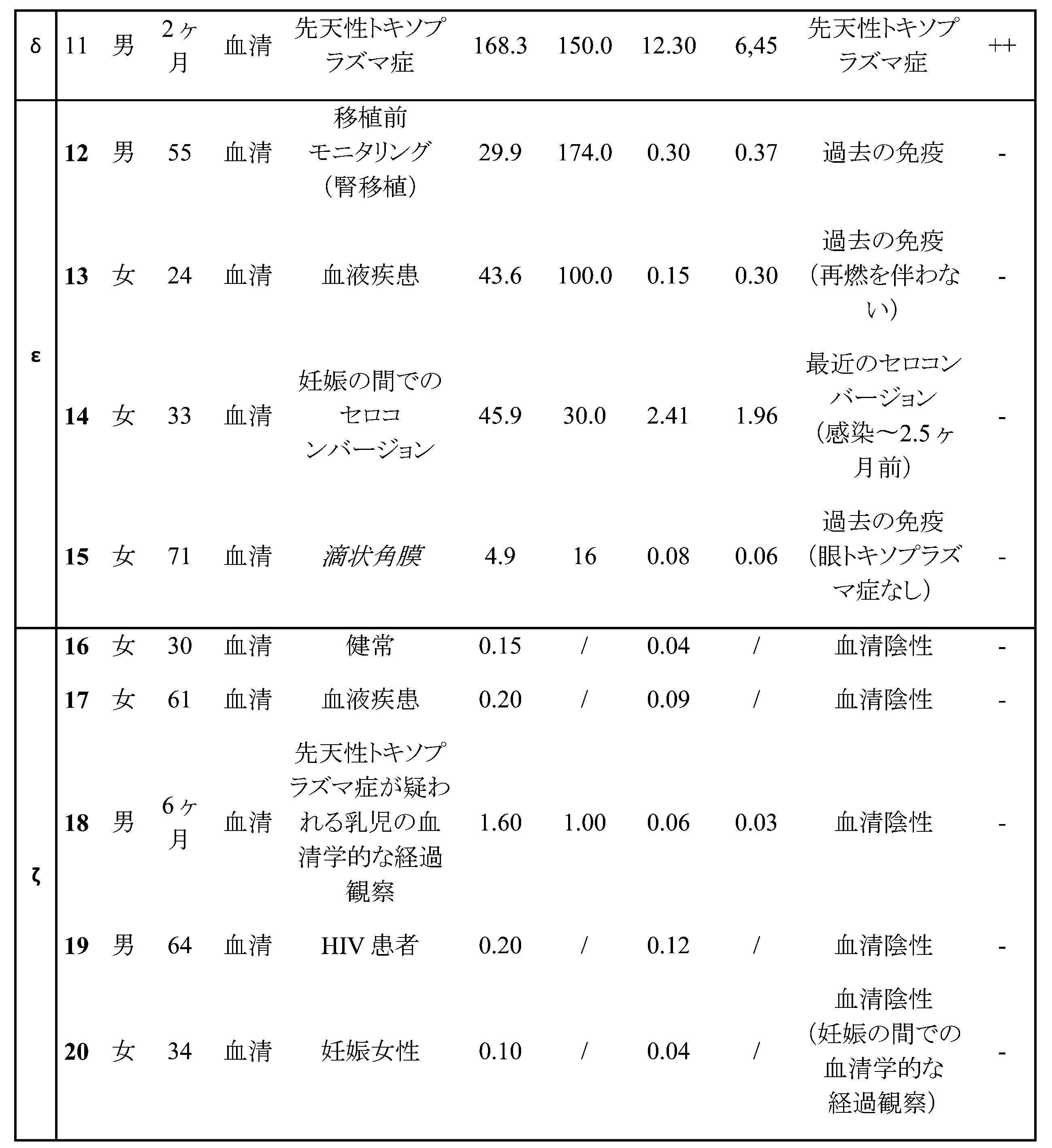
Vidas(登録商標)及びArchitect(登録商標)を使用した血清学的値の解釈のために製造者により推奨されるカットオフ
Vidas(登録商標)IgG(IU/mL):陰性<4;グレーゾーン:4.0≦x<8.0;陽性:≧8.0
Vidas(登録商標)IgM(指標):陰性<0.55;グレーゾーン:0.55≦x<0.65;陽性:≧0.65
Architect(登録商標)IgG(IU/mL):陰性<1.6;グレーゾーン:1.6≦x<3.0;陽性:≦3.0
Architect(登録商標)IgM(指標):陰性<0.50;グレーゾーン:0.50≦x<0.60;陽性:≧0.60
rBCLA陽性患者のエピトープマッピングによって、rBCLA内の多数の抗原領域及び反復領域内の一貫した反応性が明らかになる。
rBCLAの特異的な免疫原性の質は、異なる臨床カテゴリーからの一連の血清におけるウエスタンブロットにより証明されている。主な目的の1つは、ELISAベースのアッセイを開発し、費用効果が高く、確実で迅速な様式において、より大きな血清コホートをスクリーニングすることであった。しかし、化学的に合成されたペプチドにほぼ完全に基づいた、そのようなアッセイを正確に設定するために、BCLAの局所エピトープ免疫原性をより正確に理解することが要求された。そうするために、本発明者らは、反復領域及びrBCLAドメインの両方をカバーするセルロース印刷ペプチドアレイを設計及び合成した(図12a)。これらのアレイは、ペプチドの間に3aaのギャップ工程を伴う15aaのペプチドを使用して考案されている。本発明者らは次に、rBCLAに対するウエスタンブロットにより明らかに陽性であったいくつかの血清をテストし、同じ数の陰性血清を取り、非特異的反応性を比例的に差し引いた。分析された場合、リピート領域及びrBCLAの両方で得られた各々のペプチドについての合計反応性スコア(図12b)によって、2つの重要な観察が提供される:第1に、rBCLAは、特にペプチド13、22、30、及び43に近い、いくつかのより強い反応性のゾーンを有するにもかかわらず、ドメイン全体に多数のエピトープを有し、異なる血清が異なるゾーンにかなり異なって反応しうる(図12c)。これによって、rBCLAをELISAテスト内で組換えタンパク質として保つための要件が強調される。さらに、rBCLAドメインは構造化されていると予測されるため、構造化されたエピトープは組換えタンパク質戦略によってだけ提供され、その使用がさらに強調されうる。第2に、リピートモチーフは、ほぼ全てのテストされたヒト血清において、2つの別々のゾーン(モチーフAとしてのペプチド3から7及びモチーフBとしての13から16)において一貫して反応することが見出されている。この特色によって、より感度の高いELISA技術を得るために、これらのモチーフをカバーする1つ以上のペプチドを含めることの重要性が強調される。これらの結果から、本発明者らは、従って、全長BCLA組換えタンパク質及び化学的に合成されたリピートモチーフを組み合わせたELISAを設計した。
rBCLA及び反復ペプチドを使用したELISA滴定によって、BCLAの血清陽性は急性及び慢性的に感染された個人内でより高いことが実証される。
異なる臨床プロファイルを分類及び区別するための厳格なルールを確立する際に、123の血清(全てが異なる個人から取られた)を、開発されたBCLA-ELISAテストを用いてテストした。ELISAスコアは、国際単位(UI)で表され、以下のように列挙されている患者の臨床プロファイルに従って呈示される(図13)。
1)「血清陰性」、SAG1IgG/IgM陰性血清を伴う全ての患者(健康又は他の前状態を伴う)を再グループ化する。
2)「過去の免疫」、SAG1陽性IgGとして分類されるが、しかし、SAG1反応性IgMを伴わず、次の3つのカテゴリー中に分類されない全ての患者(健康又は他の状態を伴う)を再グループ化する。
3)「免疫不全患者における活動性トキソプラズマ症」、証明された症候性トキソプラズマ症を伴う全てのSAG1 IgG陽性及び免疫不全患者を再グループ化する(播種性、脳及び原発性トキソプラズマ症を再グループ化)。
4)「免疫不全患者における無症候性の血清学的再燃」、血清学的再燃をおこしているが、しかし、目に見える症状を伴わない全ての免疫不全患者を再グループ化する。
5)「眼トキソプラズマ症」、SAG1陽性の血清を伴い、証明された眼トキソプラズマ症を患っている患者を再グループ化する。
この分析によって、いくつかの観察を行うことができる。第1に、全ての群が、血清反応陰性群と比較した場合、BCLA滴定の中央値における有意な増加を呈示し、ずっと高い陽性率を有する。これによって、ヒトにおいて、SAG1血清陽性状態とBCLA陽性状態を発生する能力の間での直接的な相関関係が証明される。これはまた、SAG1陰性血清と、依然として約10%の偽陽性発見率を呈示するBCLA血清の間での現在の矛盾を示す。これは、一部の血清において、異なるBCLAエピトープとの非特異的な相互作用、rBCLAと同時精製された強い免疫原性の外因性細菌混入物、及び陰性のSAG1血清を伴う潜在的に真のBCLA陽性患者により説明することができる。第2の主な観察は、一部の臨床プロファイルが非常により強い免疫原性反応を生成する傾向を有することであり、最も注目すべきは、BCLA血清が「過去の免疫」群における陽性BCLA血清の中央値を十分に超えて滴定される、「免疫不全患者における無症候性血清学的再燃」群である。最後の観察は、BCLA陽性を常に予測すべき一部の群について、例えば「免疫不全患者における活動性トキソプラズマ症」及び「眼トキソプラズマ症」の場合において、少数の血清が陰性のままである、又は陽性カットオフ下であるということである。この観察は、ELISAテストからの感度における欠如を強調しうる、又はBCLA血清が免疫抑制の間に陰性になりうるという事実を潜在的に例証しうる。
ELISAテストはまた、マウスにおける陽性BCLA血清を、比例する嚢胞負荷に関連づける際に一貫している。
全体的に、抗rBCLA抗体価の半定量分析によって、WT嚢胞を持つ可能性が高いBALB/cマウス及びNMRIマウスが、経時的な増加収量を伴い、BCLAに高度に反応性であるとして特定された(図14A)。脳関連TゴンディDNAでの定量PCRならびにブラディジェネシス時に特異的に誘導されることが報告されている脳関連miR-155及びmiR-146マイクロRNAの定量化(Cannella et al., 2014)との併用において、本発明者らは、齧歯類における長期にわたる原生動物の持続性にわたりTゴンディブラディゾイトを負荷した嚢胞を血清学的に検出するための信頼できる抗原としてのrBCLAのエビデンスをもたらした(図14B)。これらの結果は特に興味深い。なぜなら、ELISAテストの半定量的性質によって、経時的な嚢胞形成性Tゴンディ株の応答が著しく識別されるためである。
考察
トキソプラズマ・ゴンディによる感染は、ゾイトが迅速に定着し、脳、心臓、及び骨格筋において持続する厚い嚢胞壁により囲まれた嚢胞中に封入されたブラディゾイトとしてそれらの発生プログラムをさらに完了する急性全身期に導く(Jeffers et al., 2018)。宿主免疫応答は、タキゾイト集団の増殖を迅速に制御することができ、セロコンバージョンにより典型的に表される生涯にわたる免疫に導く。しかし、タキゾイトからブラディゾイトへの発生的移行は、完全に双方向であるため、免疫機能の任意の障害(例、AIDS患者、血液学的疾患、及び免疫抑制処置)は、脳炎及び限局性脳病変、肺疾患又は播種性疾患を起こしうる潜伏感染の再燃をもたらしうる。
免疫応答性をもつ対象における急性及び慢性トキソプラズマ症の診断は主に血清学に頼っている。なぜなら、感染症はしばしば無症候性であるためである。血清診断は多くの場合において遡及的である。なぜなら、それは、例えば、妊娠の間での又は移植環境におけるセロコンバージョンの実証に基づいているためである(Robert-Gangneux and Darde, 2012)。IgM抗体及びIgA抗体の増加レベルは、一次/急性感染の血清学的指標である一方で、高いIgG結合力によって一次感染が除外され、IgMの非存在における持続性及び定常状態のIgGレベルは、潜伏感染を典型的に表す(Dard et al., 2016)。しかし、血清診断結果の解釈は、十分に訓練された専門家でさえ依然として困難である。克服すべき現在の課題は:(i)最近の感染とより遠い感染とを識別すること;(ii)乳児における先天性トキソプラズマ症及び免疫不全患者における再燃を診断すること;及びiii)感染の起源、即ち、オーシストと対比して嚢胞を確証すること。多くの方法が、血清アッセイの精度及び感度を改善するために過去数十年間において開発されてきたが、それらは前述の懸念に対して不十分にしか対処していない。明らかな理由は、全てではないにしても、多くの市販の血清テストキットが、タキゾイト段階(例、SAG1)で優位に発現される、又は寄生虫の両方の感染段階(例、GRA8)に共通する溶解物又は組換え抗原を検出することである。
現在、世界中の感染の源を推定する、又は急性感染と潜伏感染を正確に識別するための、トキソプラズマ症のための信頼できるブラディゾイト特異的血清アッセイはない一方で、進歩している。実際に、最近のプロテオミクス試験は、スポロゾイト特異的タンパク質のレパートリーに光を当てており(Fritz et al., 2012; Possenti et al., 2013)、それによって、オーシスト感染動物について特異的な反応性を伴う、ニワトリ、ブタ、及びマウスに感染した寄生虫段階を区別できる血清マーカーとしてのCCp5Aが明らかになった(Santana et al., 2015)。
しかし、BAG1を含む特定のブラディゾイト抗原が、Tゴンディ感染に対する体液性免疫(Mun et al., 1999)及び細胞性免疫(Di Cristina et al., 2004)の両方の刺激に寄与すると報告している初期の試験にもかかわらず、ブラディゾイト/嚢胞抗原は現在、診断テストにおける潜伏感染の潜在的なマーカーとして考えられていない。ブラディゾイト/嚢胞特異的マーカーについての検索は、潜伏段階の特定のプロテオームを分析するために十分なマウス脳嚢胞を収集する能力によりいくらか限定されてきた。本試験において、本発明者らは、タキゾイトのクロマチン状態をエピドラッグで操作しながら、細胞培養においてブラディゾイト遺伝子を脱抑制することにより、この問題を回避する方法を見出した。従って、数百のブラディゾイト制限タンパク質が、同定され、BCLAも含まれる。
タンパク質BCLAは、潜伏感染を開始又は維持するために必須ではないことが示されたが、しかし、BCLA欠損は、マウスモデルにおける脳嚢胞の変形及び真円度の喪失により典型的に表される非常に特異な表現型をもたらした。これまで、2つの嚢胞壁関連タンパク質、即ち、BPK1及びCST1は、Tゴンディ嚢胞の構造的完全性を含んでいた(Jeffers et al., 2018)。Δbpk1株において、嚢胞はより小さく、ペプシン酸処理に対してより感受性であり、BCLAとは異なり、Δbpk1株は、口腔感染症を起こす低下した能力を有する(Buchholz et al., 2013)。CST1は、Tゴンディ嚢胞に特徴的なヒマラヤフジマメ凝集素(DBA)レクチン結合に関与している。CST1の欠失によって、低下した嚢胞数及び嚢胞壁の基礎領域が菲薄化及び破壊により特徴付けられる脆弱な脳嚢胞の表現型がもたらされる(Tomita et al., 2013)。グリコシル化の欠損はまた、Δbcla嚢胞の変形を説明しうる。実際に、本発明者らは、ブラディゾイトを囲むPVMをカバーするGalNAcα1-Ser/Thrオリゴ糖に結合するレクチンである、ジャカリン(Jacaline)結合タンパク質と同時精製されたBCLAを示す予備的なインタラクトームデータを有する(データは示さず)(Tomita et al., 2017)。さらなる研究が、この相互作用がBCLA欠損媒介性の特異な表現型に関与するか否かを確証するために必要とされる。
感染の経路及び感染時期に関係なく、マウスにおいて明確なBCLA関連の表現型を有さないため、本発明者らは、免疫原性の役割を果たすBCLAの傾向に関する本発明者らの研究を方向づけた。本発明者らは、従って、この抗原が血清学にとって興味深いことが判明した場合において、血清テストを標準化し、製造コストをある程度まで低下させる機会を提供する高い程度の純度を伴う組換えタンパク質としてrBCLAを産生することにより、別のマイルストーンに達する。実際に、本発明者らは、rBCLAが抗原性であり、抗TゴンディIgGの検出のための優れた抗原候補を慢性的に感染されたマウスにおいて構成することを裏付ける強力なデータをもたらした。際立ったことに、本発明者らは、抗原rBCLAの血清中での強い検出及びII型嚢胞形成株により潜伏感染された全てのマウスの脳における嚢胞負荷を明確に相関させた。同様の試験によって、MAG1抗体レベルが脳嚢胞の負荷と相関しているが、しかし、それらの実験設定は、急性段階の間にタキゾイトの増殖を制御し、動物の死を回避するための抗Tゴンディ化学療法を要求する慢性I型(GT1)感染の無関係なモデルの使用によりいくらか偏っていると主張されている(Xiao et al., 2016)。
注目すべきことに、rBCLAはIgMにもIgA(急性感染に頻繁に関連付けられるマーカー)にも反応しなかったが(データは示さず)、しかし、IgGとだけ、及び独占的に亜慢性感染において反応した。この結果は、組織嚢胞を与えられたマウスが10日目に有意なIgM応答を示したという観察(Doskaya et al., 2018)と明らかに対照的であり、感染の潜伏段階の間でのBCLAに対する体液性応答の考えを補強する。同様に、組織嚢胞を用いた強制経口投与により接種されたマウスは、急性感染の時にBCLAに対して向けられた抗体を産生しなかったが(図8c)、BCLAに対する宿主免疫応答が、一次感染の間での胃腸管内の摂取された寄生虫からのブラディゾイト及び嚢胞タンパク質の放出への最初の曝露に起因しなかったことを示している。これは、感染後の非常に早期に生じるBAG1及びMAG1に対する体液性応答とは鋭く対照的である(Di Cristina et al., 2004;Mun et al., 1999)。本発明者らの知見は、BCLA含有組織嚢胞への体液性免疫応答を示唆し、Tゴンディ嚢胞が、免疫特権部位、例えば脳及び骨格筋などにおいて主に見出されるという考えとは対照的である。慢性トキソプラズマ症の間での体液性免疫応答の寄与を解明することは、マウスにおけるさらなる試験を要求しうるが、恐らくは、BCLAがこれらの過程を試験するための優れたツールになる。
最後に、抗rBCLA抗体は、免疫抑制又は先天性トキソプラズマ症に関連づけられるトキソプラズマ症の再燃の間に、トキソプラズマ再燃に続く眼トキソプラズマ症を伴う患者からの一部のヒト血清中で検出されている。これらの知見は、rBCLAが、慢性的に感染された宿主における組織嚢胞の存在の素晴らしい血清マーカーになるという、マウスモデルから引き出された結論と一致している。
実施例2(VHH産生)
免疫化
ラマSEL005及びSEL006を、0、14、28、及び35日目に4回の注射を介して、Eurogentecを介して免疫した。血清を0日目、28日目、及び43日目に得た。末梢血単核細胞(PBMC)を43日目に大量採血から得た。
免疫応答
SEL005及びSEL006の免疫応答を、43日目の血清中のrBCLA特異的抗体の存在を評価することによりテストした。MaxiSorpプレートを4℃で一晩、ウェル当たり200ngの抗原でコーティングした。0.05%Tween-20を含むPBSで3回洗浄した後、プレートをPBS(MPBS)中の4%粉乳でブロックした。次に、1%MPBS中での血清の段階希釈液をウェルに加え、1時間インキュベートした。非結合抗体を、PBS-Tweenでの洗浄の間に除去した。その後、結合抗体を、ウサギ抗VHH(クローンK1216)及びHRPに結合されたロバ抗ウサギで検出した。抗体結合を、490nmでのH2O2の存在におけるO-フェニレンジアミン(OPD)の比色反応により定量化した。ラマSEL005及びSEL006はHis rBCLAに対して非常に良好な応答を示す。
SEL005、43日目及びSEL006、43日目のライブラリー構築。
RNA単離及びcDNA合成
末梢血リンパ球を43日目に大量採血から単離し、そこからRNAをEurogentecで単離した。沈殿したRNAをRNase不含MQ中に溶解し、RNA濃度を測定した。RNAの品質を評価するために、5μlの溶解したRNAをゲル上で分析した。図2Aは、インタクトな28S及び18S rRNAが明らかに目に見えることを示し、RNAの適切な完全性を示している。
約40μgのRNA(各々の10μgの4つの反応)を、逆転写酵素キット(Thermo Fisher Scientific)を使用してcDNA中に転写した。cDNAをMacherey Nagel PCRクリーンアップカラムで精製した。重鎖(従来型及び重鎖だけの両方)フラグメントの可変ドメインを、リーダー配列領域で及びCH2領域でアニーリングするプライマーを使用して増幅させた。5μlを、増幅の制御のために1%TBEアガロースゲル上にロードした。
この制御の後、サンプルの残りを1%TAEアガロースゲル上にロードし、700bpのフラグメントを切り出し、ゲルから精製した。合計80ngの単離されたPCR産物をネステッドPCR(最終容量800μl)用のテンプレートとして使用し、VHH遺伝子のいずれかの末端にSfiI及びEco91I制限部位を導入した。増幅されたVHHフラグメントを、Macherey Nagel PCR洗浄カラム上で洗浄し、120μl中に溶出した。溶出されたDNAを最初にSfiI、それに続くEco91Iで消化した。制限消化のコントロールとして、4μlのこの混合物を1.5%TBEアガロースゲル上にロードした。
制限消化後、サンプルを1.5%TAEアガロースゲル上にロードした。400bpのフラグメントをゲルから切り出し、Machery Nagelゲル抽出カラムで精製した。精製された400bpVHHフラグメント(~330ng)をpUR8100ファージミドベクター(~1μg)中にライゲーションし、TG1大腸菌中に形質転換した。
ライブラリーサイズ
形質転換されたTG1を、10倍希釈液を使用して滴定した。5μlの希釈液を、100μg/ mlのアンピシリン及び2%グルコースを添加したLB寒天プレート上にスポットした。形質転換体の数を、形質転換されたTG1培養物のスポット希釈液から算出した(形質転換の最終容量は8mlであることを覚えておく)。形質転換体の総数及び、それにより、ライブラリーのサイズを、最も高い希釈液中のコロニーを数え、以下の式を使用することにより算出した:
ライブラリーサイズ=(コロニーの量)*(希釈液)* 8(ml)/0.005(ml;スポット容量)
ファージミドベクターのVHH挿入頻度は、24の異なるクローンを選び、コロニーPCRを実施することにより決定した。~700bpのバンドは、成功裏にクローン化されたVHHフラグメントを示す。~300bpのバンドは、空のプラスミドを示す。ライブラリーSEL005、43日目についての挿入頻度は100%である。ライブラリーSEL006、43日目について、挿入頻度はほぼ95%であり(図4)、それはファージパニング選択を継続するのに十分である。
ファージ産生及び選択。
ファージを、以下に概説するようにライブラリーから産生させた:ライブラリーSEL005、43日目及びSEL006、43日目を含む大腸菌 TG1を、2%グルコース及び100μg/mlアンピシリンを含む2×YT培地中で0.05のOD600までグリセロールストックから希釈した。この接種物中での細菌の数は、少なくとも10×ライブラリーサイズであった(接種物中の>109個細菌)。この培養物を37℃で2時間培養し、~0.5のOD600に達した。その後、約7mlの培養物を、37℃で30分間静置させ、100のMOI(多重感染度)を使用してヘルパーファージVCS M13で感染させた。感染された細菌をスピンダウンし、アンピシリン(ファージミドについては100μg/ml)及びカナマイシン(M13ファージについては25μg/ml)の両方を添加された50mlの新鮮2×YT培地中に再懸濁し、37℃で一晩振盪しながら増殖させた。産生されたファージを、PEG-NaCl沈殿を使用して培養物の上清から沈殿させた。産生されたファージの力価を、ファージの段階希釈及び大腸菌TG1の感染により算出した。産生されたファージの力価は、それぞれSEL005、43日目について3×1011/ml及びSEL006、43日目について6×1011/mlであったが、それらは選択を伴い継続するために十分であった。
第1ラウンドのパニング/選択のために、20μlの沈殿したファージ(~1010ファージ、ライブラリーの多様性の>100倍である)を、His rBCLAでコーティングされたウェルに適用した。手短には、100μlの抗原をMaxiSorp上に2つの濃度、5μg/ml及び0.5μg/mlで一晩コーティングした。陰性コントロールとして、1つのウェルをPBSだけでインキュベートした。非結合抗原の除去後の次の日、プレートをPBSで3回洗浄し、PBS中の4%粉乳(MPBS)でブロックした。同時に、新鮮に沈殿されたファージを2%MPBSで30分間プレブロックした。プレブロックされたファージを、直接的にコーティングされたHis rBCLAと2時間インキュベートした。大量のPBS-Tween及びPBSによる洗浄の際に、結合されたファージを0.1M TEA溶液で溶出し、それを、その後、1M Tris/HClpH7.5で中和した。溶出されたファージを段階希釈し、次にTG1細菌に感染させるために使用し、2%グルコース及び100μg/ mlアンピシリンを添加したLB寒天プレート上にスポッティングし、37℃でインキュベートした。
第2ラウンドの選択のために、新たなファージを、5μg/ mlのHis rBCLA(最も高い濃度)での選択からのレスキュー産出物から産生した。一晩増殖させたレスキュー産出物を、2%グルコース及び100μg/ mlアンピシリンを添加した5mlの新鮮な2×YT培地中で100倍に希釈し、対数増殖期まで2時間増殖させた。その後、1μlのヘルパーファージVCSM13を加え、37℃で30分間インキュベートした。培養物を37℃で一晩ファージを産生させた。産生されたファージを、PEG-NaCl沈殿を使用して培養物の上清から沈殿させた。
その後、2回目のパニング/選択のために、1μlの沈殿されたファージを、以下に示すように、His rBCLAでコーティングされたウェルに適用した:抗原をMaxiSorpプレート上に3つの濃度(5μg/ ml、0.5μg/ ml、及び0.05μg/ml)で一晩コーティングした。陰性コントロールとして、1つのウェルをPBSだけでインキュベートした。次の日、非結合抗原の除去後、プレートをPBSで3回洗浄し、4%MPBSでブロックした。同時に、新鮮に沈殿されたファージを、上に記載するように2%MPBS中で30分間プレブロックした。プレブロックされたファージを、直接的にコーティングされたHis rBCLAと2時間インキュベートした。PBS-Tween及びPBSでの広範な洗浄時に、結合されたファージを0.1M TEA溶液で溶出し、その後、1M Tris /HClpH7.5で中和した。溶出されたファージを段階希釈し、次にTG1細胞に感染させるために使用し、2%グルコース及び100μg/ mlアンピシリンが添加されたLB寒天プレート上にスポッティングし、37℃で一晩インキュベートした。
2ラウンドのファージディスプレイ選択後のスクリーニング。
His rBCLAでの第2ラウンドの選択のレスキュー産出物を、単一クローンを選ぶために、プレートアウトした。マスタープレートERB-1については、合計92の単一クローンを96ウェルプレート中に選んだ。
His rBCLAバインダーについてのマスタープレートERB-1をスクリーニングするために、モノクローナルVHHを含むペリプラズム抽出物を産生した。このマスタープレートを、2%グルコース及び100μg/mlアンピシリンで添加された2×YT培地中で、37℃で培養し、最終濃度20%までのグリセロールの添加後、-80℃で保存した。ペリプラズム抽出物の産生のために、マスタープレートERB-1を0.1%グルコース及び100μg/mlアンピシリンが添加された1mlの2×YT培地を含むディープウェルプレート中に複製し、VHH発現の誘導のために1mM IPTGを加える前に、37℃で3時間増殖させた。VHH発現を室温で一晩行った。ペリプラズム抽出物を、遠心分離、120μlのPBS中へのこのペレットの再懸濁、及び1回の凍結融解サイクルにより細菌を収集することにより調製した。細菌を遠心分離し、VHHを含む可溶性ペリプラズム画分を細胞破片(ペレット)から分離した。ELISAによりモノクローナルVHHの結合特異性をテストするために、His rBCLA(PBS中100ng/ウェル)を4℃でMaxiSorpプレート上に一晩コーティングした。コーティングされたプレートを洗浄し、その後、4%MPBSを使用してブロックした。ブロックされたウェルを、10μlのペリプラズム抽出物及び40μlの1%MPBSと室温で1時間インキュベートした。未結合VHHを、0.05%Tween-20を含むPBSで洗浄することにより除去した。その後、結合VHHを、ウサギ抗VHH(クローンK976)及びHRPに結合されたロバ抗ウサギで検出した。VHHの結合を、490nmでのH2O2の存在におけるOPDの比色反応により定量化した。マスタープレートERB-1の全てのクローンが、His rBCLAに特異的に結合することができた。使用された2つのライブラリーの間に差はない。
His rBCLA結合VHHの配列分析
ELISAの結果に基づき、17のクローン(ERB-1A1、ERB-1F1、ERB-1A2、ERB-1E2、ERB-1F2、ERB-1G2、ERB-1B3、ERB-1H4、ERB-1A5、ERB-1G6、ERB -1D7、ERB-1F7、ERB-1G8、ERB-1E9、ERB-1E10、ERB-1B11、及びERB-1A12)を配列決定のために選択した。これらのクローンはELISAにおける結合に基づいて選ばれたが、異なる産出物より選択されたクローンの大部分を表すはずである。
His rBCLAで選択されたVHHのクローニング及び産生。
シーケンスされた全てのクローンから、7つのクローン(ERB-1F1、ERB-1F2、ERB-1H4、ERB-1G6、ERB-1D7、ERB-1B11、及びERB-1A12)を見出されたVHH配列の良好な代表として選んだ。これらのVHHを次に、SfiI及びEco91I制限酵素を使用してファージミドベクターから発現ベクターpMEK222中にサブクローニングした。pMEK222中への再クローニングによって、また、VHHのC末端にFLAG及びHisタグが加えられ、検出及び親和性精製が可能になる。産生のために、前培養物を、選択されたVHHを伴うプラスミドを含む細菌を、2%グルコース及び100μg/mlアンピシリンが添加された8mlの2×YT培地中で、37℃で一晩増殖させることにより調製した。この前培養物を、37℃で予熱し、100μg/mlアンピシリン及び0.1%グルコースが添加された800mlの新鮮な2×YT中に希釈した。細菌を、1mM IPTGを用いたVHH発現の誘導前に、37℃で2時間増殖させた。このVHHを37℃で4時間発現させ、細菌を遠心分離により回収した。細菌ペレットを30mlのPBS中に再懸濁し、-20℃で凍結した。
VHHの精製及び分析。
凍結された細菌ペレットを室温で解凍し、細胞破片を遠心分離によりスピンダウンした。VHHを、コバルト帯電セファロースビーズに対するHisタグの親和性(TALONビーズを使用した固定化金属親和性クロマトグラフィー(IMAC))を使用し、上清(可溶性画分)から精製した。結合VHHを150mMイミダゾールで溶出し、PBSに対して透析した。
タンパク質濃度を、280nmでの吸光度を使用して測定し、モル吸光係数及び異なるVHHの分子量に従って補正した。
品質チェックとして、1μgの精製VHHをSDS-PAGE上にロードした。
固定化されたHisrBCLAへの精製VHHの結合をELISAにより分析した。MaxiSorpプレートをPBS中で、4℃で一晩200ng/ウェルの抗原でコーティングした。ウェルを4%MPBSでブロックした後、VHHの段階希釈液を、コーティングされたウェルに加え、室温で1時間インキュベートした。非結合VHHを洗浄した後、結合VHHを、HRPに結合されたマウス抗フラグ(クローンM2)及びロバ抗マウスを使用して検出した。結合を、490nmでOPD+H2O2の比色反応を測定することにより定量化した。ERB-1G6、ERB-1B11、及びERB-1A12は、固定化されたHis rBCLAへのナノモル以下の見掛け上の親和性を示す。ERB-1F1及びERB-1F2は低いナノモル親和性を示す。ERB-1H4及びERB-1D7は、His rBCLAへのモルの見掛け上の親和性を示す。
結論
ラマSEL005及びSEL006の免疫化は、良好な免疫応答をもたらした。生成されたライブラリーは、良好なサイズ及び挿入頻度であった。His rBCLAでのファージディスプレイ選択によって、多くの良好なクローンがもたらされ、そのうち3つ(ERB-1G6、ERB-1B11、及びERB-1A12)は非常に良好な明らかな親和性を示し、ERB-1G6がまた、大腸菌において高い産生レベルを示す。
実施例3:
現在の縦断試験において、本発明者らは、BCLA抗体の検出が、適切に組み合わされた場合、現在のテストの感度をおそらく促進できることを意味する。本発明者らは、母子先天性トキソプラズマ症の関連においてBCLAのテストを経験している。当面は、母/子の群当たり10組のカップルだけがテストされたが、そのため、結果はそれに従って考慮すべきである。2つの群を比較するが、1つは、先天性トキソプラズマ症が出生後ずっと子供の血清中での持続的なSag1 IgG力価を通じて確認されたが、他は、先天性トキソプラズマ症が子供の血清が経時的にSag1に対して陰性になった場合に除外された(Lebech M et al., 1996)。
Vidas(登録商標)及びArchitect(登録商標)によるToxo IgGの比較滴定により示されるように、出生時に、両方の群における乳児は、識別可能なプロファイルを伴わない同等の力価を共有する(図15C-D)。これは、母親が抗Sag1 IgGを、胎盤バリアを通じて伝達するという事実により説明され、従って、決定的な生物学的結論は出生時に不可能である。BCLA ELISA滴定を見る場合、先天性トキソプラズマ症と除外された先天性トキソプラズマ症の間の分別はより明確になっている。出生時の子供の血清は、彼らの母親の又は除外された先天性トキソプラズマ症群の血清よりもはるかにより反応性のBCLA滴定を呈示する(図15A-B)。
この観察は、子供が出生前に抗BCLA IgGを特異的に新合成することを意味し、強いBCLA反応性によって出生時の先天性トキソプラズマ症の診断をさらに方向付けることができることを示す。
参考文献:
本願を通して、種々の参考文献によって、本発明が関係する最新技術が記載されている。これらの参考文献の開示は、参照により本開示中に組み込まれる。